肺炎支原体肺炎患儿黏液栓形成原因分析
路素坤,刘建华*,帅金凤,王 乐,杨会荣,吕文山,黄坤玲,曹丽洁
肺炎支原体(mycoplasma pneumoniae,MP)是儿童社区获得性肺炎(community-acquired pneumonia,CAP)的重要病原体之一[1-4],部分MP感染患儿可无临床表现或仅有轻微上呼吸道感染症状,另一些则可发展为肺炎,甚至出现致死性肺部感染[5-6]。近年来,重症与难治性MP肺炎比例增高,有研究指出支气管黏液栓可能成为MP肺炎治疗困难的重要因素之一[7-10],部分可发展为塑型性支气管炎而危及生命[11],少部分可遗留支气管扩张、肺不张、闭塞性支气管炎等后遗症[12]。而对于MP肺炎黏液栓形成的原因,临床尚不明确。本文旨在分析MP肺炎黏液栓形成与MP菌量、混合感染的相关性,为改善患儿预后提供参考。
1 对象与方法
1.1 研究对象 纳入标准:(1)小儿肺炎符合《诸福棠实用儿科学》[13]诊断标准;(2)胸部影像学表现呈肺叶或节段性大片密度增高影,有行支气管镜检查及支气管肺泡灌洗指征,并得到患儿父母或其他监护人知情同意;(3)MP感染的诊断:应用颗粒凝集(particle agglutination,PA)方法检测血清MP抗体滴度≥1∶160或对比2次MP抗体滴度增高4倍以上;(4)不伴其他基础疾病。选取2014年6月—2015年12月河北省儿童医院收治的MP感染所致肺实变患儿87例,其中男38例,女49例;年龄10个月~11岁。本研究获得河北省儿童医院伦理委员会同意。
1.2 方法
1.2.1 支气管镜操作方法 术前禁食、禁水6 h。采用日本OLYMPUS CV.260(2.8 mm)或FUJINON EB.270P(3.6 mm)电子支气管镜,根据患儿年龄选择合适尺寸,采取边麻醉边进镜,依次观察鼻腔、声门、气管,逐级观察支气管结构、支气管黏膜情况,若有黏液栓,则确定阻塞部位,并用0.9%氯化钠溶液灌洗,堵塞严重者使用异物钳或细胞刷将黏液栓清出呼吸道。另外,收集病变部位支气管肺泡灌洗液(BALF)4 ml。根据支气管镜下表现,将患儿分为黏液栓组(34例)和非黏液栓组(53例)。
1.2.2 MP菌量 患儿入院次日清晨抽取静脉血2 ml,进行MP抗体检测,若检测为阴性,但临床高度怀疑MP感染,则病程10 d左右再次进行MP抗体检测。取BALF 2 ml,采用实时荧光定量聚合酶链式反应(FQ-PCR)检测MP-DNA,应用PE5700型基因检测系统进行PCR扩增及数据处理,PCR循环条件:95 ℃预变性3 min,94 ℃变性15 s,60 ℃退火30 s,60 ℃延伸30 s,共40个循环。根据基因拷贝数分为低菌量(≤106/ml)和高菌量(≥107/ml)。
1.2.3 细菌培养 婴幼儿采用无菌负压吸引法采集痰标本,年长儿晨起漱口后用力咳出痰,并取2 ml BALF用于细菌培养。将痰标本用0.9%氯化钠溶液稀释成悬液后分别接种于血平板和含万古霉素的巧克力平板,纯培养结果或优势菌生长判定为阳性。BALF原液和用0.9%氯化钠溶液稀释10、100倍的BALF溶液分别接种于血平板上进行定量培养。将接种好的血平板置于5%CO2培养箱中35 ℃培养18~24 h。定量培养菌落≥104cfu/ml为阳性。
1.2.4 病毒检测 采用痰培养检测呼吸道病毒。利用GeXP多重基因表达分析系统(GenomeLab Genetic Analysis System)联合多重反转录-聚合酶链反应(mRT-PCR)方法同时检测鼻病毒、呼吸道合胞病毒、腺病毒、偏肺病毒、博卡病毒、甲型流感病毒、乙型流感病毒、总甲型流感病毒H1、甲型流感病毒H3、甲型流感病毒N2、甲型流感病毒H5N1、副流感病毒1型、副流感病毒2型、副流感病毒3型、季节性流感病毒N1、季节性流感病毒H1N1、人冠状病毒HKUI/OC43型、人冠状病毒NL63/229E型、非典型性冠状病毒、猪流感病毒等呼吸道病毒,具体过程参考文献[14]。
1.3 统计学方法 采用SPSS 17.0软件进行统计学分析,符合正态分布的计量资料以(s)表示,两组间比较采用独立样本t检验;计数资料的分析采用χ2检验;采用多因素Logistic回归分析黏液栓形成的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较 两组性别、年龄、行纤维支气管镜时病程比较,差异均无统计学意义(P>0.05)。黏液栓组高菌量比例高于非黏液栓组,差异有统计学意义(P<0.05,见表1)。
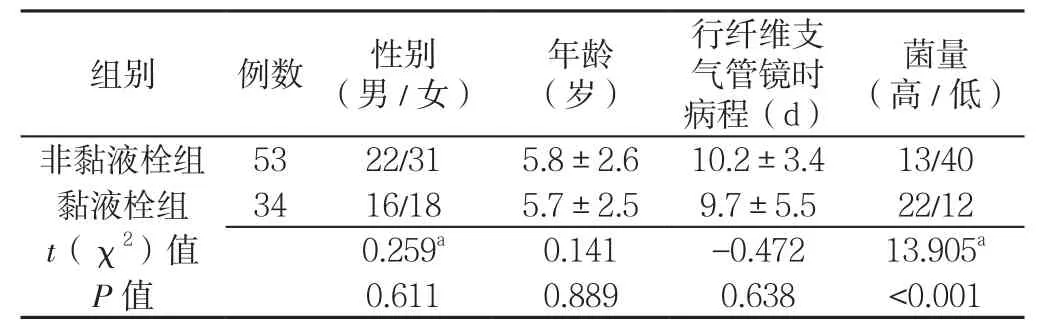
表1 两组患儿一般情况及菌量比较Table1 Comparison of the general situation and the MP load between the two groups
2.2 混合细菌感染 非黏液栓组检出混合细菌感染6例(11.3%),其中肺炎链球菌3例,流感嗜血杆菌2例,大肠埃希菌1例;黏液栓组检出混合细菌感染7例(20.6%),其中肺炎链球菌3例,流感嗜血杆菌2例,卡他莫拉菌1例,肺炎克雷伯菌1例。两组混合细菌感染率比较,差异无统计学意义(χ2=1.400,P>0.05)。
2.3 混合病毒感染 非黏液栓组检出混合病毒感染11例(20.8%),其中鼻病毒4例,呼吸道合胞病毒3例,副流感病毒3型2例,乙型流感病毒1例,腺病毒1例;黏液栓组检出混合病毒感染18例(52.9%),其中鼻病毒4例,呼吸道合胞病毒3例,副流感病毒3型3例,腺病毒2例,甲型流感病毒2例,博卡病毒1例,偏肺病毒1例,鼻病毒混合偏肺病毒1例,呼吸道合胞病毒混合乙型流感病毒1例。黏液栓组混合病毒感染率高于非黏液栓组,差异有统计学意义(χ2=9.656,P=0.002)。
2.4 多因素Logistic回归分析 以性别、年龄、行纤维支气管镜时病程、菌量、混合细菌感染、混合病毒感染为自变量,以是否有黏液栓形成为因变量行多因素Logistic回归分析。结果显示,高菌量是MP肺炎患儿黏液栓形成的危险因素(P<0.05,见表2)。
3 讨论
支气管黏液栓是由支气管黏膜的炎症、坏死、出血及支气管黏液分泌异常而致黏液排除障碍,导致黏液在支气管内积聚、结块而形成,于1951年由美国SHAW首次报道[15]。有研究认为,黏液栓的形成是MP肺炎气道黏膜损害进展的重要表现,可造成气道通气不良,若无有效治疗,支气管通气不良可能不可逆转[16]。MP感染损害支气管上皮细胞和纤毛,存在黏膜坏死以及黏液高分泌[17],与急性期肺不张及继发性支气管扩张、闭塞性支气管炎、闭塞性细支气管炎等后遗症有关,但对于气道黏膜损害的轻重原因临床报道甚少。

表2 MP肺炎患儿黏液栓形成危险因素的多因素Logistic回归分析Table2 Multivariate Logistic regression analysis of the risk factors of airway mucus plug formation in children with MP pneumonia
有研究指出,不同年龄患儿肺部损伤机制可能不同,婴幼儿感染MP体内产生的特异性抗体水平低,MP肺炎肺损伤机制可能与MP的直接损伤有关,MP的终末代谢产物过氧化氢可直接损伤呼吸道上皮细胞,导致纤毛运动停滞、脱落消失,最终导致上皮细胞溶解坏死[18]。而学龄儿童MP肺炎发病机制可能与免疫介导的肺损伤有关。切除胸腺的小鼠在感染MP后,其肺部的炎症较对照组减轻[19]。本研究两组患儿性别、年龄比较,差异并无统计学意义,说明黏液栓的形成可能与患儿性别、年龄无关。但本研究均为胸部影像学表现呈肺叶或节段性大片密度增高影患儿,研究对象有一定的局限性,因此不能代表不同年龄段患儿的病情。
近年来,有关于MP肺炎患儿气道黏液栓形成的危险因素的报道较少,但其结论仅从患儿热程、合并胸腔积液、C反应蛋白、乳酸脱氢酶等临床表现、生化指标方面阐述[20],结合本研究前期总结的分泌物堵塞呼吸道的儿童MP肺炎临床特征[21],认为上述结论仅是MP肺炎合并黏液栓形成患儿的临床表现,并不是黏液栓形成的原因。有基础研究报道,MP可通过其代谢产物、毒素损害局部组织,同时又可能诱发局部炎症与免疫反应损害机体[18],所以MP肺炎患儿局部菌量与黏液栓的形成可能存在一定的相关性。本研究两组患儿行支气管镜肺泡灌洗术时的病程无差异,提示局部BALF中MP菌量与黏液栓的形成相关。
有研究认为,混合感染可加重MP肺炎患儿病情,也有MP肺炎混合感染致患儿死亡的报道[22]。本研究显示,MP肺炎混合细菌感染中以混合肺炎链球菌感染最为常见,但并未显示混合细菌感染与黏液栓形成有关,不能排除与样本量小,细菌培养阳性率低等因素有关。而本研究单因素分析显示,混合病毒感染与MP患儿黏液栓形成有关,混合病毒感染中,以呼吸道合胞病毒、鼻病毒、副流感病毒3型常见。有研究指出,肺部疾患常存在细菌、病毒、真菌等感染,气道黏液过度分泌,分泌物黏稠不能被有效清除,可能是肺部疾病伴发塑型性支气管炎的重要机制[23],本研究结果与该报道一致。
综上所述,MP菌量、混合病毒感染可能是MP肺炎患儿黏液栓形成的高危因素。通过本研究,初步了解MP肺炎患儿黏液形成的相关因素。伴有黏液栓形成的MP肺炎患儿在抗感染、对症治疗基础上,及时行支气管镜解除呼吸道阻塞对减轻高热等症状、促进肺复张、减少后遗症的发生有重要意义。本研究为临床医师早期、合理治疗MP肺炎提供了参考依据。
作者贡献:路素坤、刘建华进行文章的构思与设计、研究的实施与可行性分析、结果的分析与解释,对文章整体负责,监督管理;帅金凤、杨会荣、吕文山进行数据收集;吕文山、黄坤玲、曹丽洁进行数据整理;路素坤、王乐进行统计学处理;路素坤撰写论文;刘建华进行论文的修订;刘建华、帅金凤负责文章的质量控制及审校。
本文无利益冲突。

