百草枯致SD大鼠中毒生理研究
刘传志,汪路涵,王越,赵天阔,侯玥
(长春理工大学 生命科学技术学院,长春 130022)
百草枯化学名称是1-1-二甲基-4-4-联吡啶阳离子盐,是一种快速灭生性除草剂,对人毒性极大,一般LD50为20mg/kg,且无特效解药。市面上多为百草枯20%紫蓝色溶液,此类产品成人致死量为5-15ml/kg[1]。目前,国内外对于百草枯的致病机理尚不明确,而且没有有效降低毒性的治疗手段[2-4]。虽然我国已对百草枯的生产做出控制和销售资质的管理,但每年仍有因百草枯或其类似物而中毒的患者,出现严重的病发症甚至危及生命。因此,研究百草枯导致脏器损伤的机制就显得十分重要。现有证据表明百草枯对身体各个脏器都有毒性,其毒性是通过产生自由基而导致破坏作用的[5-7]。
前人有报道称百草枯毒性的主要靶器官是肺,是依赖多胺摄取系统积聚浓度,发生氧化还原循环途径产生大量促氧化剂反应性物质[8,9]。由于在肺泡中I、II型细胞和细支气管细胞膜上多胺转运系统的大量表达,肺组织的百草枯浓度要比血浆高出6-10倍。造成肺纤维化,使肌成纤维细胞(MFb)活化增生[10,11],进一步导致肺表面活性剂系统的功能异常所致。同时巨噬细胞释放炎性因子如:TNF-α、IL、IFN-γ、磷脂酶(PLA2)等。使巨噬细胞发生组织内聚、亲润、活化,自由基释放增加,正反馈性加剧组织损伤。Takeyama等人[12]用人肺上皮样细胞系L123进行体外实验,发现百草枯可导致DNA细胞结构破坏,组织细胞从G1期进入S期。此外,研究人员还发现,线粒体内膜脂质过氧化反应,造成线粒体功能障碍,并能诱导体外肺细胞A549肌动蛋白骨架破坏,膜通透性改变,线粒体内膜异常去极化,解偶联和基质肿胀造成细胞凋亡。同时百草枯对细胞通路还有很大的影响,丝裂素活化蛋白激酶(MAPKs)通路、核因子κB(NF-κB)通路、氧化应激反应等。临床上误服百草枯可导致口腔、舌咽及胃、食道粘膜糜烂溃疡,有时还伴有发热呕吐、呼吸困难等表现。本文旨在探究不同剂量百草枯对大鼠血液各项指标的影响以及对大鼠各脏器器官的病变状况,借此分析百草枯对大鼠的生理性毒性和免疫功能的损伤,为进一步揭示百草枯或其类似物的致毒机理提供实验依据。
1 实验材料
1.1 实验动物制备
SD大鼠购于吉林大学实验动物中心,编号2017000185550。6-7周雌性,共20只,分为4组,每组5只,第5组为对照组。标准颗粒饲料,给水充足,饲养在长春理工大学生命科学技术学院动物房。
百草枯溶液:1.0mg/mL、0.5mg/mL、0.1mg/mL的各100ml。每日晚18时向实验组大鼠分别灌胃剂量为:0.1mg、0.5mg、1.0mg的百草枯,连续灌胃7天,同时向对照组灌胃等计量的生理盐水。
1.2 仪器及耗材
百草枯(江苏省南京市红太阳生物化学有限责任公司)、Leica石蜡切片机(德国 1850 UV)、FV1000型Olympus激光共聚焦显微镜、5810R型低温高速离心机、HH-501A型超级恒温水浴、LR40型制冰机、CX31-12C02型Olympus显微镜、多聚甲醛、无水乙醇、明胶、苏木素、二甲苯、Tunel染色试剂盒(碧云天 C1086)、血常规使用全自动血液分析仪和EDTA抗凝采血管(长春理工大学校医院)。
2 实验方法
2.1 大鼠悬尾实验
将大鼠移入实验室适应30min,在大鼠尾端胶带固定,使大鼠头向下悬挂,并注意避免机械性损伤,悬挂台使大鼠离桌面30cm的悬挂点,由观察者分别记录各组大鼠的放弃挣扎时间,并记录数据平均值用于统计。用于统计百草枯对大鼠情绪抑郁性状态、比较大鼠体能变化,揭示药物对大鼠的行为活动造成的影响。数据采用mean±SD表示,以P<0.05为差异有统计学意义。
2.2 大鼠血常规
大鼠采用心脏穿刺采血,储存于EDTA抗凝采血管内,将收集到的各组大鼠血液标记,充分混匀后,送至校医院分析化验。各项数据以mean±SD表示,各组间的差异显著性采用SPSS 13.0 for Windows统计软件进行分析SD大鼠常见血液学检测指标参考范围参照文献[12].
2.3 大鼠脏器检测
取实验组SD大鼠肺、肾、肝、脾处器官检测细胞凋亡情况,将取出的组织,剪切成2×2×2mm3的小块,经放置于多聚甲醛浸泡48h,样本浸泡流水冲洗30分钟去除组织中的固定液。然后浸泡在50%、75%、无水乙醇脱水。包埋样品托上涂一层OCT包埋胶,4℃冰箱预冷5min,让OCT胶浸透组织。样品速冻架速冻,组织置于样品托上,其上再添一层OCT胶,冷冻30min。恒温冰冻切片机切片,切薄片至6-8μm。切片时,低温室内温度以-15℃~-20℃为宜,温度过低组织易破碎,抗卷板的位置及角度要适当,载玻片附贴组织切片。切好室温放置30min后,晾干。PBS溶液洗5min×3。封闭BSA蛋白、进行Tunel染色,显微镜观察,分析取样组织器官的细胞凋亡情况,借以评估百草枯中毒致大鼠肺、肾、肝、脾器官损伤情况。
3 结果与讨论
3.1 大鼠悬尾实验结果
将连续7天灌胃有百草枯的大鼠进行悬尾实验观察,计时6min后停止,对大鼠后4min的不动时间进行统计。不动时间最短的是1组,即对照组,为(35.0±3.2)s,不动时间最长的是第三组为(165.0±19.2)s。统计结果表明:百草枯使得大鼠明显虚弱,且浓度越大的药液造成的损伤更为严重,引发大鼠体力下降,情绪低落,兴奋性降低。且在对SD大鼠观察中发现高浓度给药组大鼠呼吸剧烈,胸腔起伏明显。这提示百草枯可能对大鼠肺部造成损伤。

表1 大鼠悬尾实验结果
3.2 大鼠血常规检测结果
将连续7天灌胃有百草枯的大鼠,心脏穿刺采血,送至校医院进行血常规检验。随着灌胃百草枯溶液的浓度和剂量的加大,其中白细胞、单核细胞数的下降、淋巴细胞增加表明机体免疫功能遭到损害,伴有严重的炎症反应,大鼠腹腔内积液较多,胸腔水肿并有浑浊腔液,尤其以1.0mg/D组最为明显。

表2 SD大鼠血常规检测主要部分指标(第三组)
3.3 大鼠脏器检测结果
将连续7天灌胃有百草枯的大鼠,取大鼠肺、肝、肾、脾等组织,冰冻切片处理,进行Tunel染色,检测细胞凋亡情况。实验采用碘化丙啶(propidine iodide,PI)核酸染料,不能透过完整的细胞膜,在凋亡中晚期的细胞和死细胞,能够透过细胞膜而使细胞核红染。生凋细胞,基因组DNA开始断裂,暴露的3'末端羟基,可以在脱氧核苷酸转移酶催化下加上绿色荧光探针荧光素(FITC)标记的dUTP。

图1 第三组肺凋亡染色结果

图2 第一组肺凋亡染色结果

图3 第三组肝凋亡染色结果

图4 第一组肝凋亡染色结果
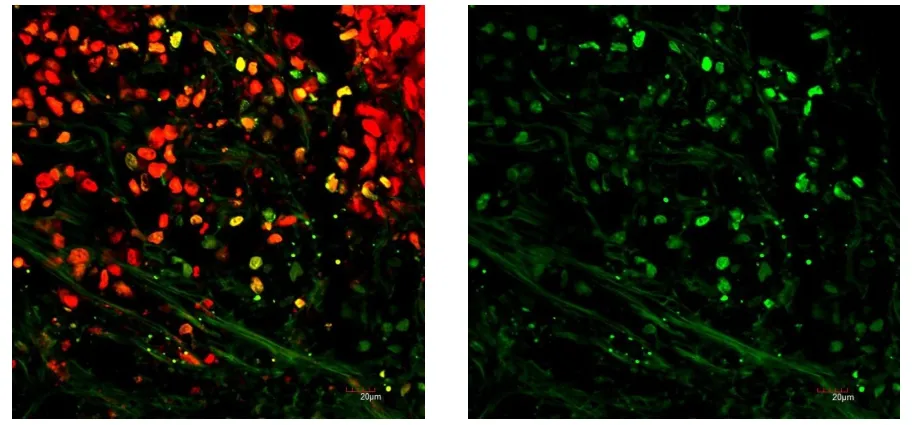
图5 第三组脾调亡染色结果

图6 第一组脾凋亡染色结果

图7 第三组肾凋亡染色结果
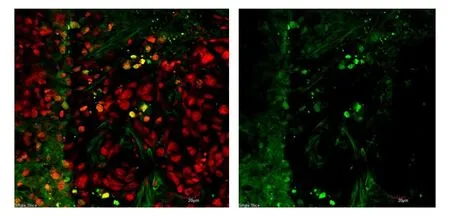
图8 第一组肾凋亡染色结果
从上述凋亡染色实验结果显示:第三组,大鼠肺脏出现大量的死亡细胞,而凋亡的细胞相对较少,但却有大量的细胞处于凋亡状态。在肝脏、脾、肾等脏器的IHC检测中,在高剂量百草枯实验组中都发现有较多的细胞发生死亡,且肝细胞凋亡损伤较重。第一组低剂量百草枯大鼠肺细胞仅有部分死亡,且损伤相对较轻,但在肝、脾、肾等脏器细胞损伤大致相当,表明低剂量的百草枯对大鼠脏器有一定的伤害作用。总之连续七天灌胃1.0mg剂量的百草枯对大鼠肺部造成严重损害,其它脏器也损伤较重。连续七天灌胃0.1mg剂量的百草枯对肺部就能诱发肺细胞的凋亡,对肝、脾、肾等亦有不同程度伤害。
4 结论
本文采用连续七天不同浓度的百草枯溶液灌胃大鼠,构建百草枯中毒大鼠模型。通过大鼠悬尾实验、血常规检验、IHC组织切片实验,分析百草枯对大鼠制毒机制。实验表明连续七天灌胃1.0mg剂量百草枯大鼠体能下降严重,情绪抑郁,饮食量和活动性减少,对外界刺激敏感度下降。血常规分析血红细胞含量增多,血红蛋白增加,免疫相关细胞增多,提示大鼠免疫应答剧烈,出现炎症反应。IHC组织切片凋亡染色发现高剂量百草枯对大鼠肺部造成极其严重的损害,肺细胞大量死亡,几乎全部肺内组织发生细胞死亡,这与悬尾实验中第三组大鼠体力下降,呼吸急促相符,这一结果与前人研究相一致。同时高剂量百草枯对肝、脾、肾脏也产生了影响,出现不同程度的细胞出现凋亡现象。提示百草枯对大鼠肺细胞有明显的致死性,对肝、肾、脾等组织也有不同程度的损害。在0.1mg的剂量下可对大鼠造成不可逆性的伤害。综上所述,通过对大鼠灌胃百草枯农药,对其生理特征的研究提示,一旦误服百草枯农药,必须立即洗胃灌肠导泄持续胃肠减压,吸出胃液残留毒物,药物对肺部损伤将会产生严重的后果,中毒严重者只能换血或者肺纤维化后切除。针对百草枯对肺细胞的损伤,探究其损伤机制和代谢类型,开发相关抑制剂性药物或解毒制剂,将是未来主要研究方向。

