南蛇藤多萜对4种化疗药物增效作用的实验研究
陶 丽 刘延庆
(1.扬州大学医学院,江苏扬州 225001; 2.国家中医药管理局胃癌毒邪论治重点研究室,江苏扬州 225001)
化疗是目前治疗癌症最有效的手段之一,但针对肿瘤耐药后出现的疾病进展,临床尚无替代性的良策,给癌症治疗带来了严峻挑战。中医药以其独特的诊疗理论和方法在抗肿瘤治疗方面显示出巨大潜力。雷公藤是临床最为有效且运用最为广泛的中药之一,但其治疗窗较窄,课题组很早开始关注与雷公藤具有一定亲缘性的,功效接近的,但毒性相对温和的中药南蛇藤。南蛇藤(Celastrus orbiculatusThunb.)为卫矛科植物南蛇藤的藤茎,始载于清代《植物名实图考》,又名过山枫,具有祛风除湿、通经止痛、活血解毒等传统功效。课题组前期发现南蛇藤乙酸乙酯提取物是其体内外抗肿瘤与抗类风湿性关节炎活性的有效部位[1-4]。进一步通过活性追踪、化学分离与结构鉴定,课题组从该部位富集获得以五环三萜为主的南蛇藤多萜(the total terpenoids ofCelastrus orbiculatusThunb.,TTC)[5]。本研究观察了TTC对临床一线化疗药物的体外增效作用,并采用定量药理学模型进行评价,为南蛇藤在肿瘤治疗方面的进一步开发利用提供实验依据。
1 实验材料
1.1 细胞株 A549与H1299人非小细胞肺癌细胞株,购自中国科学院典型培养物保藏委员会细胞库,用含10%胎牛血清(FBS)的RPMI 1640培养基培养。
1.2 药物 南蛇藤多萜:南蛇藤购自广州致信药业,经中国药科大学中药资源研究室秦民坚教授鉴定为卫矛科南蛇藤属植物南蛇藤的藤茎。取南蛇藤茎药材10kg,加6倍量90%乙醇,浸泡1h,回流提取3次,每次2h,合并提取液,减压回收乙醇得浸膏(0.9kg),加水混悬,用石油醚萃取3次,再用乙酸乙酯萃取3次,分离乙酸乙酯层,加20%乙醇洗涤3次后将乙酸乙酯层减压浓缩干燥,获得南蛇藤多萜总部位220g。以乙酰齐墩果酸进行含量测定,其中获得二萜、三萜含量达71.2%(TTC制备工艺已获授权发明专利:200710025343.3)。TTC储存于4℃冰箱,临用前用DMSO溶解成100mg/mL的储液,用不含酚红的RPMI 1640无血清培养基稀释成实验浓度。紫杉醇注射液(福王):购自扬子江药业集团有限公司。注射用盐酸吉西他滨(泽菲):购自江苏豪森药业集团有限公司。注射用奥沙利铂(艾恒):购自江苏恒瑞医药股份有限公司。氟尿嘧啶注射液:购自天津金耀氨基酸有限公司。以上4种化疗药物用PBS稀释成100mg/mL的储液。
1.3 主要仪器与试剂 精密天平,纯水仪,倒置显微镜(Olympus,日本),EnspireTM多模式微孔板检测系统(PerkinElmer,美国),96孔细胞培养板(Nunc,美国),RPMI-1640培 养 基 与FBS(Gibco,美国),二甲基亚砜(DMSO)与3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT购自美国Sigma公司)。
2 实验方法
2.1 MTT法测定TTC单独或与化疗药物联合用药的细胞毒作用 将A549、H1299细胞以每孔1×104个细胞接种在96孔细胞培养板内,加入不同浓度TTC(12.5,25,50,100,200µg/mL)或化疗药物(0.01,0.1,1,10,100µg/mL)或溶剂对照(DMSO),或分别联合使用TTC与各化疗药物,处理48h后,每孔加入5mg/mL的MTT试剂20µL,37℃孵育4h后,小心吸弃上清,加入150µL/well DSMO溶解,酶标仪测定490nm吸光度,并计算相对细胞活力。
2.2 Combenefit定量药理学软件评价TTC与化疗药物的联用效果 采用英国癌症研究中心剑桥研究所开发的Combenefit定量药理学软件及Loewe相加模型评价2种化合物组合后潜在的药物相互作用[6]。测试时,2种药物的5种梯度浓度包括溶剂对照孔以矩阵模式混合。通过MTT测定每孔细胞的相对增长率所得响应值通过Combenefit软件使用以生成剂量-效应(D-R)响应矩阵以及协同分布矩阵,并导出可视化结果。
3 实验结果
3.1 TTC与4种化疗药物联合用药剂量确定 为了确定联合用药采用的剂量范围,实验首先研究了TTC与4种化疗药物单独使用对A549与H1299两种非小细胞肺癌细胞株的生长抑制活性,并采用作图软件GraphPad自带的Logistic非线性回归方程拟合量效关系曲线。结果发现TTC与4种化疗药物处理细胞48h后分别在12.5~200µg/mL与0.01~100µg/mL剂量范围内呈现典型的剂量依赖关系,其半数抑制浓度IC50值也基本分布在试验剂量范围的中间,此时IC50数据计算相对精确(见图1)。因此,在联合用药时,采用低于TTC自身IC50剂量(3.125,6.25,12.5,25,50µg/mL)与较宽范围的化疗药物给药剂量(0.01,0.1,1,10,100µg/mL)进行联合给药,观察低剂量TTC与化疗药物是否存在增敏作用,以及所增敏的化疗药物的剂量区间。
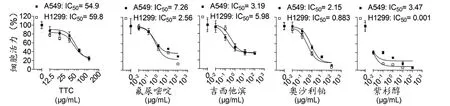
图1 TTC与4种化疗药物单独给药对非小细胞肺癌细胞株体外增殖的影响

图2 TTC与4种化疗药物联合给药对A549(A)与H1299(B)细胞体外增殖的影响
3.2 TTC与4种化疗药物联合用药效果分析 联合用药时,将5个梯度TTC剂量(3.125,6.25,12.5,25,50µg/mL)与5个梯度化疗药物(0.01,0.1,1,10,100µg/mL)连同溶剂对照(即0µg/mL)以矩阵混合的方式进行给药,因此共产生36种剂量组合。从Combenefit软件生成的两株细胞对联合用药的响应矩阵图可以看出,联合用药的量效关系呈现对角线分布(见图2)。Loewe相加定量药理学药物相互作用拟合的结果发现,TTC与4种化疗药物均能产生一定的协同作用。其中,TTC在接近IC50剂量(25~50µg/mL)下与高剂量(10~100µg/mL)的氟尿嘧啶产生协同,而在低于IC50剂量(3.125~25µg/mL)下与低剂量(0.01~10µg/mL)的吉西他滨、奥沙利铂、紫杉醇产生一定的协同(见图2)。因此针对后3种化疗药物,在采用低剂量的TTC对其产生增敏作用时,还允许使用更低的化疗药物剂量。
4 讨论
课题组前期针对多种消化道肿瘤充分证实南蛇藤提取物体内抗肿瘤作用的有效性和初步的安全性[1-3],因此明确南蛇藤未来在肿瘤治疗中的临床定位及能够体现其作用特点的应用价值对南蛇藤开发利用具有重要意义。我们注意到,临床上肿瘤患者首次接触化疗药物无效(固有性耐药)或者接受化疗一段时间内有效但再次进展时(继发性耐药)通常不再接受相同药物治疗且无法采取进一步可行性措施,此时若继续给予化疗药物治疗,同时给予中药治疗,可以重新获得化疗疗效,即所谓的肿瘤复敏(re-sensitization)[7]。这为肿瘤耐药患者的后续治疗生存带来一缕曙光,也为中药抗肿瘤治疗提供新的契机。
为了评价南蛇藤多萜能否对现代常规化疗产生潜在的增效作用,本实验采用3D可视化的定量药理学计算软件筛选南蛇藤多萜与化疗药物的联合效应。结果发现TTC能在低于其IC50剂量下增强多种一线化疗药物的敏感性,因此在广谱性的化疗增敏剂方面有较为广阔的应用前景。考虑TTC本身具有一定的抗肿瘤活性,因此其化疗增敏作用有可能来源于作用机制上的互补性。Combenefit软件中的Loewe相加模型引入等效剂量的概念,建立了用等效线方法判断药物相互作用的指标,将药物相互作用进行定量化[8]。利用该软件Loewe相加模型评价并以热图方式呈现TTC与四种化疗药物的相互作用,我们发现这种相互作用在不同的细胞株中的效应分布基本一致,特别是两种药物分别在低剂量下联用产生大于同等剂量的药理效应,即TTC对低于治疗量的化疗药物产生增敏作用。
在今后的工作中,我们将进一步建立符合临床耐药进展特点的耐药模型,在此基础上考察TTC能否实时性增强化疗药物的敏感性甚至逆转耐药模型并达到最初的敏感性,从而为南蛇藤作为肿瘤复敏的中药新药开发夯实临床前数据。

