ABT199通过增加Drp-1依赖的线粒体分裂诱导人皮肤鳞癌A431细胞凋亡
袁胜华,张玉荣,李浩运,宋静卉
皮肤癌是临床上比较常见的恶性肿瘤,严重威胁着人们的生命和健康。皮肤癌的主要病理类型为:基底细胞癌、恶性黑色素瘤和鳞状细胞癌等。其中鳞状细胞癌最为常见[1]。研究显示抗凋亡蛋白Bcl-2在鳞状细胞癌中高表达,促进细胞存活并降低其对凋亡反应的敏感性[2]。Bcl-2家族成员主要包括促凋亡蛋白和抗凋亡蛋白,分别促进或抑制细胞死亡。抗凋亡蛋白主要包括Bcl-2、Bcl-xL和Mcl-1等,促凋亡蛋白主要包括Bax、Bak、Bim和Bid等[3]。其中抗凋亡蛋白Bcl-2在肿瘤的发生、发展和转移中发挥着重要作用,并充当着一个“凋亡开关”的功能。线粒体是Bcl-2家族蛋白的主要作用靶点之一,最新研究表明其除了调控线粒体外膜通透性外,也调控线粒体动力学(线粒体融合和分裂)[4]。
ABT199是一种高效的特异性Bcl-2抑制剂,具有良好的抗肿瘤效应,并且不会引起血小板的减少[5,6]。Fan等[7]研究已证实Bcl-2抑制剂通过增加线粒体分裂可增加人胆管癌细胞对顺铂的敏感性。然而目前关于ABT199在人皮肤鳞状细胞癌凋亡中的作用研究甚少。本研究采用鳞癌A431细胞为研究对象,从体外水平观察ABT199对A431细胞活性和凋亡的影响并探讨其分子机制,旨在揭示ABT199通过增加线粒体分裂诱导A431细胞凋亡的新机制,从而为鳞癌的治疗提供新的思路。
1 材料和方法
1.1 实验材料 人皮肤鳞状细胞癌细胞系A431购买于中国科学院细胞所,DMEM(高糖)培养基和胎牛血清购自Gibco公司。ABT199由Med Chem Express公司提供。线粒体分裂抑制剂-1 (mitochondrial division inhibitor-1,Mdivi-1)购自Selleck Chemicals公司。Mito-Tracker Red购自Invitrogen公司。Muse™细胞分析仪、Muse凋亡试剂盒和Muse线粒体膜电位试剂盒购自Merck Millipore公司。线粒体提取试剂盒、ECL发光显色液购自碧云天公司。线粒体分裂蛋白(mitochondrial dynamin-related protein-1,Drp-1)抗体、线粒体内参抗体(COX IV)抗体、β-actin抗体、cleaved caspase-3抗体、cleaved caspase-9抗体及其对应二抗均购自Proteintech 公司。聚二偏氟乙烯板(Polyvinylidene fluoride,PVDF)膜(0.45 μm)购自Millipore公司。Nacl和无水乙醇等常规化学试剂购自北京化工厂。
1.2 方法
1.2.1 细胞培养、传代 使用完全型DMEM高糖培养基培养A431细胞系,放入37℃,5% CO2的培养箱。根据细胞生长情况及培养基颜色更换培养液或传代。当细胞生长至80%左右融合时弃去培养基,使用已经高压灭菌的1×磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗细胞2次,弃去PBS,加入37 ℃预热的0.04%胰蛋白酶(简称胰酶)消化细胞。然后将培养瓶放入孵箱中,期间间断取出培养瓶观察,当细胞失去彼此间连接,从多角形逐渐变圆后加入DMEM培养液以终止胰蛋白酶的消化,使用吸管吹打细胞,直至细胞完全被吹下来。将细胞悬液移至离心管中。室温下800 r/min,离心5 min,有效离心半径15 cm。弃去上清液,按照1∶3~1∶5比例传代至新的培养瓶中,置于37℃,5% CO2培养箱内继续培养。
1.2.2 MTT法检测细胞的活力 取对数生长期A431细胞进行实验。将收集到的细胞沉淀用培养基重悬,调整细胞数为8×104个/ml,每孔100 μl接种于96孔板中,实验设1个阴性对照和8个药物浓度,每一浓度均设5个复孔,周围孔用无菌的PBS填充。37℃、5%CO2、饱和湿度培养箱孵育。次日,对照孔更换培养基,8个加药孔分别用DMEM配制不同浓度的ABT199(1.25 μM、2.5 μM、5 μM、7.5 μM、10 μM、15 μM、20 μM、30 μM)工作液,加药完成后,放回培养箱中继续培养。24 h后,每孔加入20 μl MTT (5 mg/ml),继续孵育4 h,用1 ml注射器小心吸去上清,每孔加入二甲基亚砜(Dimethyl sulfoxide,DMSO)150 μl,振荡10 min。在酶联免疫检测仪上检测570 nm波长下各孔的吸光度(OD值)。实验重复3次,计算细胞活性=(1-加药孔OD值/对照孔OD值)×100%。根据实验结果,以药物浓度为横轴,细胞活性为纵轴,绘制细胞活性变化曲线,计算细胞活性抑制率达到50%时的药物剂量(IC50)作为后续实验用药浓度。
1.2.3 流式细胞术检测细胞凋亡 取生长状态良好的对数生长期的A431细胞接种于24 孔板中,接种浓度约为4×104个细胞/孔,加入不同浓度的ABT199作用24 h,胰酶消化,收集细胞,800 r/min,离心5 min,有效离心半径15 cm,然后弃去上清液,缓缓加入适量无血清 DMEM培养液(调整细胞浓度细胞浓度约为1×106/ml),用手指轻弹将细胞悬液混匀,将细胞悬液与Muse™Annexin-V凋亡细胞检测试剂 1∶1 混匀,室温避光孵育25 min,处理好的样本用Muse™细胞分析仪进行检测,分析不同处理组中细胞凋亡率的变化。
1.2.4 共聚焦显微镜检测线粒体分裂对数 生长期A431细胞按照4×104个/孔接种于24孔板(提前把高压过的1 cm2盖玻片放入其中)内,37℃、5% CO2细胞培养箱培养,待细胞达到70%融合时,10 μM ABT737和/或Mdivi-1作用24 h。弃掉培养液,将细胞用0.1 M PBS洗3次后。MitoTracker Red 250 μM作用于细胞30 min。弃掉染色液,将细胞用0.1 M PBS洗3次,每次3 min。随后用1∶500稀释好的Hoechst33342染料孵育2 min。0.01% Triton 0.01 M PBS洗3次,5 min/次。小心将细胞面朝下放置在准备好的载玻片上,利用水性封片剂(甘油∶双蒸水=1∶9)封片,注意避光。共聚焦显微镜下采集图像。MitoTracker Red激发波长575 nm,发射波长590 nm。
1.2.5 Western blot检测caspase-3和caspase-9的活化及Cyto C和Drp-1的线粒体移位 ABT737和/或Mdivi-1处理A431细胞24 h后,提取全细胞蛋白或通过碧云天试剂盒分离线粒体蛋白和胞浆蛋白。Bradford法测蛋白浓度,取待测样本按30 μg上样,15%二烷基硫酸钠-聚丙烯酰胺凝胶电泳常规电泳、将蛋白转移至PVDF膜,5%脱脂奶粉封闭、一抗4℃过夜,二抗温育2 h,用0.01 mol/L的PBS洗膜3次,1次15 min,2次5 min,加增强化学发光法(enhanced chemiluminescence,ECL)显色液进行显影。数据采用天能图像分析系统及Quantity One软件进行分析。
1.2.6 流式细胞术检测线粒体膜电位 不同药物处理后,常规培养6 h。用胰酶消化细胞,随后800 r/min、离心5 min,有效离心半径15 cm,并用100 μl 培养液重悬。取细胞悬液100 μl和MitoPotential dye染料95 μl放入1.5 ml 环氧树脂(epoxide,EP)管,并轻微混匀,37℃避光孵育20 min。再向EP管中加入5 μl的7-氨基放线菌素(7-aminoactinomycin D,7-AAD),室温避光孵育5 min。Muse流式细胞仪检测各组细胞的线粒体膜电位变化情况。
1.3 统计学处理 采用SPSS 20.0软件进行统计分析。计量数据以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 ABT199对A431细胞活性的影响 由图1 MTT结果可知,ABT199能以剂量依赖的方式抑制A431细胞活力(P<0.05),24 h的IC50值为(10.33±0.93)μM。因此,本研究选用3个浓度梯度的ABT199(5 μM、10 μM、15 μM)作用细胞24 h。流式细胞术结果进一步表明ABT199可诱导A431细胞的凋亡(P<0.05,图2)。
2.2 ABT199对线粒体长度变化的影响 共聚焦显微镜结果显示ABT199能诱导线粒体长度减短,说明ABT199能诱导A431细胞发生线粒体分裂;而Mdivi-1可减弱ABT199诱导的线粒体分裂(图3)。Western blot结果显示ABT199诱导A431细胞胞浆蛋白中Drp-1表达下降,而线粒体蛋白中Drp-1表达上升(图4)。
2.3 ABT199诱导A431细胞线粒体途径的凋亡 流式细胞术结果表明ABT199能诱导A431细胞线粒体膜电位(△Ψm)下降(图5),而与ABT199组相比,Mdivi-1联合ABT199能增加线粒体膜电位。提取A431细胞线粒体和胞浆蛋白分析Cyto C的表达。Western blot结果显示Mdivi-1减弱了ABT199诱导的Cyto C从线粒体释放至胞浆(图6)。提取全细胞蛋白分析caspase-3和caspase-9的活化水平发现Mdivi-1能减弱ABT199诱导的activated caspase-3和activated caspase-9的表达上调(图7)。
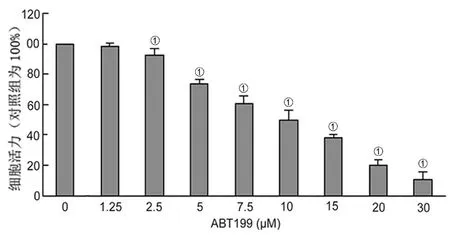
图1 ABT199对A431细胞活力的影响

图2 ABT199对A431细胞凋亡的影响

图3 ABT199对线粒体长度变化的影响
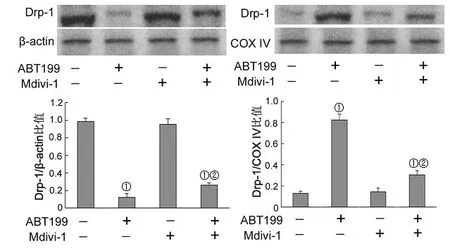
图4 ABT199对Drp-1表达的影响

图5 ABT199对线粒体膜电位的影响
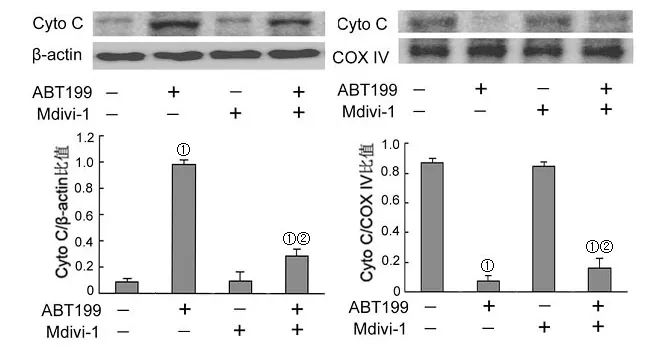
图6 ABT199对Cyto C表达的影响
3 讨 论
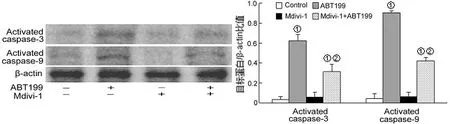
图7 ABT199对activated caspase-3和activated caspase-9表达的影响
Bcl-2家族中抗凋亡蛋白和促凋亡蛋白之间的失衡是肿瘤发生发展的主要原因,同时也是标志性事件。因此,Bcl-2抗凋亡蛋白成为肿瘤治疗非常重要的分子靶点。Bcl-2在皮肤鳞癌中广泛表达,颜芹[8]报道皮肤癌中Bcl-2的表达水平与凋亡敏感性呈负相关。ABT199是Bcl-2的特异性小分子抑制剂,其可以选择地结合到Bcl-2蛋白的疏水凹槽上,通过间接或直接的方式激活Bax/Bak,最终诱导细胞凋亡。临床前期研究已经表明ABT199能诱导Bcl-2高表达的肿瘤细胞凋亡,其可以显著地诱导慢性淋巴细胞白血病和非霍奇金氏淋巴瘤细胞凋亡[9]。本研究结果表明ABT199能以剂量依赖性的方式抑制鳞状皮肤癌A431细胞活力并诱导其凋亡。
在真核细胞内,线粒体不断地发生分裂和融合,两者一般保存着动态平衡。当两个过程失衡时就会改变线粒体的形态,从而抑制或促进凋亡。线粒体分裂可以通过减弱线粒体网络的连贯性和减少三磷酸腺苷(adenosine triphosphate,ATP)的产生抑制细胞生长。而线粒体融合能通过维持线粒体的完整性促进新陈代谢和生物能量转换[10]。研究表明Bcl-2蛋白家族调控着线粒体动力学[11]。Drp-1是调控线粒体分裂的重要蛋白之一。在正常生理状态下,Drp-1主要定位在胞浆内;而在分裂信号刺激下,Drp-1迅速转位至线粒体并促进线粒体分裂。Mdivi-1是Drp-1的特异性抑制剂,它主要通过变构调节阻断Drp-1的ATP酶活性和自组装,从而抑制Drp-1的功能。Drp-1是线粒体分裂的标志性蛋白,一旦发生分裂,Drp-1会被Fis1和Mff招募到线粒体外膜上。EGL-1是一种新的BH3 only蛋白,其可以通过诱导Drp-1从胞浆移位至线粒体进而促进线粒体分裂[12]。同时,也有研究表明Bax和Bak的高表达能通过诱导Drp-1依赖的线粒体分裂促进细胞凋亡[11]。在本研究中,笔者发现Drp-1特异性抑制剂Mdivi-1能减弱ABT737诱导的线粒体分裂和Drp-1线粒体转位,这表明了ABT199能诱导A431细胞发生Drp-1依赖的线粒体分裂。
在真核细胞内,线粒体分裂有利于线粒体膜电位下降、线粒体外膜通透性形成和促凋亡因子的释放(如Cyto C)。线粒体分裂是位于线粒体途径凋亡上游的一个重要生物学事件。线粒体可以通过调控caspase激活剂(如Cyto C)的释放参与细胞凋亡过程,与此同时,线粒体发生分裂并形成颗粒状和点状散的线粒体。但是,目前尚不清楚线粒体分裂是线粒体途径凋亡的原因还是结果,亦或只是一个伴随现象。通过时间间隔显微镜,研究人员证明了Cyto C的释放要比分裂早10 min发生,这提示了分裂可能是Cyto C释放的一个结果[13]。但也有研究指出Drp-1介导的线粒体分裂可以导致线粒体膜电位下降和Cyto C的释放[14]。Chae等[15]证实了Drp1K38A(Drp-1显性失活突变体)能抑制硫代硫酸银诱导的Cyto C释放和凋亡。本实验结果显示Mdivi-1能减弱ABT199诱导的线粒体膜电位下降、Cyto C的释放及caspase-3和caspase-9的活化。这提示了ABT199通过诱导Drp-1依赖的线粒体分裂导致了线粒体途径的凋亡。
综上所述,本实验结果表明ABT199能以剂量依赖性的方式抑制A431细胞活力并诱导其凋亡。ABT199通过诱导Drp-1的线粒体转位促进线粒体分裂,进而诱导线粒体膜电位下降,最终导致了线粒体途径的凋亡。

