481例恶性肿瘤患者循环肿瘤细胞(CTC)检测的回顾性分析
沈敏娜 戴 谦 周佳烨 王蓓丽 郭 玮 潘柏申
(复旦大学附属中山医院检验科 上海 200032)
2012年,全球新增恶性肿瘤病例约1 410万,死亡病例820万[1]。相比2010年的全球癌症统计报告,恶性肿瘤的发病率和死亡率都呈现快速上升的态势[2]。其中,肺癌、肝癌、乳腺癌、胃癌、结直肠癌、胰腺癌等恶性肿瘤的死亡率位居前列[1],通常手术切除原发肿瘤是首选治疗方案,但即便是顺利切除肿瘤,仍有很多患者最终死于肿瘤的复发和转移。病理组织活检是肿瘤诊断的金标准,但不适用于术后监测,影像学检查适用于术后随访,但很难发现早期微小转移病灶。
在原发肿瘤形成和生长的早期,循环肿瘤细胞(circulating tumor cell,CTC)即可从原发肿瘤脱落,并进入血流循环,在远处播散、种植,形成转移灶。CTC被认为是“液体活检”,具有实时监测功能,是一种非侵入性的新型诊断标志,有助于肿瘤微转移的早期发现和预后评估,在治疗监测及个体化治疗中具有重要临床意义[3]。
但是CTC存在于大量血细胞背景之中,在不同肿瘤之间、不同患者之间,甚至是同一患者不同时期都可能存在极大的异质性,因此分离和检测CTC都面临极大的技术挑战。2004年,CellSearch系统成为FDA批准用于计数7.5 mL全血中的循环肿瘤细胞(CTC7.5)的唯一方法。第一阶段使用CellSearch系统的临床研究数据表明[4],CTC与转移性乳腺癌、结直肠癌和去势抵抗性前列腺癌预后不良相关。后期研究表明[5],CTC也与小细胞肺癌和非小细胞肺癌、膀胱癌、胰腺癌、头颈部癌、卵巢癌、神经内分泌肿瘤和肝细胞肝癌相关。
现有基于CellSearch平台的文献报道一般仅关注CTC的数量及其临床价值,往往忽略了该平台可以观察到的CTC形态特征,本文以CellSearch系统为例来讨论CTC的形态学特征及其临床应用价值。
资 料 和 方 法
研究对象回顾性分析复旦大学附属中山医院检验科2014年12月至2016年4月期间申请CellSearch系统检测CTC、经病理活检确诊并有病史资料的恶性肿瘤患者481例,包括肝癌331例、胃癌51例、结直肠癌38例、乳腺癌35例、胰腺癌17例、肺癌5例、前列腺癌4例,其中肝癌患者连续监测随访时间更新至2018年4月,将未发现复发、转移或死亡的患者定义为无进展。根据CTC检测时是否接受外科手术治疗,将患者分为术前组和术后组。
检测方法CTC检测系统采用CellSearch系统[强生(上海)医疗器械有限公司],检测试剂采用其配套的CTC试剂盒。使用专用的 CellSave 储存管(添加细胞防腐剂)采集外周血并取7.5 mL全血制备样本。将制备好的血液及缓冲液样本放置在CellTracks AutoPrep自动化装置中,进行细胞富集和分离,随后进行磁孵育。将MagNest装置富集后的CTC进行免疫荧光染色,通过CD45抗体、细胞角蛋白(CK)8,18,19抗体与细胞核DAPI荧光染色试剂共同识别CTC。CTC检测结果经CellTracks Analyser Ⅱ系统分析后,由两位工作人员独立进行判读。
统计学分析采用SPSS 19.0软件进行统计学分析。 计数资料组间比较采用χ2检验或Fisher确切概率检验,生存时间分析采用Kaplan-Meier法,生存曲线的比较采用log-rank检验,P<0.05为差异有统计学意义。
结 果
7类肿瘤术前术后CTC7.5检出率变化术前组CTC7.5(图1):肝癌检出率53%,中位检出数1(0~94)个;胃癌检出率73%,中位检出数2(0~42)个;结直肠癌检出率64%,中位检出数1(0~11)个;乳腺癌检出率85%,中位检出数2(0~322)个;胰腺癌检出率62%,中位检出数1(0~5)个;前列腺癌检出率100%,中位检出数32(3~35)个。术后组CTC7.5检出率为0~37%。术前组CTC7.5检出率居前的是前列腺癌和乳腺癌,术后组CTC7.5检出率均有显著下降(P均<0.05)。因术后组检测例数过少,肺癌和前列腺癌未检测到CTC,其他肿瘤术后组CTC7.5检出率下降最为显著的是乳腺癌和胃癌(χ2=9.12,P=0.003;χ2=5.76,P=0.016)。

图1 7类肿瘤术前术后CTC7.5检出率变化Fig 1 Preoperative and postoperative CTC7.5 detection rate in 7 types of cancer
7类肿瘤CTC的形态差异观察7类肿瘤的CTC形态特征发现(图2):胃癌、乳腺癌、胰腺癌多见CK强阳性CTC;肝癌、胃癌、肺癌可见体积较小CTC;不同类型肿瘤CTC形态特征存在极大异质性;同类肿瘤CTC体积、核质比、细胞形态、染色强度等亦存在较大差异,其中尤以肝癌和肺癌为甚。

图2 7类肿瘤CTC的典型形态Fig 2 Typical cell morphology of CTC in 7 types of cancer
6例肝癌患者CTC连续监测典型形态变化6例肝癌患者CTC典型形态变化特征见图3,CTC数量及形态特征与治疗反应及预后关系见图4。基于CTC形态变化特征将患者分为4个亚组。
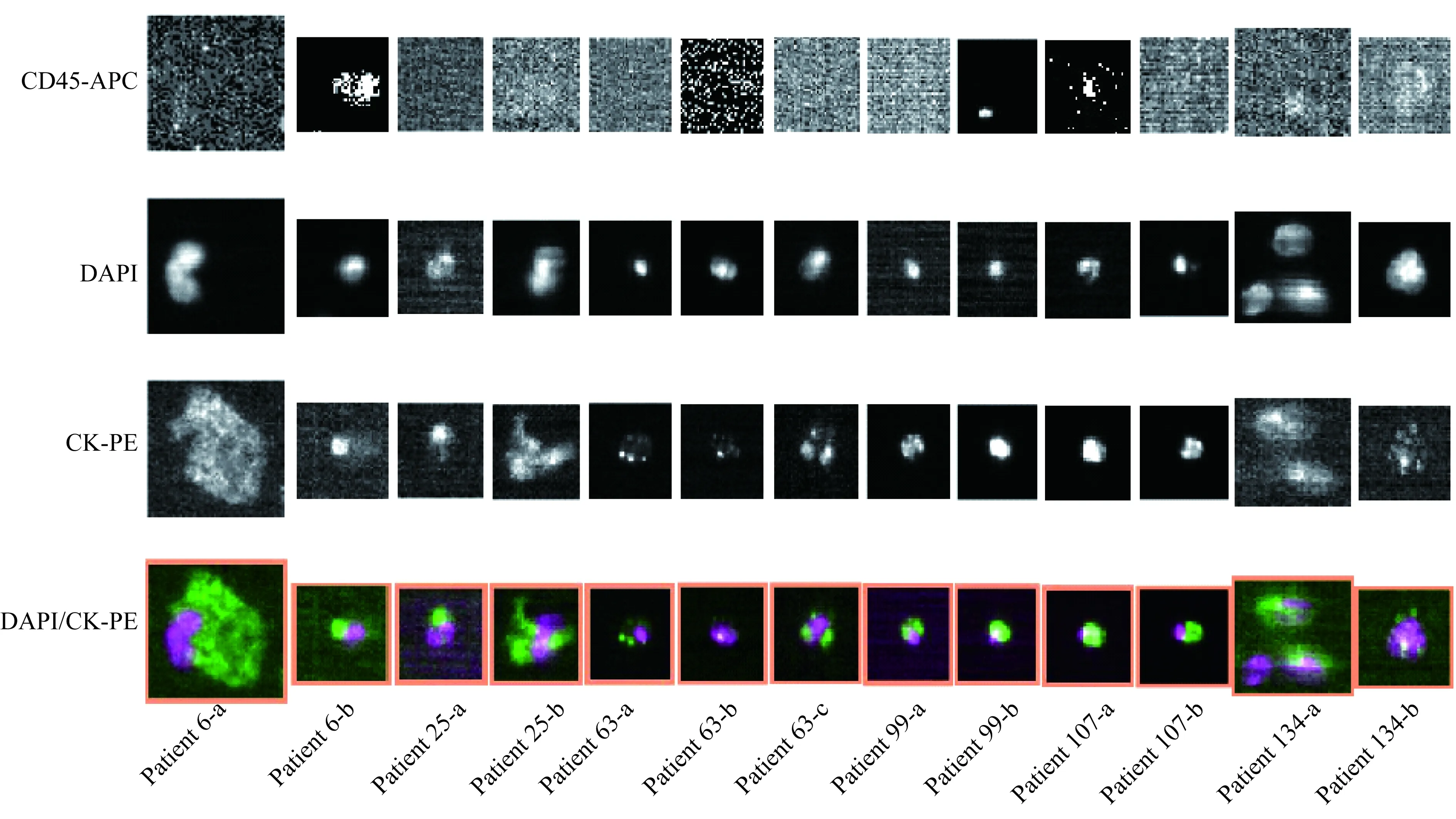
图3 肝癌患者CTC形态变化Fig 3 Morphological changes of CTC in patients with liver cancer
CTC体积变化组 治疗反应及预后好。患者6连续4次监测CTC,2次检出CTC,体积变化较大。6-a CTC细胞体积大,核质比小;6-b CTC细胞体积小,核质比大。该患者术前未检出CTC,手术导致CTC的大量释放,在随后的1周内CTC7.5已大幅下降,在第1次化疗后CTC已被清除,该患者目前未发现转移复发。患者25连续3次监测CTC,2次检出CTC,体积变化较大。25-a CTC细胞体积较小,25-b CTC细胞体积明显增大。该患者术前CTC7.5为2个,术后1周逐渐下降为0,该患者目前未发现转移复发。
CTC体积稳定组 治疗反应不佳,CTC清除周期延长或预后不良。患者63连续5次监测CTC,3次检出CTC,体积基本没有变化。该患者为肝癌术后复发,CTC7.5为2个,肝移植术后降为0,但1个月后又检出CTC,经过2次化疗降为0,该患者目前未发现转移复发。患者107连续2次监测CTC,均检出CTC,体积无明显变化。该患者为肝癌综合治疗后复发,CTC7.5为4个,经多次化疗和TACE治疗4个月后CTC7.5为7个,电话随访该患者复发。
CK染色增强组 CK表达增加提示预后不良[10-12]。患者99连续3次监测CTC,2次检出CTC,体积变化不大,但第2次检出的CTC CK染色明显增强。该患者肝癌术后第1次化疗后CTC7.5为4个,第3次化疗后虽然CTC数量下降,但检出的CTC CK染色明显增强,第4次化疗后CTC清除,但2个月后发现转移。
CTC凋亡组 预后良好。患者134连续3次监测CTC,2次检出CTC,形态变化明显,第2次检出的CTC可见碎裂的CK呈小圆囊泡状环绕核周,说明这些细胞正在走向凋亡。该患者肝移植术后18天CTC7.52个,第1次化疗后CTC7.5仍为2个,但观察第2次检出的CTC发现细胞正在走向凋亡,该患者目前未发现转移复发。
不同亚组CTC患者无进展生存曲线比较Kaplan-Meier生存分析表明,CTC体积稳定组(n=11)的无进展生存率显著低于CTC体积变化组(n=9)(27.3%vs.77.8%,P=0.0405,图5A);CK染色增强组(n=8)的无进展生存率显著低于无CK染色增强组(n=18)(0vs.88.9%,P<0.000 1,图5B);无CTC凋亡组(n=18)的无进展生存率显著低于CTC凋亡组(n=4)(16.7%vs.100.0%,P=0.009 6,图5C)。以上结果提示以CTC形态特征为基础的CTC亚组(包括CTC体积变化、CK染色增强、CTC凋亡)可能与肝癌患者的临床预后相关。
讨 论
CTC作为“液体活检”标志用于肿瘤患者实时动态监测。随着分离、富集和检测技术的发展,已有多种平台可用于检测外周血中的CTC。由于无法进行标准化,不同平台CTC报道的数量变化范围很大,本文回顾性分析的数据也显示CellSearch系统的CTC检出率确实与其他平台报道的数据有一定差异[4,6-7]。
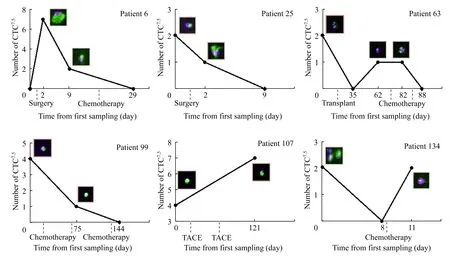
No recurrence:Patient 6,25,63 and 134;Metastasis:Patient 99;Recurrence:Patient 107.
图4肝癌患者治疗反应CTC连续监测
Fig4CTCdetectionoftreatmentresponsesurveillanceinpatientswithlivercancer
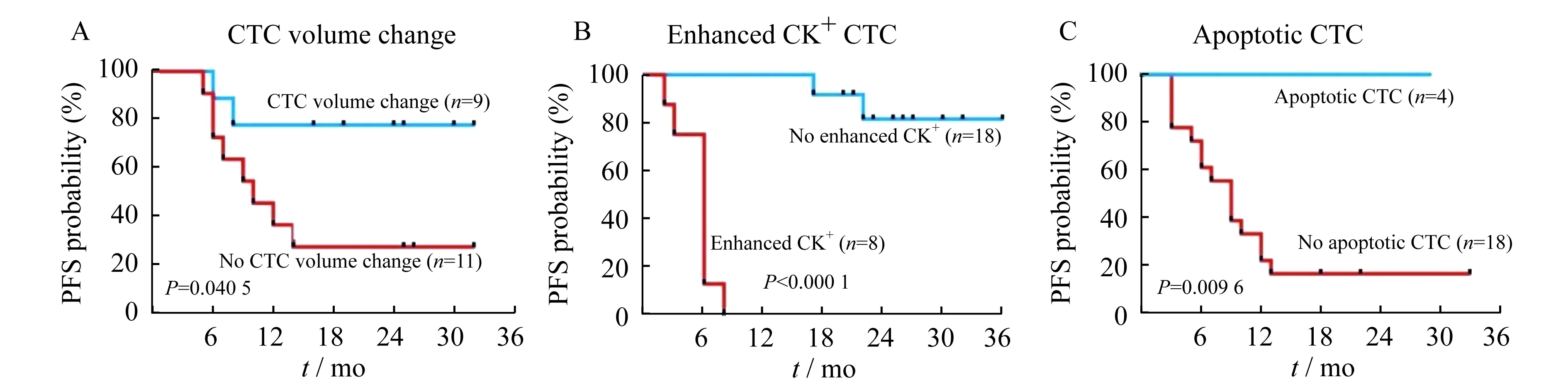
图5 不同亚组CTC患者的无进展生存曲线Fig 5 Progression-free survival curve of different CTC subgroups
CellSearch系统是唯一被FDA批准用于临床检测转移性乳腺癌、前列腺癌和结直肠癌患者外周血CTCs[8]的检测平台,CellSearch系统由专用的CellSave储存管、血样处理设备 AutoPrep系统、扫描和分析样本的Analyzer系统以及配套的试剂盒等部分组成,是目前国际上最为稳定和可靠的CTC检测系统。AutoPrep系统能够实现复杂样本处理流程的自动化和标准化。Analyzer系统是一种荧光光学系统,可对经过免疫磁性分选的CTC进行全自动扫描,并进行全自动背景分析,以图库形式呈现备选的荧光检测图像,最终经人工判读确定CTC报告数量。
目前CellSearch系统定义一个CTC的基本条件需要有细胞核(DAPI染色阳性)、CK+、CD45-(排除白细胞背景干扰)、面积大于4 μm×4 μm,具有细胞形态和免疫学特征。但当着眼于CTC的形态特征时,发现肿瘤患者自身和不同患者之间,CTC都具有很大的异质性[4]。不同肿瘤之间CTC的形态差异也很大,例如胃癌、乳腺癌、胰腺癌多见大体积、CK染色强阳性CTC,结直肠癌、前列腺癌也多见大体积CTC;而肝癌、肺癌多见小体积CTC,且细胞形态异质性程度更高。根据我们观察CTC细胞形态的经验,在判定不同肿瘤或不同患者CTC时,即使满足CellSearch系统CTC的基本定义,CTC形态的异质性仍会给判读造成一定困难。因此,即便使用相同的CellSearch系统,由于没有指南明确规定详细的CTC判读标准,加之判读人员对形态的理解、认知、经验等方面的差异,不同实验室CTC报告数量仍可能存在一定差异。CellSearch系统虽然只报告CTC数量,但人工判读部分完全基于细胞形态特征,因此我们对于细胞形态的探讨有助于积累更多的经验,减少判读差异,以期最终形成统一的判读标准。
基于CellSearch系统,通常认为CTC数量与预后相关,CTC数量越多,预后越差[7,9]。在肝癌患者治疗监测过程中,我们发现同一患者的CTC形态也是不断变化的,而且这种变化可能与治疗反应及预后密切相关。我们连续监测肝癌患者的CTC形态变化,发现CTC体积变化、CK染色增强、凋亡CTC的出现可能与肝癌患者的治疗反应及临床预后相关。本文随访数据显示,若治疗过程中,肝癌患者CTC体积发生明显变化,提示治疗可能有效;反之,则提示CTC对治疗反应不佳,清除CTC的周期延长,甚至预后不良。鉴于随访患者数量有限,该现象还需要进一步扩大随访例数进行验证。细胞角蛋白19 (cytokeratin 19,CK19)是胆管细胞和肝祖细胞的标志物,与肝癌患者的预后不良密切相关[10-11]。近期研究发现,CK19的表达与上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)和甲胎蛋白(alpha-fetoprotein,AFP)的表达相比,与肿瘤侵袭更具有相关性[12]。CTC CK染色增强可能强烈提示预后不良,其预后价值不亚于CTC数量。凋亡CTC的出现提示CTC即将被清除[4],在我们的研究中多见于肝移植术后患者,即使CTC数量未下降,凋亡CTC的出现也提示预后良好。
我们通过Kaplan-Meier生存分析,比较不同亚组CTC患者无进展生存率,CTC体积稳定组、CK染色增强组、无CTC凋亡组的无进展生存率均显著低于CTC体积变化组、无CK染色增强组、CTC凋亡组。进一步验证了以CTC形态特征为基础的CTC亚组(包括CTC体积变化、CK染色增强、CTC凋亡)可能与肝癌患者的临床预后相关。有效的治疗不仅使CTC数量下降,也可能使CTC形态发生一定的改变。我们报告CTC数量的同时,若能兼顾CTC形态的变化,可以给临床提供更多监测数据,有助于临床医师更准确地判断治疗效果并及时调整治疗方案,以期改善预后。同时,CTC形态特征变化对临床预后可能有一定的提示作用。当然,局限于本文连续监测CTC且能观察到CTC形态变化的患者例数有限,还需要进一步扩大数据,进行验证。

