一种侵染红枣叶片和果实的病原真菌鉴定
萨吉达木·艾则孜,麦合木提江·米吉提,赵志强,许泰百,郭庆元
(新疆农业大学,乌鲁木齐 830052)
0 引 言
【研究意义】枣(ZizyphusjujubaMill.)为鼠李科(Rhamnaceae)枣属(Ziziphus)植物,我国是原产地,栽培历史悠久[1]。红枣是我国重要的特色果树,也是新疆重要经济果树。新疆红枣种植面积约占全国总面积的1/3,已达4.7×105hm2[2]。随着新疆红枣种植面积的迅速扩大和栽培年限的延长,红枣病害影响新疆红枣的产量和品质,查明红枣病害种类,了解病害规律,高效控制红枣病害的发生与危害对新疆红枣产业可持续发展具有实际意义。【前人研究进展】据国外文献报道,在枣的果实生长期Alternariachartarum、Aspergillusnanus、A.parasiticu、Helminthospriumatroolivaceum、Phomahessarensis和Stemphyliommavalparadisiacum可引起一些枣的果实病害;在果实储藏期Alternariabrassicicola、Phomaspp.、Curvularialunat、Cladosporiumherbarum可引起一些枣果斑点性病害;此外,Fusariumspp.、Nigrospqraoryzae、Epicoccumnigrum可引起枣果实腐烂,Entypellazizyphi、Hypoxylonhypomiltum、Patellariaatrata.侵染枣树枝条[3]。国内研究显示,在2012~2013年对阿克苏地区及南疆部分地区枣树生长期的主要果实病害有缩果病、软腐病、黑斑病、裂果病等;叶部病害有枣炭疽病、叶黑斑病、缺素症及药害等,枝干部病害有腐烂病、流胶病等10种病害[4]。其中,白剑宇等[5]通过分子鉴定,将枣黑斑病的病原菌鉴定为链孢霉属链格孢(Alternariaalternata)。赵燕等[4]初步认定短小芽孢杆菌(BacilluspumilusWL.)是新疆红枣缩果病的主要致病菌。白剑宇等[6]在国内报道了枣树褐斑病,病原菌鉴定为Nothophomaquercina。【本研究切入点】新疆红枣病害的种类比较复杂,相关的鉴定和研究还比较不足。除了上述已查明病虫害以外,近几年在新疆阿克苏地区局部红枣上发现了一种引起花叶和果实畸形的病毒病(病原尚未确定),并在花叶及畸形果上常有褐色斑点出现。经过病害症状、田间发病特点及传染性观察初步判断花叶、畸果症状为病毒引起,花叶及畸果上的褐色斑由病原真菌侵染所引起。2016年调查,有上述症状的受害果树在阿克苏部分地区已比较普遍,严重地块果树发生株率达100%;并有可能在更大区域蔓延。【拟解决的关键问题】研究主要针对与花叶、畸果症状相伴出现的真菌性褐色斑点病,通过病样采集,病原菌分离,回接证病,病原菌的形态观察及分子鉴定,确定病原种类,为病害的发病规律调查、病毒病的关系分析、病毒病的高效防控提供依据。
1 材料与方法
1.1 材 料
供试病样于2016年9月在新疆阿克苏市机场附近枣果园采集。根据该危害的症状特点描述记载。
1.2 方 法
1.2.1 病原菌的分离及单孢纯化
采用常规组织分离法和孢子蘸取法对采集的红枣果实和叶片病样进行病原菌分离,再用单孢纯化方法获得单孢菌株。
1.2.1.1 常规组织分离法
将有褐色病斑的叶片及果实用无菌水洗净,晾干,在超净台上用75%乙醇浸润2 min,在病健交界处切取约4 mm2组织,用2% NaClO液消毒5 min后,再用无菌水冲洗3次,置于滤纸上晾干,最后放在PDA培养基上,25℃恒温培养5 d。
1.2.1.2 孢子蘸取法
田间采集病样在低温潮湿的环境保存15 d,待病斑处产生黑色小黑点(分生孢子器)并且溢出黑褐色黏状物(分生孢子)。用接种针蘸取黑褐色黏状物在PDA上进行25℃恒温培养。
1.2.1.3 单孢纯化法
用接种针蘸取菌落上的分生孢子器中溢出的分生孢子,加入10 mL无菌水中,配制成的孢子悬浮液,并稀释到103个/mL的浓度,用涂布器蘸取孢子悬浮液并涂布于WA平板培养基上,通过显微观察找到单个孢子并用接种针转移至PDA平板培养基上,在培养过程中再次通过显微观察确认并标记出单孢菌落,将其转移至PDA斜面培养基上培养10 d后保存于4℃冰箱备用。
1.2.2 回接证病
选取长势一致的离体叶片和离体果实(直径为1.5~2.0 cm),用106个/mL的孢子悬浮液分别对其进行无伤接种和伤口接种,在室温及室内湿度下诱发病变,15 d完成观察,记录接种后出现的症状特点及分生孢子器特征。
(1)无伤接种
用75%的酒精棉球对叶片正面、背面及果实表面进行消毒处理,用毛笔蘸菌(106个/mL的孢子悬浮液)涂抹于叶片正面、背面及果实表面,并以无菌水为对照。
(2)伤口接种(针刺贴菌法)
对叶、果样品进行同样的消毒处理后置于玻璃板上,用注射针头(ø:0.23 mm)分别对叶面、叶背、叶脉及果实表面进行针刺,在每个接种点形成8~9个针刺伤,然后用事先制备的菌饼,将菌丝面朝向刺伤的接种部位,并覆盖刺伤部位。对照用无菌PDA培养基。
1.2.3 病原菌形态观察
选取典型菌株,将其转入PDA平板上,25℃恒温培养7 d后,观察菌落、分生孢子器和分生孢子形态并分别测量分生孢子器和分生孢子大小。
1.2.4 病原菌分子鉴定
使用生工(上海)生物工程有限公司提供的新型植物基因组DNA快速抽提试剂盒(真菌)对多个单孢菌株分别进行病原菌基因组DNA的提取,以菌株的基因组DNA为模板,参照白剑宇等[6]的PCR反应体系及反应程序,采用ITS引物(ITS1/ITS4)进行PCR扩增;PCR产物经1%琼脂糖凝胶电泳检测确认后,委托新疆子琦生物技术有限公司进行测序。将菌株序列登录GenBank网站,采用BLAST 软件对测序结果进行同源性比较。并利用Mega软件的UPGMA法和NJ法构建系统发育树,分析其与GenBank公布的近缘种的亲缘关系,确定病原菌种类。
2 结果与分析
2.1 病害症状与病原菌形态观察
田间花叶和畸果症状多发生于新生枝条上,坏死褐斑多出现在有花叶症状的叶上和有畸果症状的果实表面。叶上形成褐色斑点或病斑,多数出现在叶脉上,容易造成叶脉褐色坏死,少数出现在叶脉间,呈褐色,圆形或不规则形;幼果受害,初不明显,后期渐变为边沿不清晰的褐色斑块,其上生多个小的突起;田间未见病征,但经室内保湿,叶斑和果斑上可产生黑褐色小粒点(分生孢子器)。图1

a、b:病枝上的畸果、花叶症状;c、d:叶斑上产生的分生孢子器
a、b: The Deformed fruit、mosaic on the disease branches; c、d: The pycnidia produced on the leaf spot
图1 枣树病枝上畸果、花叶以及褐色叶斑
Fig.1 The deformed fruit、mosaic and brown leaf spots on the disease branches of jujube
通过分离纯化得到3个单孢分离菌株,一株来自果实(菌株号:AKS117-F1),2株来自叶片(菌株号:AKS117-L1、AKS117-L2)。这些菌株在PDA平板培养基上生长较快,菌落初期呈白色丝绒状,气生菌丝致密,短绒毛状,后变为褐色至黑褐色,菌落背面有明显轮纹;分生孢子器生于气生菌丝下,埋生或半埋生,初为褐色,成熟时变黑褐色,有孔口,卵形或近球形,聚生或散生,菌落中央多而密,边缘较分散,大小为(88.7×125.3) μm~(194.6×233.1) μm(平均为(108.2~214.8) μm,n = 30);镜检观察时分生孢子从孔口成串外溢,大多数分生孢子呈长椭圆形,无色,单细胞(2.7~3.8) μm×(7.2~9.5) μm(平均为(3.4×8.5) μm,n = 50)。图2
根据《茎点霉属真菌的鉴定手册》[7]中记载的头状茎点霉的形态特征和E. K. Ligoxigakis.等[8]描述的P.glomerata形态特征基本一致。图2
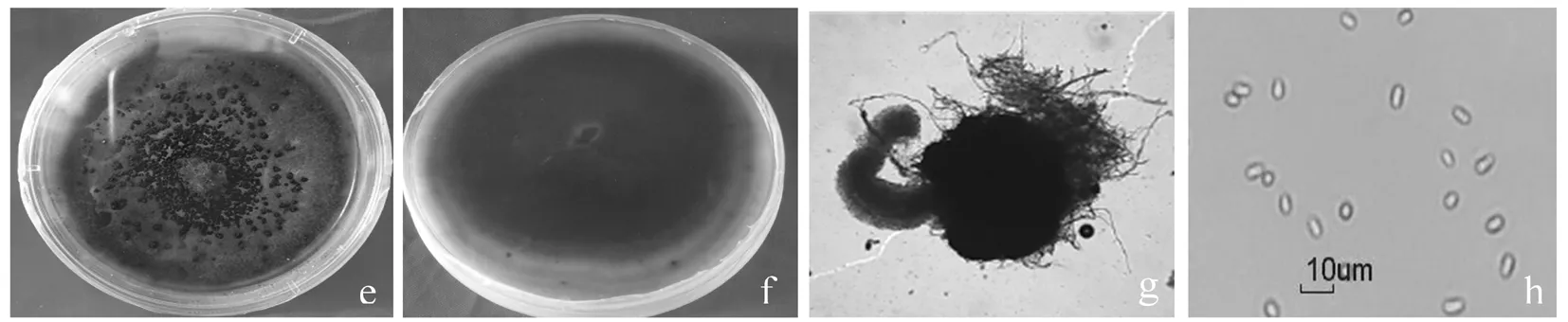
e: 菌落正面; f: 菌落背面; g: 分生孢子器; h: 分生孢子
e:Colony of pathogen; f: The back of the Colony of pathogen; g: Pycnidia of the pathogen; h: Conidia of the pathogen
图2 病原菌形态特征
Fig.2 Morphological characteristics of the pathogens
2.2 回接证病
用3个来自病叶和病果的分离菌株分别对离体叶、果进行的接种试验结果表明,进行无伤接种的叶、果均未发病;而伤口接种的叶、果均有发病,对照无症状。接种3 d后,可见果实接种点开始出现坏死、叶面和叶脉的不太明显;7 d后,果实病斑扩大,侵染部位开始凹陷,叶上出现褐色病点,并开始扩展,且明显可见叶脉上病斑较叶脉间病斑扩展更快;15 d后,果实病斑继续扩大,各接种点病部相连,组织坏死,形成更大凹陷坏死斑,病部生褐色至黑褐色分生孢子器;叶片病斑扩展缓慢,但叶脉坏死部出现少量褐色至黑褐色分生孢子器。回接后的一系列症状表现与田间病状及病样诱发病征有很大的相似性,从接种叶、果病部再分离所获得的病菌特征与接种用菌相同。确定3个分离菌株侵染红树叶片和果实引起褐色坏死病斑的病原菌。图3
2.3 分子生物学鉴定
使用引物ITS1/ITS4对3个菌株的rDNA进行PCR扩增和电脉分析得到约500 bp扩增条带,经测序均得到大小517、523和529 bp的rDNA-ITS序列,并向GenBank提交了菌株AKS117-F1的rDNA-ITS扩增片段序列(收录号为MG372318)。将该序列与Gen Bank中相关菌株的ITS序列进行同源性比较,结果表明,3个分离菌株之间的相似度为100%,并与Peyronellaeaglomerata(GenBank登录号:AB470906、KT192373等)和Phomaglomerata(GenBank登录号:EU273521)相似度达到99%。图4,图5
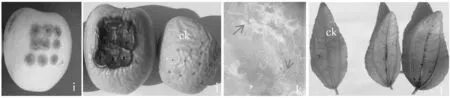
i:接种3 d后的果实症状;j:接种7 d后的果实症状;k:接种15 d在果实上产生的分生孢子器;l:接种7 d后的叶片
i: Symptom the fruit of 3 days after inoculation; j: Symptom the fruit of 7 days after inoculation; k: Pycnidia on the fruit of 15 days after inoculation; l: Symptom the leaf of 7 days after inoculation
图3 叶片和果实上人工接种症状
Fig.3 Symptoms of artificial inoculation on leaves and fruits
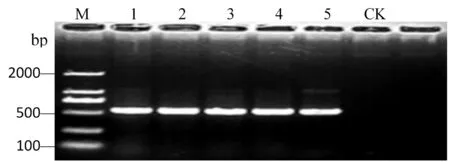
M:2000D ladder marker;1-2:AKS117-F1;:3-4:AKS117-L2;5:AKS117-L2;CK:阴性对照;
M: 2000D ladder marker; 1-2: AKS117-F1; 3-4: AKS117-L2; 5: AKS117-L2; CK: negative control
图4 病原菌ITS序列PCR扩增结果
Fig.4 The PCR amplification product of ITS sequence of pathogens
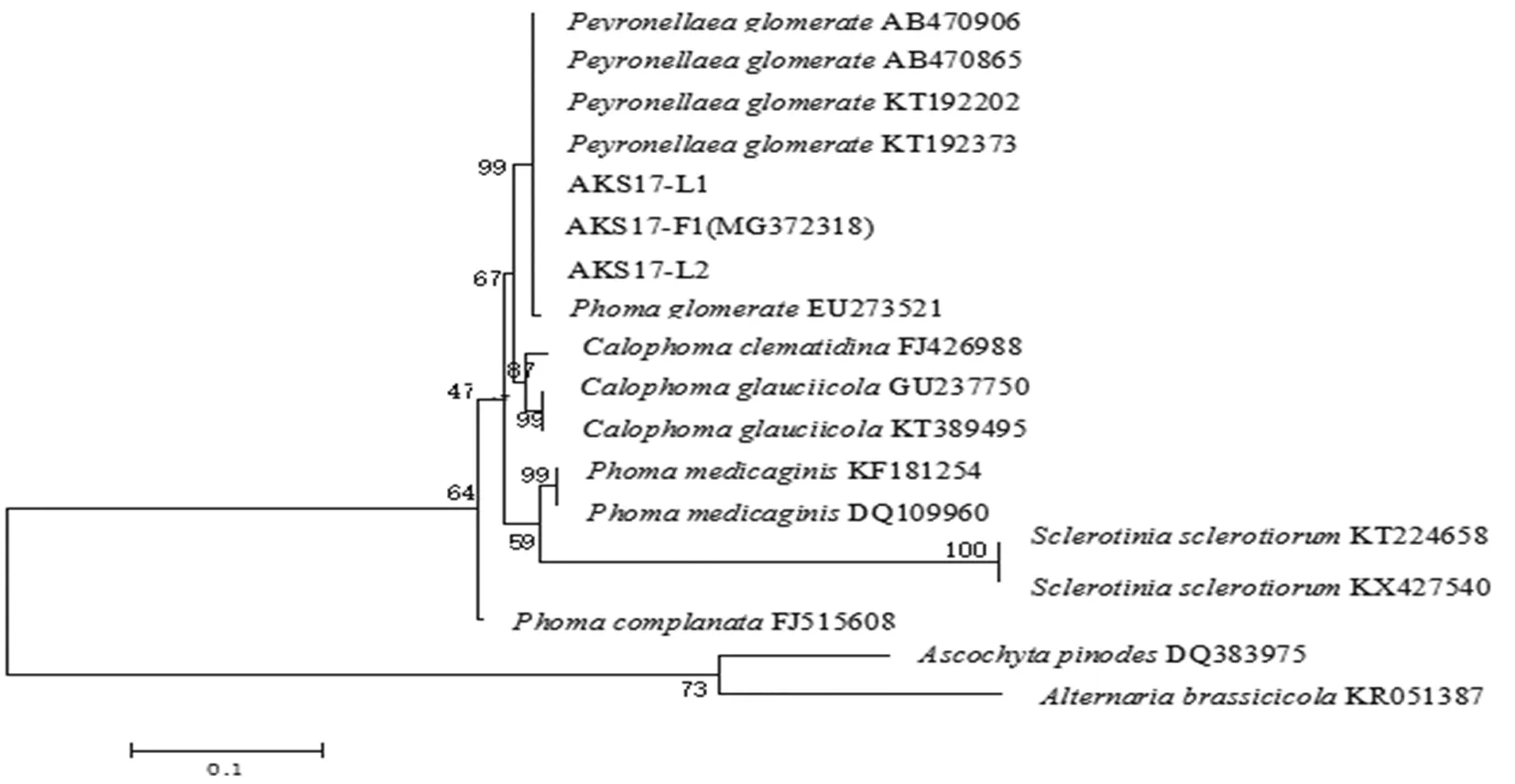
注:括号中为相关菌株在GenBank中的登录号,分支处数值表示自举值。尺标表示每个核苷酸位点上的0.1替换值
Note: Numbers in parentheses represent the accession numbers of the related isolates in Gen Bank,the numbers in each branch points denote the percentages supported by bootstrap. Scale bar represents 0.1 substitutions per nucleotide position
图5 基于rDNA-ITS序列构建的系统发育树
Fig.5 Phylogenetic tree based on rDNA-ITS sequences
3 讨 论
Peyronellaeaglomerata(Corda) Goid. ex Togliani与Phomaglomerata(Corda) Wollenw. & Hochapfel为同物异名[8],其中文译名为头状茎点霉。迄今,关于该菌作为植物病原菌的报道有很多,可为害近百种植物,常造成丝葵枯萎病[8]、无花果叶斑病[9]、牡丹枝枯病[10]、五味子树叶斑病[11]、黄瓜叶斑病[12]、葡萄茎枯病[13]、开心果的枝枯病[15]、藤蔓植物花枯病[14]及多种植物(草坪早熟禾[16]、豌豆[17]、马铃薯[18]、山茱萸[19])的叶枯病等。根据所掌握的资料,头状茎点霉在枣上的侵染为新寄主记录。
研究从多次重复回接过程中发现,病原菌对健康组织的侵染力较弱,主要从伤口侵入,引起褐色坏死斑,虽与田间的花叶症状及畸果症状有较强的共存性,但不是引起花叶和畸果症状的病原,而是与花叶病混合发生的病害,且与花叶病有着某种非必然的联系。目前已有枣花叶病及其病原和传媒的相关报道,但花叶病与头状茎点霉的侵染有何关系值得研究。一种简单的推论是花叶病削弱了叶果抗病性,致使弱侵染的头状茎点霉较易侵染。此外,头状茎点霉是否可以带毒、传毒,花叶病毒与头状茎点霉之间是否存在协同侵染等问题有待进一步的研究。
4 结 论
从病样上分离获得的主要分离物接种到离体叶和幼果后出现与直接采集到的病样症状基本相似的坏死病斑,确定其为枣叶、果褐色坏死斑的病原菌;病原菌的分生孢子器平均大少约108.2~214.8 μm,分生孢子平均大少约(3.4×8.5) μm,与P.glomerata的形态特征基本相似。使用引物ITS1/ITS4对3个菌株的rDNA进行PCR扩增,经测序均得到大小517、523 和529 bp的rDNA-ITS序列。将该这些序列与Gen Bank中相关菌株的ITS序列进行同源性比较,其相似度与PeyronellaeaglomerataSynonymPhomaglomerata均达到99%。结合形态观察及分子鉴定将该病原菌鉴定为头状茎点霉(Peyronellaeaglomerata(Corda) Goid. ex Togliani)。其分类归属为真菌界,半知菌类,腔孢纲,球壳孢目,茎点霉属。

