不同辣椒品种果实发育过程中DNA甲基化的MSAP分析
李宁,帕提古丽·艾斯木托拉,杨生保,王柏柯,唐亚萍,杨涛,余庆辉
(新疆农业科学院园艺作物研究所,乌鲁木齐 830091)
0 引 言
【研究意义】辣椒(CapsicumannuumL.),也可称为番椒、辣茄等,隶属茄科(solanaceae),辣椒属(C.apsicumL.),主要产地分布于南北美洲、亚欧大陆以及大洋洲[1]。辣椒红素作为目前销售量最大的纯天然的色素,被广泛应用到各行各业中去。在国内农作物市场上,而每年辣椒红素的产量大约是2 000 t[2]。新疆制干加工型辣椒年种植面积达3.5×104hm2,干椒年产量15×104~20×104t,辣椒成为新疆发展红色产业的重要支柱作物。【前人研究进展】辣椒果实中的主要色素是辣椒红素和辣椒玉红,通过辣椒红素-辣椒玉红合酶(CCS)由辣椒特有的类胡萝卜素路径合成[3]。辣椒拥有高度进化的类胡萝卜素合成路径,前人采用基因克隆技术得到了辣椒红素相关的部分基因,辣椒中尚未发现有哪个单基因突变可影响色素含量的差异[4]。对辣椒红素的表观遗传及其调控机制缺乏系统研究。辣椒中胞嘧啶位点的甲基化是影响其外形的较为明显的修饰形式,DNA甲基化能够对作物的外表、生长发育的情况等其他方面产生重要的影响。经过大量的实验,其结果和数据都能够证明DNA甲基化在植物逆境胁迫响应以及生长等重要的生命进程有明显的影响,DNA甲基化的发生还会引起基因沉默以及功能蛋白的缺失,导致于植物性状发生改变[5-7]。MSAP(methylation-sensitive amplified polymorphism)法用以同裂酶HpaII和MspI当做高频切割酶来取代AFLP(amplified fragment length polymorphism)中的MspI。其他遵循标准的AFLP分析[8]。在同裂酶(如HpaII和MspI)的众多特性中,其能够准确的分辨出序列中的甲基化,使得DNA进行不同的片段切割方式,产生出不同的切割片段来对甲基化位点进行表示[9-10]。【本研究切入点】目前,关于辣椒红素表观遗传机制的研究仍未见报道,鲜见对辣椒果实发育过程中的DNA甲基化变化的研究。结合MSAP技术,研究不同品种辣椒果实发育过程DNA甲基化的状态和模式的变化。【拟解决的关键问题】以7月下旬到10月上旬2个取材时期的GB14和GB38两个辣椒品种果实为研究对象,以DNA甲基化敏感扩增多态性(methylation sensiitve amplified polymorphism,MSAP)技术为基础,对各时期辣椒果实基因组甲基化变化进行观察和研究。并对甲基化表现呈多态性变化的8个片段回收、测序分析。为揭示辣椒红素的表观遗传机制以及辣椒高红素品种的选育奠定基础理论参考依据。
1 材料与方法
1.1 材 料
采用辣椒红素低的GB14和辣椒红素高的GB38两个辣椒品种不同发育阶段(绿熟期、红熟期)的果实。引物(上海生工,中国);植物总DNA提取试剂盒,纯化试剂盒,DNA marker、克隆载体试剂盒,RNase-Free ddH2O,dNTP、10×buffer及内切酶均使用北京博迈德生物技术有限公司所生产的产品,而其余的实际都是分析纯级别的试剂。
1.2 方 法
1.2.1 基因组DNA提取
采用北京博迈德植物总DNA提取试剂盒提取总DNA,将DNA溶于ddH2O中,进而对此进行琼脂糖凝胶电泳和紫外分光光度计的实验,在完成这两项实验之后将剩余溶液放入-20℃的冰箱中密封保存,以备下次实验之用。
1.2.2 MSAP分析
甲基化敏感扩增多态性(MSAP)以Christoph等[8]的方法为基础,进行适当的完善,再此试验中使用EcoRⅠ/MspⅠ和EcoRⅠ/HpaⅡ连个双酶切组合。表1
酶切反应中,DNA样本(200 ng/μl)2 μL,10×Buffer 4 μL(50 mM KAc,20 mM Tris-acetate,10 mM MgAc2,1 mM dTT 2 μL),10 U/μLEcoRⅠ和HpaⅡ内切酶各0.8 μL,加水至20 μL,37℃保温过夜。
在进行连接反应的过程中,在其实验原料中酶切片中进行与人工设计的与EcoRⅠ和HpaⅡ/MspⅠ酶切位点互补的拼接工作,其中接头连接体系为40 μL,20 μL酶切产物,10×T4 Buffer 4 μL,20 μM的EcoRⅠ和HpaⅡ/MspⅠ接头各0.8 μL,5 U/μL连接酶2 μL,其余用水补齐,16℃过夜。
表1 用于MSAP分析的接头和引物序列
Table 1 Adapters and primers used for MSAP analysis

接头与引物Connectors and Primers引物序列 (5'-3')Primer sequenceEcoR I接头EcoR I ConnectorsCTCGTAGACTGCGTACCAATTGGTACGCAGTCTACHM接头HM ConnectorsGACGATGAGTCCTGAGCGCTCAGGACTCAT预扩增引物Pre-Amplified PrimerGACTGCGTACCAATTC(E00)GATGAGTCCTGAGCGG(HM00)选择性扩增引物Selective Amplification PrimerGACTGCGTACCAATTCACC(E1)GACTGCGTACCAATTCACG(E2)GACTGCGTACCAATTCCAT(E3)GACTGCGTACCAATTCGTA(E4)GACTGCGTACCAATTCGTG(E5)GACTGCGTACCAATTCTCT(E6)GATGAGTCCTGAGCGGAGC(H1)GATGAGTCCTGAGCGGAGG(H2)GATGAGTCCTGAGCGGATC(H3)GATGAGTCCTGAGCGGCTC(H4)
预扩增反应体系为20 μL,其中含有酶切产物2 μL,10 mM dNTPs 0.4 μL、10×Buffer(25mM Mg2+)2 μL、5 U/μLTaq酶0.2 μL、10 μM E00-primer 0.5 μL、10 μM M00-primer 0.5 μL,其余用水补齐。反应条件为:94℃ 30 s,56℃ 1 min,72℃ 1 min,26个循环,在72℃的条件下进行10 min。将预扩增产物的溶剂稀释20倍,以保证后续的实验过程能够顺利完成。
选择性扩增体系与预扩增体系相同。其PCR仪上设定的条件和过程是:在94和65℃到56℃之间分别持续30 s的时间,在72℃的时候持续1 min,其退火温度在每个循环之后下降0.7℃,之后进行降式PCR扩增。在上述三个温度段内往复进行23次,再在72℃延伸10 min。
将扩增PCR产物中假如适量的缓冲溶液,在94℃时,持续10 min使其充分的变性,之后把6%的变性聚丙烯酰胺凝胶加入到得到的溶液中去,进行垂直方向的电泳分析,之后在使用硝酸银进行染色,在经过水的漂洗以及氢氧化钠显色等项目。在对得到的电泳条带进行相应的分析。
1.2.3 特异性条带回收测序
在上述实验后获得的聚丙烯酰胺凝胶上选取差异较大的条带进行取样,把样品放入适当的容器中在放入20 μL的TE缓冲液(pH值8.0),进行沸水浴,时间为10 min、等其完成沉淀之后,抽取3 μL的上清液作为对比对象。适应相同类型的引物和反应体系进行相同的实验步骤,之后再用0.8%的琼脂糖凝胶电泳进行分离操作,最后同样使用北京博迈德生物技术有效公司生产额纯化试剂盒进行最后的实验。完成此实验后,将两次实验获取的物质送往上海生工测序公司进行更较准确的测序。
2 结果与分析
2.1 DNA琼脂糖检测
在进行辣椒果实DNA质量检测时使用0.8%的琼脂糖,研究表明,在该DNA中,其结果是一条单带,并且没有讲解现象的发生,在之后进行的紫外分光光度计试验中证实了其DNA纯度较高的猜想。图1
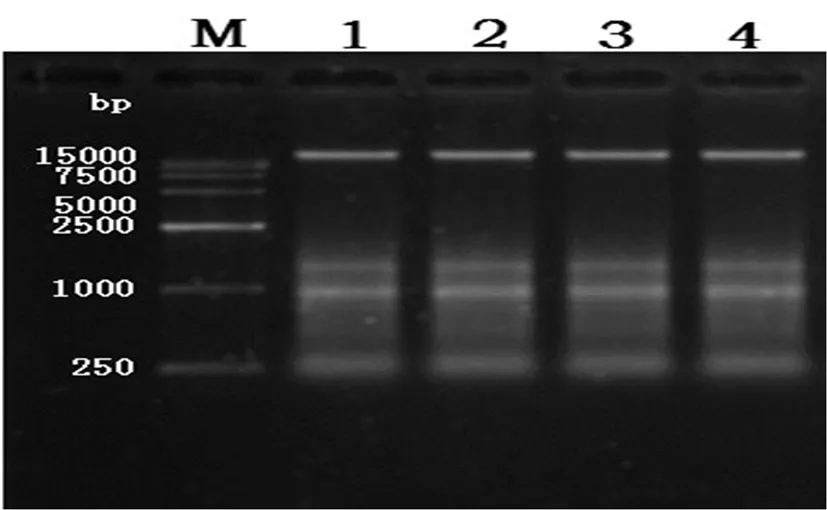
图1 辣椒果实DNA检测结果
Fig.1 DNA test results of Capsicum fruit
2.2 PAGE电泳检测结果
在进行了优化预扩增反应体系后,预扩增产物进行50倍的稀释操作,所得到的溶液取用1 μL作为实验的对比对象,再取用10 μL进行接下来的实验操作。共组合成24对引物进行筛选。在100~800 bp选择扩增条带致密、多态性高的引物组合。在现有的24对组合中,通过对比分析,选出4对较为有实验价值的组合进行了MSAP检测。表2
表2 24对选择性扩增引物组合
Table 2 24 pairs of selective amplified primer combinations
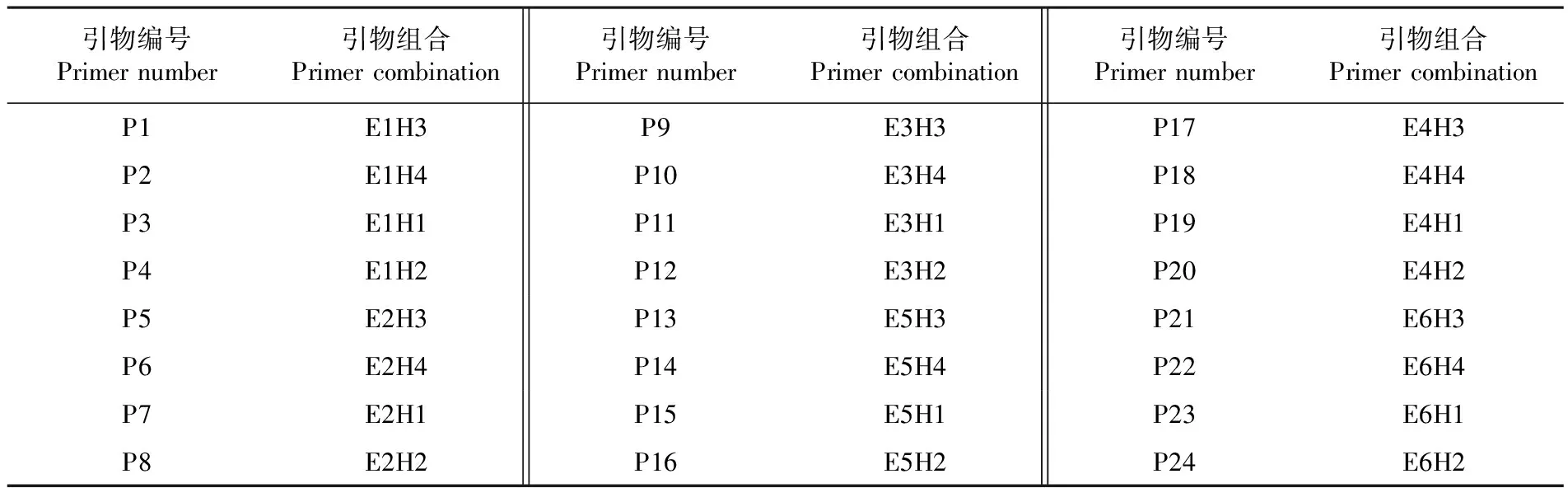
引物编号Primer number引物组合Primer combination引物编号Primer number引物组合Primer combination引物编号Primer number引物组合Primer combinationP1E1H3P9E3H3P17E4H3P2E1H4P10E3H4P18E4H4P3E1H1P11E3H1P19E4H1P4E1H2P12E3H2P20E4H2P5E2H3P13E5H3P21E6H3P6E2H4P14E5H4P22E6H4P7E2H1P15E5H1P23E6H1P8E2H2P16E5H2P24E6H2
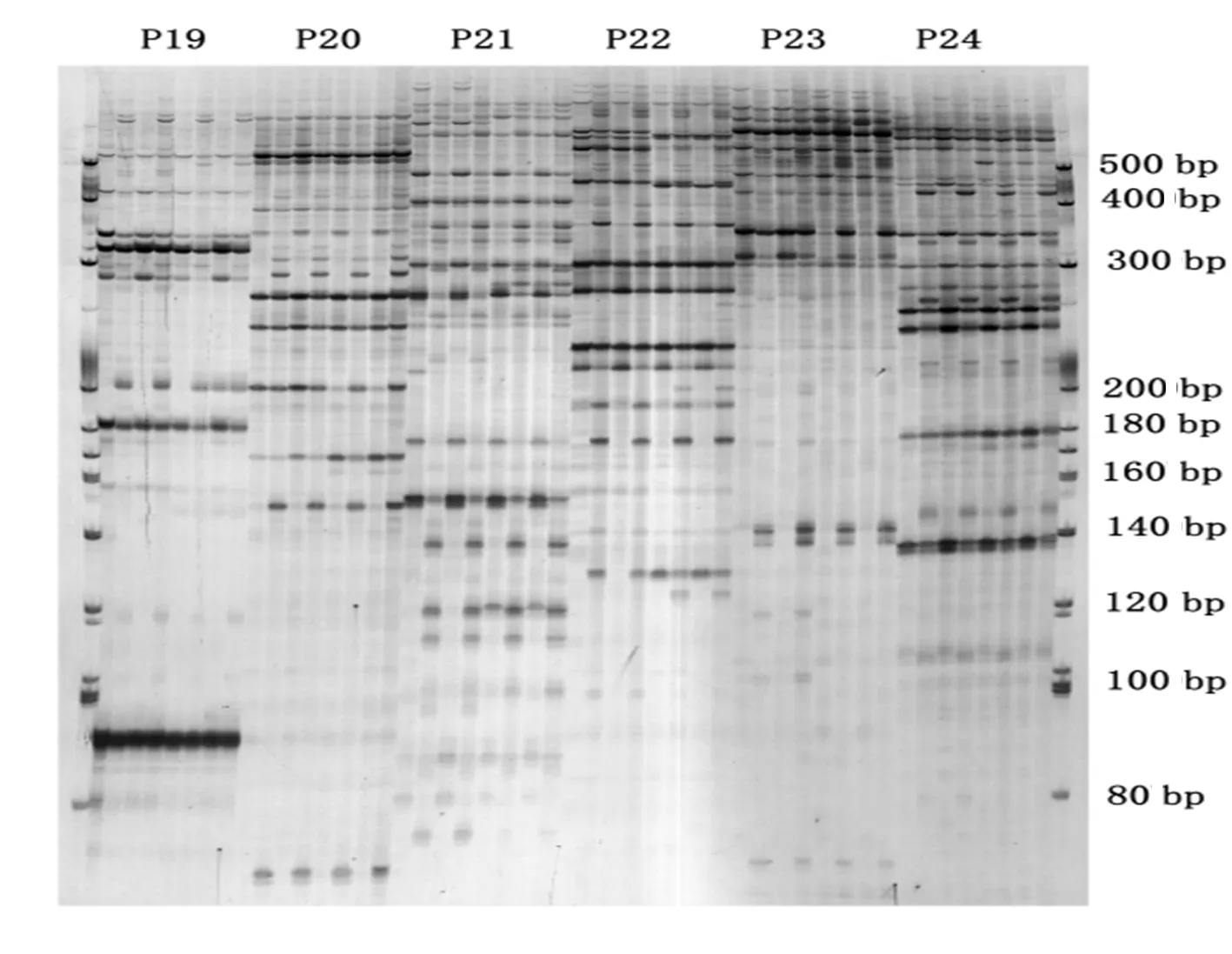
图2 两个辣椒品种的果实发育不同时期DNA甲基化电泳
Fig.2 DNA methylation electrophoresis of two capsicum cultivars in different developmental stages
表3 辣椒基因组DNA甲基化修饰位点序列Blast分析
Table 3 Results of blast analysis of gene methylation modified loci of capsicum genome
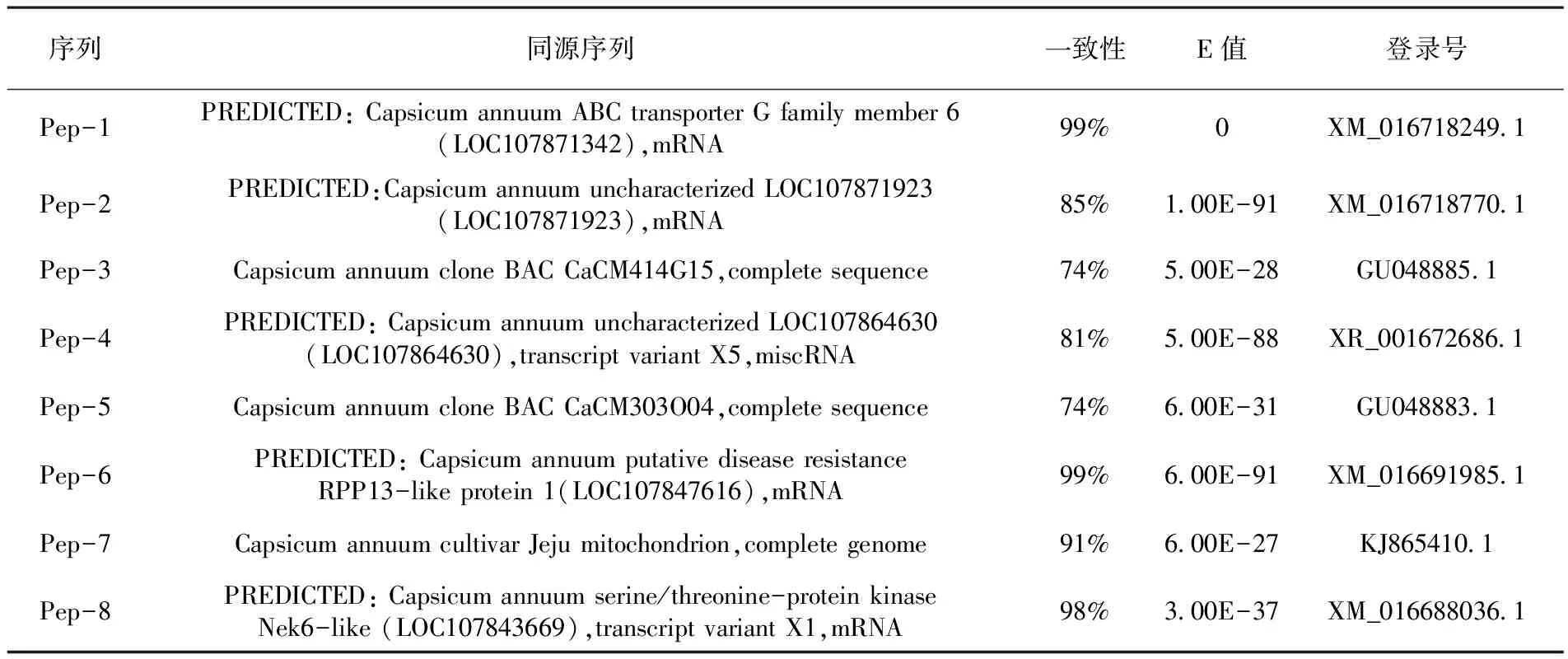
序列同源序列一致性E值登录号Pep-1PREDICTED: Capsicum annuum ABC transporter G family member 6(LOC107871342),mRNA99%0XM_016718249.1Pep-2PREDICTED:Capsicum annuum uncharacterized LOC107871923(LOC107871923),mRNA85%1.00E-91XM_016718770.1Pep-3Capsicum annuum clone BAC CaCM414G15,complete sequence74%5.00E-28GU048885.1Pep-4PREDICTED: Capsicum annuum uncharacterized LOC107864630(LOC107864630),transcript variant X5,miscRNA81%5.00E-88XR_001672686.1Pep-5Capsicum annuum clone BAC CaCM303O04,complete sequence74%6.00E-31GU048883.1Pep-6PREDICTED: Capsicum annuum putative disease resistance RPP13-like protein 1(LOC107847616),mRNA99%6.00E-91XM_016691985.1Pep-7Capsicum annuum cultivar Jeju mitochondrion,complete genome91%6.00E-27KJ865410.1Pep-8PREDICTED: Capsicum annuum serine/threonine-protein kinase Nek6-like (LOC107843669),transcript variant X1,mRNA98%3.00E-37XM_016688036.1
2.3 测序结果
对10个辣椒基因组DNA甲基化修饰位点进行了相关的操作之后,得到了8条DNA甲基化修饰位点的核苷酸序列。使用BLASTn对此8条核苷酸序列进行分析,辣椒基因组DNA中有转录调控因子(Pep-5)、反转录转座子(Pep-3)、跨膜蛋白(Pep-5)、选择性剪切体(Pep-4、Pep-5)、通道蛋白(Pep-9)、蛋白激酶(Pep-3)、葡萄糖基转移酶(Pep-4)等多种类型的DNA序列中假定蛋白(Pep-2、Pep-3、Pep-4、Pep-5、Pep-8)、核糖体蛋白(Pep-6)、硫氧还蛋白(Pep-2)、均存在甲基化修饰现象[9]。表3
2.4 甲基化类型
辣椒果实DNA经HpaII/EcoRI(H)和MspI/EcoRI酶切后会生成四种不同的甲基化类型,这四种甲基化类型可以通过聚丙烯酰胺凝胶进行电泳实验而得到,这四种甲基化类型可以分为一下几种情况:类型I(TypeI)、类型II(TypeII)、类型III(TypeIII)、在这三种情况下,类型I可以表示非甲基化,在H和M用到都有条带的形成,而其余两种分别可以表示单链甲基化和双链甲基化,其条带也分别可以在H和M用到上看到,而且III类型在M泳道上的条带为对各时间点采集的有野的MSAP条带统计。两种辣椒果实绿熟期和红熟期的基因组单链甲基化(TypeII)类型条带数分别为880、885、904、916,双链甲基化(TypeIII)类型条带数分别为为155、164、168、184,而超甲基化类型(TypeIV)条带数分别为64、74、28和24。总体甲基化比例公式为MSAP%=(TypeII+TypeIII+TypeIV)/(TypeI+TypeII+TypeIII+TypeIV)%[11],在此基础上,可以知道,两种辣椒果实绿熟期和红熟期基因组总体甲基化比例分别为36.51%、36.38%、35.57%和35.45%。两种辣椒果实绿熟期和红熟期,在扩增的甲基化位点变化的过程中,基因组DNA的甲基化与果实发育时间呈反比,当其时间越长,其总体的甲基化比例就会下降。表4
表4 辣椒果实发育不同时期下DNA甲基化水平
Table 4 Effects of the DNA methylation levels in different stages of capsicum fruit development

甲基化类型Methylation type不同时间点采集的甲基化谱带统计Methylation bands statistics in Different time points collected samples(%)GB14绿熟期GB38绿熟期GB14红熟期GB38红熟期类型1 Type I880885904916类型2 Type II155164168184类型3 Type III287268303295类型4 Type IV64742824
Note:TypeI:representsnon-methylated,typeII:representssingle-strands methylated,typeIII:represents double-strands methylated,TypeIV:represents super-methylated
3 讨 论
基因的甲基化作为一种重要的表观遗传调控方式,在高等植物的基因组表达调控中发挥着重要作用。辣椒是一种非模式植物,针对辣椒基本开展的各种与基因相关的研究还没有取得突破性的进展。在试验中,针对辣椒果实在着色成熟的过程中进行了细致的研究,同时发现在此过程中DNA甲基化修饰发生了巨大的变化。两种辣椒果实在不同发育阶段对比,GB14和GB38辣椒果实的绿熟期和红熟期的总体甲基化水平依次分别是36.51%、36.38%、35.57%和35.45%,GB14的果实甲基化水平在红熟期不断降低。而在GB38的果实生长至成熟的过程中,CCGG位点的半甲基化迅速升至较高的水平,在64.5%处发生了停顿,与此同时全甲基化位点的百分比为13.21%。
有研究发现,DNA甲基化不仅参与植物生长发育调控并在植物逆境胁迫响应中发挥作用[12],而且在树木年龄效应中也具有重要的调控作用。任茂等[13]对棉花高温胁迫诱导,发现高温能够诱导棉花甲基化水平的提高,同时棉花耐热性高低与DNA甲基化水平及状态变化存在重要关系。李廷春等[14]对紫玉米生长发育过程MSAP分析结果显示,紫玉米籽粒在授粉后,DNA半甲基化条带和全甲基化条带的百分比与玉米粒的生长发育呈正比例的关系,而且甲基化发生的区域并没有明确的划分。Bitonti等[15]针对桃子也开展了DNA甲基化对植物自身影响的实验,实验发现,通过对DNA中甲基化程度的干预,可以实现控制植物生长周期记忆果实成熟的目的。DNA甲基化水平对于植物的生长有重要的作用[16-17]。在实验中,GB14和GB38两个不同品种的果实在不同发育阶段DNA甲基化水平变化也不同,推测辣椒种群分化及物种进化也与DNA甲基化水平有关。
MSAP体系中包括了对于基因的提取、酶切、连接等程序。较好的电泳图谱是试验获得成功的重要前提条件;而酶切反应是该体系的关键操作,好的酶切反应操作可以帮助科研人员获得较为清晰的条带及相关资料。酶切试验被给予了充分的反应时间,酶连产物用量关系到预扩增产物浓度,会影响后续操作;预扩增产物不仅可以当做选择性扩增的模板来使用,同时还可以对模板进行纯化,所以在进行溶液稀释的时候要谨慎小心,同时此操作对于整个实验也有至关重要的作用。
4 结 论
辣椒红素低的GB14和辣椒红素高的GB38的果实在不同发育阶段对比,两种辣椒果实的绿熟期和红熟期的总体甲基化水平依次分别是36.51%、36.38%、35.57%和35.45%,对比两个品种的辣椒生长过程,对甲基化中8个片段进行研究,DNA的甲基化的发生不受编码区和非编码区的限制,在这两种区域中都有可能发生。

