从代谢角度研究有氧耐力运动降血脂效应及其机制
王学坤, 苑庭刚, 王逸群
(1.安徽师范大学 体育学院,安徽 芜湖 241003;2.国家体育总局 体育科学研究所 北京 100763)
肥胖主要是因脂肪在机体内的大量堆积所造成。而肥胖导致的糖脂等代谢紊乱是心脑血管疾病、2型糖尿病等疾病的重要诱因[1-3]。有氧耐力运动被普遍认为是改善血脂的有效运动形式[4]。长时间耐力运动中机体能耗需求增加,脂肪动员供能增加,使得甘油三酯、内源性甘油三酯和胆固醇合成下降[4]。研究亦证实,持续锻炼可使肥胖小鼠血液总胆固醇和低密度脂蛋白(LDL)含量下降,并使得高密度脂蛋白(HDL)水平增加[5,6]。但是目前体育科学领域内,探究不同强度有氧耐力运动影响肥胖小鼠血清及组织器官各代谢酶活性的相关研究还较少。Hu等报道有氧游泳训练通过调节脂肪转运与合成以及β-氧化有关酶基因的表达预防高脂饮食诱导的脂肪肝病发生[7],Aoi等进一步报道了有规律的锻炼通过上调脂肪分解关键酶基因如肉碱-脂酰辅酶A转移酶、脂酰辅酶A脱氢酶等在肝脏中的表达,增强脂肪的氧化分解,从而可有效预防由高糖饮食诱导的脂肪肝发生[8],Sampedro-Piquero等研究提示耐力运动可使大脑的细胞色素氧化酶活性增强[9],Tomiga等最新研究发现小鼠运动训练可增强其大脑皮层一氧化氮合成酶的表达从而可能是实现肥胖小鼠减肥的中枢机制之一[10]。由于生物体的一切代谢都是酶促反应,因此运动减肥势必会涉及到代谢酶类活性的改变。为了对运动减肥的机制有一个比较深入的了解,本研究利用不同强度的有氧耐力运动对肥胖小鼠进行运动干预,研究小鼠糖代谢、脂代谢、脂蛋白代谢与转化、能量代谢等某些重要酶活性的变化,旨在为运动减肥的理论研究及其推广提供较全面的实验依据,并从分子水平进一步阐明运动减肥的部分机制。
1 材料和方法
1.1 实验动物
90只6周龄雄性昆明系小鼠,体重(19.02±2.15g),购自南京青龙山实验动物养殖场,适应性喂养1周后,随机分为正常饲料对照组(NC组)、高脂饲料对照组(HC组)、运动大组1(为有氧耐力运动+高脂饲料组,根据游泳时长又设短、中、长3组,分别为HES1、HEM1、HEL1)、运动大组2(为有氧耐力运动+正常饲料组,同样根据游泳时长分为短、中、长3组,分别为HES2、HEM2、HEL2),除NC和HC分别为15只外,其余各组均为10只。动物基础饲料和高脂饲料(配方:在基础饲料中加入2%胆固醇、20%猪油、0.5%胆酸钠。)均购于南京青龙山实验动物养殖场。
1.2 试剂和仪器
甘油三酯测定试剂盒、胆固醇测定试剂盒、高密度脂蛋白-胆固醇测定试剂盒皆购于上海复旦张江生物医药股份有限公司,溶血磷脂酶购于Sigma产品,细胞色素氧化酶(CCO)测定试剂盒、柠檬酸合酶(CS)测定试剂盒购于上海酶联生物科技有限公司,长链羟脂酰辅酶A脱氢酶(HACD)测定试剂盒购于上海宝曼生物科技有限公司,脂蛋白脂酶(LPL)测定试剂盒为南京建成生物工程研究所产品,其它所有试剂皆为分析纯。HITACHI7020型全自动生化分析仪,Multiskan FC酶标仪,752型紫外可见分光光度计(购于上海分析仪器厂)。
1.3 实验设计
NC组小鼠利用基础饲料进行喂养,其余各组均采用高脂饲料进行高血脂小鼠造模。8周后,在NC和HC组随机各取小鼠5只,禁食18h,摘除小鼠眼球取血,血液在3200r/min条件下,离心10min,取血清测定血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量。造模成功后,运动组HES1、HEM1、HEL1以及HES2、HEM2、HEL2进行无负重游泳运动,NC和HC组不参加运动。
运动组在长120cm、宽60cm、高60cm的玻璃缸中(静水深32cm,水温29~32℃)。运动组小鼠每天游泳1次,第1周HES组为10min,HEM组为20min,HEL组为30min;第2周HES组为20min,HEM组为30min,HEL组为40min;第3周、第4周各运动组游泳时间依此递增,每周6d,休息1d。小鼠末次游泳训练后,所有小鼠禁食18h,同样摘除小鼠眼球取血,血液在3200r/min条件下,离心10min,取血清测定TC、TG、HDL-C、LDL-C含量。同时,分别取适量血清测定血清卵磷脂胆固醇脂酰转移酶(LCAT)、柠檬酸合酶(CS)。另外,取小鼠肝脏和心脏,用冷生理盐水冲洗后用滤纸吸干其表面水分,分别制成10%肝匀浆和10%心匀浆,在4℃条件下按4000r/min离心10min后,取其上清液分别测定小鼠肝脂酶(HL)、肝长链羟脂酰辅酶A脱氢酶(HACD)和心脂蛋白脂酶(LPL)、心细胞色素氧化酶(CCO)活性。
TC、TG、HDL-C以及LDL-C均采用全自动生化分析仪进行测定。LDL-C含量计算按公式LDL-C(mmol/L)=TC-(HDL-C+TG/2.2)。LCAT活性测定按照比色法定量检测试剂盒方法测定[11,12],CS、CCO活性采用ELISA法按照测定试剂盒要求进行测定,以标准物的浓度为横坐标,OD值为纵坐标,在坐标纸上绘出标准曲线,根据样品的OD值由标准曲线查出相应的浓度[13]。HACD按照测定试剂盒要求用比色法进行测定。
HL和LPL活性测定根据试剂盒说明测定生成的FFA含量并分别计算出HL、LPL活性(单位:μgFFA/mL上清液/h)[14]。
1.4 数据处理
2 结 果
2.1 肥胖小鼠造模的结果
经过8周对小鼠进行高血脂造模,结果见表1。
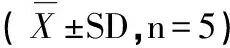
表1 8周造模后小鼠血脂水平的变化
注:与对照组NC相比*P<0.05,**P<0.01。
分析表1可知,HC组与NC组相比,其TC与TG含量均显著升高,P<0.05;LDL-C含量更是极显著性升高,P<0.01,而HDL-C含量有显著性下降,P<0.05,HDL-C/TC也有显著性下降,P<0.05,说明高血脂模型组造模成功。
2.1 有氧耐力运动对小鼠血脂水平的影响
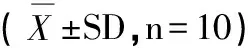
表2 有氧耐力运动对小鼠血脂水平的影响
注:与HC相比*P<0.05,**P<0.01;与NC组相比&P<0.05,&&P<0.01;HE2与HE1组相比#P<0.05。
由表2可知,HC组与NC组相比,其TC与TG含量更是显著升高,P<0.05;LDL-C含量极显著性升高,P<0.01,HDL-C含量更具有显著性下降,P<0.05,HDL-C/TC也有显著性下降,P<0.05,进一步说明高血脂模型组造模成功。HES组、HEM组和HEL组的TC、TG含量与HC组相比均显著降低(P<0.01或P<0.05),且HEL1组、HEL2组与NC组相比无显著性差异;HES组、HEM组和HEL组的HDL-C含量与HC组相比具有显著性升高(P<0.01或P<0.05),且HDL-C/TC比值与HC组相比亦均显著升高(P<0.05);而LDL-C的含量则随着有氧耐力运动时间的增加而降低(P<0.05),HEL组与NC组相比不具有显著性差异(P>0.05)。HES2、HEM2组与HES1、HEM1组的TC、TG以及LDL-C含量相比,均有显著性降低,P<0.05;而HEL2组与HEL1组各指标相比均无显著性差异,说明在某种程度上,一定时间的耐力运动可能对降血脂的作用比饮食控制更为重要。
2.2 有氧耐力运动对小鼠血清LCAT以及CS活力的影响
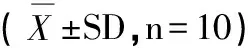
表3 有氧耐力运动对小鼠重要代谢酶活力的影响
注:与HC相比*P<0.05,**P<0.01;与NC组相比&P<0.05。
分析表3可知,NC组小鼠血清LCAT以及CS活力与HC组相比均无显著性差异。而HES组、HEM组和HEL组LCAT活力与HC组相比均显著升高(P<0.05);且与NC组相比亦显著升高(P<0.05),存在运动时间长度与酶活性的正相关。CS活力在HEM组和HEL组也均显著高于NC以及HC组(P<0.05),HEs组活性虽较NC组和HC组高,但没有统计学意义。
同样由表3可知,除NC组心LPL活力HC组相比具有显著差异,即NC组高于HC组(P<0.05),其余三种酶活力两组间并无显著性差异,HES组、HEM组和HEL组与HC、NC组相比各酶活力均显著升高(P<0.05),随着运动时间加长各酶活性升高越明显,运动时间与酶活力升高幅度呈正相关。
但同样的运动时间长度,高脂饲料组HE1与基础饲料组HE2相比,几乎所有酶活性显示出HE1各组高于HE2各组,但没有显著性差异。
3 讨 论
高脂血症是导致动脉粥样硬化和冠心病的主要危险因素。研究发现,血脂降低可减缓粥样硬化斑块的形成进程,在一定程度上还可使其逐渐消退,降低冠心病的病死率[2-4]。研究表明,在高脂血症的相关指标中,TC及LDL-C水平与心血管疾病发病率之间呈密切正相关,而HDL-C升高可降低心血管病的发病率[14,15]。有氧运动可显著改善肥胖人群的高脂血症,有研究表明一组肥胖人群经过4周的有氧耐力训练,体重明显下降、体脂百分比和血脂显著降低[16]。本研究结果发现,在本实验的不同运动时间下,有氧耐力运动降脂效果与其运动时间密切相关,即运动时间越长降脂效果越佳。当然,运动结合低脂饮食其升高的血脂降低越明显。
从代谢角度全面阐释运动降血脂的机理目前的报道还不多。本研究表明运动可以加快脂肪的降解、糖的有氧代谢、能量转化和利用,促进胆固醇转化以及脂蛋白的转化与代谢。脂肪酸降解的主要途径是β-氧化,羟脂酰辅酶A脱氢酶(HACD)是β-氧化中四个重要的分解酶之一,研究发现随着有氧耐力运动强度的增加,HACD的活性越高,表明运动可促使HACD基因表达上调,促进脂肪酸的降解,这不仅与Aoi报道的有规律的锻炼通过上调脂肪分解关键酶基因如肉碱-脂酰辅酶A转移酶、脂酰辅酶A脱氢酶(β-氧化中的另一个脱氢酶)等在肝脏中的表达结果一致[8],也证明了运动量与脱氢酶活性的相关性。
无论是糖有氧氧化还是脂肪酸β-氧化生成的乙酰辅酶A在机体内有几条出路,如分解产生能量或合成脂肪或胆固醇等。当机体需要能量时,乙酰辅酶A会通过三羧酸循环进行氧化,而柠檬酸合酶(CS)则是乙酰辅酶A进入三羧酸循环的第一个关键酶,该酶控制着三羧酸循环的入口,决定了糖、脂肪等的氧化速度,本研究首次表明有氧耐力运动可增加CS的活力,促进糖和脂肪的氧化利用,并且运动时间长度与该酶活力成正相关。
尽管三羧酸循环是糖、脂肪、甚至是蛋白质彻底氧化分解的共同途径,但真正能量的产生则需要通过线粒体的呼吸链将物质代谢脱下的氢传递给氧,在此过程中产生能量(ATP)。已有研究提示耐力运动可使大脑的细胞色素氧化酶(CCO)活性增强[9],本研究测定了肝线粒体CCO活性在高脂饮食对照组(HC)最低,而有氧耐力运动该酶活性显著增高,并且具有运动时间和酶活性的正相关。CCO是线粒体中2条呼吸链的共有末端组分,催化电子从细胞色素C到氧原子的传递,是线粒体氧化磷酸化的限速酶,在整个能量代谢中发挥着重要的作用,CCO活性升高,氧气的利用增多,物质代谢速度加快,能量产生增加。
由此,不难发现,有氧耐力运动促使了脂肪酸β-氧化—三羧酸循环—氧化磷酸化整个连续过程,促进了物质的氧化分解和能量的利用,从而减少了脂肪和胆固醇的生成,是降低胆固醇的有效措施。
LCAT是血浆胆固醇酯化、HDL成熟和胆固醇逆向转运过程的关键酶,对于动脉粥样硬化形成具有重要的保护作用[18]。LCAT作用于HDL分子表面的卵磷脂,使其Sn-2脂酰基转移至胆固醇生成胆固醇酯(CE),通过胆固醇酯转运蛋白的作用,与极低密度脂蛋白(VLDL)及低密度脂蛋白(LDL)的TG进行交换,为肝脏摄取与代谢[19]。有研究显示遗传性LCAT缺乏杂合子个体动脉粥样硬化明显增加[20]。而有关运动影响肥胖小鼠LCAT的研究较少,本实验结果表明,运动可使LCAT活力增加,且增加幅度与有氧耐力运动有关,这提示运动过程中脂类代谢相关酶系统做出相应改变,脂蛋白转换增强。LPL是调节脂蛋白代谢的另一种关键酶,由心、脂肪、骨骼肌细胞等合成后分泌入血与毛细血管内皮细胞表面的糖萼结合,作用于血循环中的乳糜微粒(CM)及VLDL内核的TG,使之水解,释出游离脂肪酸(FFA)[21]。有关运动影响肥胖小鼠LPL的研究较少,但运动会提高LPL活力这几乎是共识的[22]。本研究发现,有氧耐力运动各组小鼠心LPL活力均升高,提示有氧耐力运动小鼠脂蛋白代谢与转化速率加快,释放出的FFA氧化分解以提供组织细胞需要的能量。
HL由肝实质细胞合成后转运到肝窦状隙内皮细胞表面发挥作用[23]。HL是参与脂蛋白代谢的关键酶,是脂肪酶家族成员。HL能识别并结合血浆中的HDL2及HDL3,水解HDL2中的TG及磷脂,使HDL2转变为HDL3,通过该过程实现肝外组织TC向肝细胞的转运[24]。肝组织HL能促进肝细胞摄取TC和CM残粒,降低血浆TG及TC,且HL还具有促进餐后血脂清除的作用。因此,HL的合成、分布、活性变化与高脂血症、脂肪肝、动脉粥样硬化等密切相关,HL活性的降低,可引起高脂血症,并在脂肪肝发病中起重要作用[18]。有关运动影响高血脂小鼠HL的研究文章尚未见报道。有氧耐力运动各组小鼠均表现出HL活性的升高,进一步说明有氧耐力运动可能会加快脂蛋白的代谢转化,促进脂肪酸氧化分解,降低血中脂肪酸含量。
但是研究表明同样的运动对于高脂饲料组各酶活性比基础饲料组更高,这可能与机体的调节功能密切相关,即当血脂高时,在运动的基础上,相关的酶表达增强促使脂类的氧化分解。
总之,本研究较好地揭示了有氧耐力运动可显著改善小鼠的高脂血症,降血脂作用与运动时间长短关系密切,而运动时间长度又与糖、脂肪、能量代谢重要酶活性密切正相关,运动增强糖与脂肪氧化分解和能量消耗、增加脂蛋白转化以及胆固醇逆向运输,减少肝脏脂肪和胆固醇合成,降低血脂水平。

