腌制处理对养殖大黄鱼品质的影响
,,, ,,,3, ,*
(1.浙江万里学院生物与环境学院,浙江宁波 315100;2.宁波市检验检疫研究院,浙江宁波 315012;3.宁波大学海洋学院,浙江宁波 315211)
大黄鱼(Pseudosciaenacrocea)是我国传统“四大海产”之首,是浙江沿海特色珍贵经济鱼类。在上世纪80年代,毁灭性捕捞导致野生大黄鱼几乎灭绝。为了改变这一现状,水产科技工作者开始研究大黄鱼的人工繁育和养殖技术,并于1985 年首次成功人工培育了大黄鱼鱼苗。随着育苗技术和养殖技术的不断成熟,养殖大黄鱼的产量逐年增加,现已成为我国八大优势出口养殖水产品之一,更是我国养殖规模最大的海水鱼类[1]。它具有营养丰富、味道鲜美、低脂肪、高蛋白等优点,是膳食平衡中不可或缺的重要组分,深受国内外消费者的喜爱[2]。养殖大黄鱼蛋白质含有多种氨基酸,且组成与人体组织蛋白相近,有较高的营养价值[3]。
养殖大黄鱼以鲜销为主,但养殖大黄鱼水分含量高、腐败菌组成复杂,不易保存[4],故有部分养殖大黄鱼去内脏后洗清,盐渍晒干制成“黄鱼鲞”或制成鱼罐头[5]。腌制食品作为传统风味产品,具有广大的消费群体,研究腌制处理对养殖大黄鱼的品质影响及作用机理对保证腌制食品安全、推广腌制食品市场将有主要意义。
腌制处理对鱼肉的口感、风味、营养成分等均有较大影响,特别是对其蛋白质变性具有较大影响[6],但目前对腌制处理的养殖大黄鱼研究主要集中在鲜度、营养成分及微生物菌群等方面,而在腌制处理对蛋白质的影响研究较少。本文通过盐渍处理养殖大黄鱼,分析其鲜度、蛋白特性、组织结构的变化及相互联系,为养殖大黄鱼的腌制工艺以及新产品的开发提供理论依据,有利于促进养殖大黄鱼加工产业化。
1 材料与方法
1.1 材料与仪器
新鲜养殖大黄鱼 体长(30±3) cm,体重(0.5±0.1) kg,宁波路林市场,用冰盒运回实验室;氯化钠(≥99.5%)、磷酸二氢钾(≥99.5%)、磷酸氢二钾(≥99.5%)、硫代巴比妥酸(≥99.5%)、甲基红(≥99.5%)、溴甲酚绿(≥99.5%)、硼酸(≥99.5%)、高氯酸(≥99.5%)、硫酸铜(≥99.5%)、酒石酸钾钠(≥99.5%)、溴酚蓝(≥99.5%)、乙酸乙酯(≥99.5%)、盐酸胍(≥99.5%)、二硝基苯腙(≥99.5%) 均为分析纯(AR),国药集团化学试剂有限公司;超微量Ca2+-ATPase酶试剂盒、微量总巯基测试盒 南京建成生物工程研究所。
PL2002电子分析天平 梅特勒-托利多仪器(上海)有限公司;Forma-725超低温冰箱 澳柯玛股份有限公司;centrifuge 5804R离心机 德国Eppendorf 5804R;YXQ-LS-50SII立式压力蒸汽灭菌锅 上海申安医疗器械厂;HWS型恒温恒湿培养箱 宁波江南仪器厂;7230G可见光光度计 上海舜宇恒平科学仪器有限公司;SKD-1000自动凯氏定氮仪 上海天齐生物科技有限公司;e2695高效液相色谱仪 上海瑞玢国际贸易有限公司;FE20pH计 梅特勒-托利多仪器(上海)有限公司;DK-8D恒温水浴锅 上海维诚仪器有限公司;BCD-216ZDJ可调式冰箱 青岛海尔股份有限公司;HWS-160恒温恒湿培养箱 宁波江南仪器厂;Universal TA物性分析仪 上海腾拔仪器科技有限公司;UV2000紫外分光仪 上海舜宇恒平科学仪器有限公司;131EVO差示扫描微量热仪 法国塞塔拉姆;MS-PB磁力搅拌器 上海圣科仪器设备有限公司;LGJ-10真空冷冻干燥机 上海实维实验仪器有限公司。
1.2 实验方法
1.2.1 养殖大黄鱼的腌制 养殖大黄鱼处理:去头、去尾、去鳞、去皮、去内脏,剖成两片,取背部肌肉,切成3 cm×3cm×1 cm大小块状,随机将样品分为两组,一组为空白对照组,另一组作为腌制组,将腌制组置于料液比3∶1的饱和食盐水中进行腌制[7],腌制温度为19 ℃,腌制时间为5 min。将两组样品置于4 ℃冰箱中放置24 h后待用。
1.2.2 肌原纤维蛋白的提取 参照Jiang[8]和Chin[9]的研究,稍作修改。取适量鱼肉,加4倍体积4 ℃预冷的提取液(20 mmol/L,pH7.5磷酸缓冲液),高速匀浆机7500 r/min匀浆60 s,7000 r/min冷冻离心10 min,去上清,重复匀浆离心两次,粗肌原纤维蛋白(MPI)匀浆60 s,4倍体积冰洗液(0.1 mol/L NaCl 溶液)7000 r/min冷冻离心10 min,去上清,重复匀浆离心一次。粗MPI匀浆60 s,4倍体积4 ℃预冷的3层纱布过滤,7000 r/min冷冻离心10 min,沉淀MPI后待用,用于Ca2+-ATPase、持水性、巯基、表面疏水性、羰基的测定。
1.2.3 pH的测定 取鱼肉样品10 g,参照GB 5009.237-2016食品pH的测定[10]进行检测
1.2.4 挥发性盐基氮(TVB-N)的测定 取鱼肉样品5 g,参照GB4789.2-2016食品中挥发性盐基氮的测定[11]进行检测。
1.2.5 K值(品鲜度)的测定 参照SC/T3048-2014鱼类鲜度指标K值的测定高效液相色谱法[12]进行测定。称取鱼肉样品(2±0.02) g于烧杯,均质后放入离心管内,加人20 mL 10%(v/v)高氯酸溶液,振荡1 min,然后在4 ℃,8000 r/min离心10 min,取出上清液。再用10 mL 5%(v/v)高氯酸溶液提取沉淀物中的待测物,4 ℃,8000 r/min离心10 min。重复操作一次,合并上清液。用10 mol/L的氢氧化钠溶液调节提取液pH至近6.0,然后再用1 mol/L的氢氧化钠溶液继续调节pH至6.0~6.4。将已调节pH后的溶液转移至50 mL容量瓶中,用4 ℃水定容。将定容后的溶液4 ℃,8000 r/min离心10 min,然后用0.22 μm微孔滤膜过滤,最后将滤液放入高效液相色谱仪检测。按照以下公式计算K值。
K(%)=(WHxR+WHx)/(WATP+WADP+WAMP+WIMP+WHxR+WHx)×100
式中:WATP-样品中腺苷三磷酸的含量,μmol/g;WADP-样品中腺苷二磷酸的含量,μmol/g;WAMP-样品中腺苷酸的含量,μmol/g;WIMP-样品中肌苷酸的含量,μmol/g;WHxR-样品中次黄嘌呤核苷的含量,μmol/g;WHx-样品中黄嘌呤的含量,μmol/g。
1.2.6 菌落总数的测定 取鱼肉样品5 g,参照GB/T4789.2-2016食品微生物学检测-菌落总数[13]测定进行检测。
1.2.7 硫代巴比妥酸值(TBA)的测定 参照鲁珺[14]的方法,各取5 g鱼肉样品研碎,加入25 mL 7.5%的三氯乙酸(含有0.1% EDTA),振荡摇匀,静置30 min后用双层滤纸过滤2次。取5 mL上清液于离心管内,加入5 mL 0.02 mol/L TBA溶液,放入沸水浴40 min后取出冷却1 h,10000 r/min离心25 min,取清液于试管内,加入5 mL氯仿摇匀,静置分层后取上清液分别在532 nm和600 nm波长处比色,并用以下公式计算值。
式中:A532为样品在532 nm下的吸光值;A600为样品在600 nm下的吸光值。
1.2.8 质构的测定 参考杨华[2]的方法,取3 cm×3 cm×1 cm块状鱼肉样品,定时质构仪探头型号P/100,测试速率:1 mm/s;测试速率:0.5 mm/s;测试后速率:0.5 mm/s;压缩比:50%;探头2 次测定间隔时间:5 s;触发力 5.0 g;触发类型:自动。测试前将样品置于4 ℃冰箱平衡1 h,每组品测定3次。
1.2.9 肌原纤维蛋白浓度测定 双缩脲法测定蛋白质质量浓度[15]。取1 mL肌原纤维蛋白溶液,加入4 mL双缩脲试剂,25 ℃水浴30 min,在波长540 nm处测吸光度。对照标准曲线求肌原纤维蛋白的质量浓度。
1.2.10 Ca2+-ATPase的测定 使用超微量Ca2+-ATP酶测试盒对鱼肉肌原纤维蛋白Ca2+-ATPase进行测定。
1.2.11 持水性测定 参考李强[16]的实验方法,做修改。取0.1 g(精确到0.0001 g)肌原纤维蛋白样品,加水至浆状,漩涡混匀,28 ℃放置30 min,3500 r/min离心15 min,倒出离心管多余水分,称取蛋白糊质量,每个样品测定三次。
式中:m0为离心管重,g;m1为试管样品总重,g;m2为离心前试管样品重,g;m3为离心后去水试管样品重,g。
1.2.12 巯基的测定 取肌原纤维蛋白样品,使用巯基试剂盒对肌原纤维蛋白巯基进行测定。
1.2.13 表面疏水性测定 参照Chelh[17]的方法,取肌原纤维蛋白溶于20 mmol/L pH6.0的磷酸缓冲液中,使样品蛋白浓度为5 mg/mL。取200 μL 1 mg/mL的溴酚蓝溶液到1 mL的MP溶液中,混匀,室温下磁力搅拌器搅拌10 min,然后7500 r/min常温离心15 min,取1 mL上清液溶于9 mL 20 mmol/L pH6.0磷酸盐缓冲液中,在595 nm下测定吸收值A1。以磷酸盐缓冲液作空白样吸光值记做A0,结果以“平均值±标准偏差”表示。表面疏水性用以下公式表示:
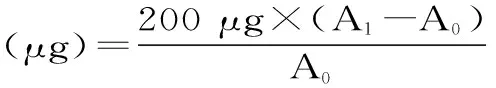
式中:A0为磷酸盐缓冲液在595 nm下的吸光值;A1为样品在595 nm下的吸光值。
1.2.14 羰基测定 参考李学鹏[18]的方法,取1 mL蛋白溶液(浓度为5 mg/mL)放入塑料离心管并加入1 mL DNPH溶液(10 mmol/L含2 mol/L HCI),室温条件下避光静置1 h(每15 min,振荡一次),添加3 mL 20%的TCA后10000 r/min离心5 min,弃上清液,用乙酸乙酯-乙醇(体积比1∶1)清洗沉淀3次后,加入6 mol/L盐酸胍溶液5 mL,37 ℃保温15 min使沉淀溶解,10000 r/min离心3 min去除不溶物,所得溶液于370 nm波长下测定吸光度。使用分子吸光系数22000 L/(mol·cm)计算每mg蛋白中羰基含量。
A=εbc
式中:A为吸光度;ε为摩尔吸光系数,L/(mol·cm);b为吸收池光程长,cm;c为吸光物质的浓度,mol/L。
1.2.15 差示扫描微量热(DSC)测定 采用差示扫描微量热仪(DSC)进行测定[19],在铝坩埚中放入一定量(0.2~0.5 mg)的不同处理样品的肌原纤维蛋白,测定其DSC曲线。温度扫描范围:15~150 ℃;扫描速率:5 ℃/min。
1.3 数据处理
使用SPSS Statistics 17软件进行差异性显著分析,使用Office Excel 2003软件进行数据处理及绘图。
2 结果与分析
2.1 腌制处理对养殖大黄鱼鱼肉生化保鲜品质的影响
pH、TVB-N、K值、菌落总数和TBA均为水产品鲜度评价的重要指标。水产品在死亡之后,体内的糖原开始发生糖酵解,反应产生乳酸、丙酮酸、磷酸等酸性物质导致pH下降[20],如表1所示,养殖大黄鱼经腌制处理,pH相对于对照组有所下降,但降低不显著(p>0.05),说明腌制处理会促进养殖大黄鱼体内糖原的分解,腌制鱼肉的风味变化可能与其体内的糖原分解及乳酸含量有关。

表1 腌制处理对鱼肉生化保鲜品质的影响Table 1 The effect of pickling treatment on the biochemical preservation quality of fish meat
水产品在腐败过程中,由于细菌的生长繁殖和酶的氧化分解作用,使蛋白质分解而产生氨及胺类及氨等碱性含氮物质,具有挥发性。刚刚屠宰的鱼肉中TVB-N含量一般维持在20 mg/100 g以下,当鱼肉中的TVB-N 含量达到或者超过30~35 mg/100 g时,样品已到达冷藏鱼类的感官接受极限[21]。如表1所示,腌制组TVB-N含量显著高于对照组(p<0.05),原因可能是鱼肉经腌制处理,盐度增加促进了鱼肉中蛋白质的分解,导致TVB-N含量增加,但与对照组仍在新鲜范围之内。
水产品在死后初期ATP即开始分解成AMP、ADP、HxR、IMP、Hx等。行业标准规定新鲜宰杀的鱼类K值在10%以下,K值在 20%以下为一级鲜度,20%~40%为二级鲜度,60%以下为可供一般食用与加工,60%~80%为初期腐败[22]。如表1所示,相比于对照组,经腌制处理的鱼肉K值增加不显著(p>0.05)。腌制处理在一定程度上促进了鱼肉中ATP的分解,导致K值增加,但腌制后的养殖大黄鱼仍属于属于一级鲜度。
菌落总数测定是用来判定食品被细菌污染的程度及卫生质量,它反映食品在生产过程中是否符合卫生要求,以便对被检样品做出适当的卫生学评价。菌落总数的多少在一定程度上标志着食品卫生质量的优劣[23-24]。如表1所示,对照组菌落总数为(4.48±0.38) lg cfu/g,腌制组菌落总数为(3.97±0.21) lg cfu/g,经腌制处理,鱼肉中盐度增加,渗透压发生改变,对鱼肉中部分微生物具有抑制、杀灭作用。腌制组的菌落总数低于对照组的菌落总数。
TBA值是判断脂肪氧化的重要指标。脂肪氧化和水解产生的酮类和醛类物质是引起鱼肉品质劣变的重要原因之一[25]。养殖大黄鱼是一种高蛋白高脂肪的鱼类,且其脂肪酸大多为不饱和脂肪酸,极易与空气中的氧气发生氧化反应产生氧化降解产物丙二醛。如表1所示,对照组TBA值为(0.25±0.04) mg/100 g,腌制组TBA值为(0.57±0.02) mg/100 g,腌制组TBA值显著(p<0.05)高于对照组,说明腌制处理促进了大黄鱼肉脂肪的氧化,游离脂肪酸的渗出。
通过上述分析可得,腌制处理在一定程度上促进养殖大黄鱼肉糖原降解、脂肪氧化,保鲜品质有所下降,但都属于新鲜的范围,且腌制处理可以杀灭微生物、抑制微生物的生长,使腌制品能够长期保藏。
2.2 腌制对养殖大黄鱼质构的影响与分析
如表2所示,鱼肉经腌制处理,大黄鱼肉硬度、粘聚性、弹性均低于对照组,硬度和弹性均显著降低(p<0.05),粘聚性降低不显著(p>0.05)。原因可能是在腌制过程中,盐处理对鱼肉的组织结构有所影响,改变了鱼肉中的水分含量及水分活度,而盐对鱼肉中肌原纤维蛋白的变性可能有影响,氯化钠可能改变了蛋白的水合作用[6],导致其质构发生了改变,从而对鱼肉的品质产生影响,故而影响了腌制食品的口感等。

表2 不同处理方式对鱼肉质构的影响Table 2 Effect of different treatments on the texture of fish
2.3 腌制对养殖大黄鱼肌原纤维蛋白特性的影响
养殖大黄鱼经相同方式提取肌原纤维蛋白,腌制组的肌原纤维蛋白含量显著高于(p<0.05)对照组,肌原纤维蛋白为盐溶性蛋白[26],鱼肉经腌制处理可能有利于提高其肌原纤维蛋白的提取率;或腌制处理影响了其它蛋白的提取,致使腌制组肌原纤维蛋白含量增加。盐度使得肌肉纤维解开,提高纤维蛋白的得率。
蛋白质溶液中,蛋白分子之间的相互作用和蛋白分子与水分子之间的相互作用直接影响蛋白质分子的空间结构,影响蛋白分子功能性质的稳定性。蛋白质表面疏水性可以说明蛋白质分子内部疏水基团的暴露程度[27]。表面疏水基团暴露的越多,肌原纤维蛋白的表面疏水性越大,肌原纤维蛋白分子有机会发生聚合,最终导致蛋白质分子不可逆的变性。如表3所示,腌制组表面疏水性显著低于(p<0.05)对照组,可能是因为肌原纤维蛋白是盐溶性蛋白,在一定离子强度的盐溶液中,肌原纤维蛋白溶解性有所增强。

表3 不同处理方式对蛋白特性的影响Table 3 Effect of different treatments on the the protein characteristics
鱼体中存在的肌球蛋白与肌动蛋白在ATP作用下生成肌动球蛋白,而肌球蛋白的重要生物活性之一就是具有Ca2+-ATPase活性。活性反映肌球蛋白头部性质的变化,是鱼肉在冷藏过程中蛋白质性质的一个重要指标,其活性值越高,说明蛋白质性质越稳定,冷冻变性程度越小,品质也越好[28]。如表3所示,腌制组Ca2+-ATPase活性显著低于(p<0.05)对照组,引起Ca2+-ATPase活性下降的原因是多方面的,可能与腌制处理导致养殖大黄鱼肌球蛋白解旋开来以及鱼肉pH的下降、巯基氧化等导致活性导致Ca2+-ATPase活性下降。
持水性可以反映蛋白网络结构,凝胶结构越细密、均匀,持水性越好[28]。在鱼糜凝胶网络结构形成过程中,键、疏水和静电相互作用等影响着凝胶网络结构。肌原纤维蛋白也会直接和水相互作用产生毛细现象,与持水性密切相关。如表3所示,腌制组的持水性显著低于(p<0.05)对照组,因为盐浓度的增大,肌原纤维蛋白发生了变性,凝胶结构不稳定,持水性下降。
蛋白质结构的变化是巯基形成二硫键,巯基含量是蛋白结构改变的一个重要指标。巯基是鱼肉中反应活性最强的功能性基团。腌制处理可能会使蛋白质降解、解聚及重聚合,蛋白质内的游离巯基含量也会随之改变,如巯基形成二硫键。所以巯基含量在一定程度上可以反应腌制处理对养殖大黄鱼肉肌原纤维蛋白的变性程度[29]。如表3所示,腌制组巯基含量显著高于(p<0.05)对照组,推测原因可能是由于腌制过程中蛋白质分子空间结构折叠打开暴露更多的巯基基团,分子内部疏基的氧化程度很低导致总巯基含量略微的上升。
羰基的形成是蛋白质氧化后最显著的变化之一,因此羰基含量已经成为衡量蛋白质氧化程度常用指标[30]。如表3所示,腌制组羰基含量显著低于(p<0.05)对照组,腌制组氧化程度低于对照组,说明腌制处理在一定程度上可以延迟蛋白的羰基化,减慢蛋白的氧化。
高浓度的盐溶液会引起肌原纤维蛋白的变性,蛋白质发生变性其热焓也会发生变化,采用差示扫描量热仪(DSC)进行分析[27],DSC曲线中的吸收峰表示蛋白热量被吸收,也是蛋白质的热变性的过程,目标蛋白会呈现固定的吸收峰;峰值的变化、变性温度的位移和消失可反映蛋白的变性情况,由此可根据DSC图谱的变化推测蛋白构象的变化,进而得到腌制处理后肌原纤维蛋白结构的稳定性。如图1所示,为腌制处理对养殖大黄鱼肌原纤维蛋白的DSC曲线,经腌制处理后的的热焓高于未处理组样品,腌制组在36、100 ℃时出现吸收峰,而对照组在115 ℃出现吸收峰,说明腌制处理降低了肌原纤维蛋白的热稳定性,腌制处理破坏肌原纤维蛋白构象,导致变性温度降低。
3 结论与讨论
结果表明腌制处理在一定程度上降低了养殖大黄鱼鲜度和组织结构,腌制过程中大量盐溶液渗透到鱼肉中,改变其渗透压,可能对鱼肉细胞膜及细胞结构有所影响,从而加速了蛋白质、ATP等的分解,使鱼肉品质发生变化;但渗透压的改变,也对鱼肉中微生物有所抑制,在一定程度又有利于鱼肉的保藏;同时腌制处理改变了鱼肉的质构、水分、盐分等,水分上升、盐分增加,质构相关指标均有所降低,改变其口感[31];而饱和食盐水腌制处理可以促进养殖大黄鱼肌原纤维蛋白的提取率;腌制处理对蛋白结构的影响体现在改变了肌原纤维蛋白的热稳定性,使其发生了结构上的变性;而腌制处理使肌原纤维蛋白的持水性和表面疏水性均下降,说明了腌制处理破坏了肌原纤维蛋白间的空间结构,同时腌制处理对肌原纤维蛋白的巯基、羰基和Ca2+-ATPase均有影响,而巯基、羰基和Ca2+-ATPase在一定程度又可以反映蛋白质的品质情况,腌制处理促使养殖大黄鱼肌原纤维蛋白发生变性,进而影响其鱼肉的口感及风味。
现阶段,国内外在盐处理对蛋白质变性机理上日益增多[32-33],多体现在变性情况及功能影响上,腌制处理对养殖大黄鱼蛋白质的特性及结构的影响有待更深层的研究。通过这些方面的研究为养殖大黄鱼腌制工艺的商业化提供一定的理论依据。

