高分辨熔解技术在食品真实溯源检测中的应用
徐秦峰,马西亚,闵红卫,曹云刚
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
0 引言
随着食品工业的发展,食品供应链和消费链的延长,出现了越来越多以经济利益为驱动的食品掺伪现象.掺伪类型主要包括替代、添加或删除.根据统计,食品掺假可能占到全球食品工业的10%.常见的掺假食品包括橄榄油、牛奶、蜂蜜、香料、果汁、酒类以及海产品等.食品掺假不再局限于特色高值动植物源性食品及混合源性食品,也涉及到肉、奶、粮油、蔬菜水果等大宗食品.这些日益普遍的食品掺伪行为不仅侵害了消费者的权益和身体健康,也影响了食品行业的健康发展甚至社会稳定和谐.因此,食品的真伪鉴别与溯源逐渐成为食品质量安全检测与监管的一项重要而具有挑战性的工作.
目前使用比较广泛的食品真实性溯源技术,主要分为传统的溯源方法和物理方法(如条形码、电子标签等)、仪器分析方法(色质联用技术、光谱学分析方法)、化学方法(同位素溯源技术、矿物元素溯源技术)和生物学方法(虹膜技术溯源和DNA技术溯源)等[1-5].其中,由于DNA的种属特异性,以及DNA在食品加工过程中对高温、高压和化学处理的稳定性,基于DNA的分子生物学检测方法具有灵敏度高、特异性强和准确度高等优点,被认为是最有潜力的真实溯源技术.在各种DNA分析技术中,PCR以其灵敏度、重复性和简便性成为最广泛使用的分子技术.然而已有的PCR产物检测技术,如凝胶电泳、荧光标记探针和测序方法,均在不同程度上存在着耗时、费力、样品通量低以及成本昂贵等局限尚待解决.
高分辨熔解曲线(High Resolution Melting,HRM)分析是一门新发展起来的荧光PCR检测技术,主要原理是依据双链DNA的熔解行为决定于DNA序列的长度、GC含量以及碱基互补性的差异,通过在熔解过程中实时监测DNA饱和荧光染料信号的改变获得特征熔解曲线,实现对样品碱基差异的精确分析.经典的熔解曲线分析通常监测的熔解温度差异>1 ℃,目的是为了鉴别特异性扩增,而HRM分析则利用DNA饱和荧光染料、高精度的检测仪器以及相关分析软件,能够监测到的熔解温度差异<0.5 ℃,并且其对于PCR扩增产物的区分检测已精确至单个碱基差异水平.相对其他PCR检测技术,HRM具有以下优点:(1)更快速,不需要PCR后凝胶处理或DNA测序;(2)更经济,因为它不需要昂贵的染料标记的引物或凝胶试剂;(3)样品通量更高,能够在多重测定中检测来自具有一种或多种其他选定物种的DNA的存在,不受突变种类和位点的限制.凭借这些优势,HRM近年来广泛用于疾病和癌症基因突变扫描、病原体检测和基因分型[6-9]、甲基化分析[10]、动植物物种鉴定[11]以及食品真伪鉴别和溯源检测[12,13]等领域中.本文阐述了影响HRM技术分析食品的关键因素,并总结了HRM技术在食品动物源性成分和植物源性成分中检测应用进展,可为今后建立快速鉴别食品真伪以及溯源方法提供理论指导和方法参考.
1 影响HRM技术分析食品真伪的关键因素
HRM分析实验比较简单,只需要在PCR扩增反应中添加饱和荧光染料,即可在具有HRM分析功能的实时PCR仪器上一步完成扩增和分析.因此,影响HRM的主要因素不仅包含PCR反应扩增条件,还包含实验中所选用的仪器以及荧光染料等.对于食品样品HRM分析而言,最重要的影响因素DNA模板提取质量和扩增目的基因片段的选择.
1.1 影响HRM分析的PCR试剂与扩增条件、荧光染料及仪器软件
与普通PCR反应一样,选择可靠的PCR反应试剂以及合适的扩增反应条件,以确保获得高纯度的PCR特异性产物对于HRM分析的成功也至关重要.PCR反应试剂如DNA聚合酶、PCR缓冲液,扩增条件包括退火温度、循环次数等条件均直接影响PCR产物的质量,其中引物二聚体和非特异性扩增产物的生成将降低样品的扩增效率,影响PCR产物的熔解和HRM分析的准确性.此外,缓冲溶液的离子强度及添加剂也影响着PCR结束后的熔解步骤和HRM分析的分辨率.因此,PCR试剂与扩增条件都需要仔细优化,必要时需在进行HRM分析之前,使用经典的熔解曲线分析或者凝胶电泳对PCR产物的特异性进行检验,以确认HRM熔解曲线中的差异源于模板DNA中的序列变异.
饱和荧光染料是经典熔解曲线分析和HRM分析之间最大的区别.SYBR Green I染料用于经典熔解曲线分析,但由于其对PCR的抑制作用较强,属于非饱和染料,加之染料本身在DNA双链熔解的过程中容易发生重排,导致熔解结果失真并影响检测的分辨率,因此在HRM的分析应用中受限.新一代饱和染料(例如ResoLight、LC Green,LC Green Plus,SYTO 9和Eva Green)专门为高分辨率熔解而开发的.这些染料有着更强的DNA结合能力和很低的抑制作用,在DNA融化过程中不会重新排列[14-16],保证了检测结果准确性.
HRM仪器对温度的均一性要求非常高,孔与孔之间微小的差异都会影响HRM结果的准确性.此外,HRM分析也要求仪器具有较高的光学精度,在温度每提升一度的过程中获得足够高的数据值密度,从而能够可靠地检出样本之间细微的序列差异.目前可用于HRM检测的仪器主要有:Idaho公司的HR-1与LightScanner,Roche公司的LC480,Qiagen公司的Rotor-gene 6000,Thermofisher公司的Applied Biosystems 7500以及Bio-Rad公司的CFX96等[17-19].
HRM分析软件主要提供理解基本曲线分析所需的所有信息,进行可靠的HRM分析及数据诠释.此外,当熔解曲线复杂时还可以进行一些额外的分析处理.这些处理主要有归一化和差异化分析两种,归一化分析可以补偿在扩增起始时染料浓度的差异以及扩增后PCR产物量的差异;而差异化分析为了提高数据的可视化,它是用待测样品的荧光值减去基线的荧光值得到的.目前已有Qiagen、Thermofisher以及Bio-rad等多个qPCR仪器生产厂家提供HRM专用分析软件.
1.2 食品样品中DNA模板的质量
从食品样品中提取的DNA模板可能存在PCR抑制剂和污染物,食品的加工处理也会导致DNA模板降解和碎片化,不仅影响PCR的扩增反应,还会影响到后续的HRM分析,从而导致判断结果错误.食品样品基质复杂,其蛋白质、脂肪、凋亡的细胞、加工过程中的单宁酸、亚硝酸盐、钙离子以及提取时醇类和盐类残留等均能抑制PCR反应,显著降低PCR的灵敏度和扩增效率,且这些抑制剂也因食品种类、加工方式以及提取方式不同而有所差异.研究证明,奶制品随着加热时间的延长,提取的DNA的纯度逐渐下降[20];并且食用油随着储存时间的延长,DNA提取产物中的抑制剂也越多[21].Faria M A等[22]比较了三种提取方法对果汁DNA纯度的影响,结果证明不同的提取方法260/280以及260/230不同,其中采用树脂法提取的DNA更适用于HRM分析.此外,Ganopoulos I等[23]对具有PDO(Protected Designation of Origin)认证的樱桃制品鉴定中表明,经过不同加工的樱桃中DNA含量有所差异,且不同提取方法提取同一种样品的纯度存在差异.因此,为了保证HRM结果的可靠性,待分析样品的提取方法需要保持一致.为找出较为合适的提取方法,实验室可根据待提取的食品样品的种类和样品中可能存在的抑制剂以及自身条件设计不同基因组提取方法,找到较为理想的提取方法或基因组提取试剂盒.提取到的DNA应使用分光光度计检查纯度,当260/280 nm和260/230 nm的吸收率分别在1.5~2.0和1.7以上时,提取的DNA可用PCR分析.通常可以通过设置非内源性DNA对照组或者通过对样品扩增效率的计算来验证样品中是否存在抑制剂;对于存在抑制剂的样品,可以根据PCR的灵敏度,适当的稀释样品DNA的浓度,达到稀释样品中抑制剂浓度的目的.如果稀释样品达不到期望的效果,需要选用不易受抑制剂影响的DNA聚合酶或者添加某些促进剂如牛血清白蛋白、二甲基亚砜、吐温20和甜菜碱等,消除PCR抑制剂的不利影响.
除了抑制剂外,食品在生产加工过程中,会经过不同的物理、化学加工,这些加工方式会导致食品中的DNA发生不同程度的破坏和降解,因此,较短的扩增片段将有着更高的扩增效率.研究发现肉制品在加工过程中,随着加热温度和加热时间的延长,其DNA逐渐降解成较小的片段[24];并且食用油随着储存时间的延长,DNA模板降解的越严重[21].Pereira L等[25]比较了705 bp(base pair)、375 bp和119 bp基因片段的扩增效果,结果证明由于发酵过程中基因片段的降解,导致705 bp的扩增产物在鉴别时受到了样品类型的限制,而采用小片段时可以实现样品的HRM快速、灵敏鉴别.同时,Tomas C等[26]通过扩增线粒体细胞色素氧化酶的全序列(600 bp)和部分序列(100 bp),证明短序列能够克服在加工过程中目的片段降解的情况下更有效的进行物种区分.
1.3 HRM分析的引物设计及目的基因选取
引物设计的目的主要在于扩增出特定目的DNA片段,便于后续的HRM分析,实现食品中物种来源的特异性准确鉴定.除了遵循普通PCR引物设计的一般原则外,HRM食品分析实验中需要综合考虑PCR扩增、HRM分析以及实际食品样品的影响.与普通PCR扩增片段的长度通常并无明确要求不同,HRM分析的DNA片段长度主要限定在70~300 bp之间.当扩增片段超过300 bp时,一方面可能会由于食品样品模板的降解,导致PCR扩增效率降低或者扩增失败;另一方面,由微小的DNA序列变化引起的熔解曲线的差异就越小,还可能含有几个熔解域,形成复杂的熔融曲线,降低HRM的分辨率[27].而当扩增片段小于70 bp时,产生的荧光信号强度将更低,影响HRM分析的灵敏度;此时引物二聚体的Tm(Melting Temperature)值和特异性扩增子的Tm值也将十分接近,从而影响HRM分析的准确性.
目前,用于动物物种鉴别的基因通常是线粒体DNA,其属于核外遗传物质,相对于核DNA进化速度快,在生产加工过程中更容易得到保留,在细胞中的拷贝数多于核基因组DNA,易于进行PCR扩增,且其具有广泛的种间和种内多样性,能对亲缘关系更近的物种进行鉴别,另外线粒体DNA中某些基因区域具有高度保守性,可通过设计通用引物,扩大所鉴别的物种范围[28-30].涉及线粒体区域的物种鉴定通常包括细胞色素b(cytb),12S rRNA,细胞色素C氧化酶I(COI),D-loop和16S rRNA基因[31-35].其中,cytb是基因细胞色素氧化酶亚基,大量哺乳动物的cytb基因数据库被存放在公共数据库中,而COI基因序列相对较少,因此根据基因序列的可获得性难易程度上,一般选择cytb基因.而12S rRNA和16S rRNA是线粒体DNA上的编码基因,其基因区域比cytb基因区域更加保守,但是保守区中的可变区域进化快,不同种属间差异大[36],且16S rRNA比cytb基因含有更多的物种特异性突变位点[37],因此基于亲缘性极其相近的物种,可以选择16S rRNA作为靶基因.
对于植物样品,由于线粒体基因序列比率低,进化速率较慢,遗传分化程度小,不适用于植物样品中线粒体DNA的变化[38].而叶绿体基因在多数植物中以多拷贝形式存在,在DNA含量甚微的食品种类,比单拷贝或少拷贝的物种特异性基因具有更高灵敏度的优势,因此叶绿体序列已被用作植物物种鉴定目的序列.目前,已经提出质体基因组的不同区域用作植物物种鉴定的靶序列,包括rbcL,matK,rpoB和C基因以及非编码间隔子pF-atpH,trnH-psbA和psbK-psbItrnL-F,trnL内含子和核内核糖体DNA的内转录间隔区ITS2,其中不同的基团具有其优选的植物DNA条形码,但对于使用标准区域尚未达成共识[39,40].
2 HRM技术在食品动物源性成分检测中的应用
2.1 肉制品类
由于HRM技术具有上述优点,已作为快速鉴别动物源性成分的一种有效工具,用于对包括肉类及其制品、乳类及其制品等动物源性成分的快速检测和追溯.Sakaridis I等[41]采用通用引物,物种特异性引物和HRM方法快速、准确分析了混合肉中水牛肉掺入量.首先,使用通用引物18S rRNA扩增区分绵羊、山羊和猪的不同物种来源,再采用12S rRNA特异性引物确定水牛和牛成分,并且定量肉制品中水牛肉的掺入量,检测限达到0.1%.Klomtong P等[42]则是根据动物线粒体16S rRNA设计通用引物,通过PCR扩增线粒体长度为512 bp的靶基因基因,有效的鉴别了山羊、绵羊、牛、水牛、猪等七个物种.类似的,Lopez-Oceja A等[43]以线粒体cytb基因中的148bp片段为靶基因通过HRM 检测牛、猪、羊、兔子和马五种哺乳动物,以及鸡、火鸡和鹌鹑三种鸟类,并将这些物种混合检测其成分,结果证明该方法可以有效鉴别物种来源.Naue J等[44]在对欧洲常见的11种动物亚种进行研究,证明了HRM不仅在种属上进行了区分,还能够在具体的物种水平上进行鉴定.在此基础上,周光宏课题组等根据单核苷酸多态性对来自不同产地的猪肉、羊肉制品以及牛肉制品溯源,说明了选择充分的SNP位点采用HRM技术可以快速高效的进行肉制品产地溯源,同时,结果也证明了相对于探针法和限制片段长度多态性法,HRM分析是最准确、简便和经济的方法[45-47].
HRM技术在海产品的掺假鉴定也有一定的应用.Jilberto F等[48]通过设计贻贝特异性引物,使用HRM技术区分了三种常见的贻贝以及其混合物.Fernandes T J R等[49]根据HRM技术建立了不同种属鳕鱼的鉴别方法以及采用HRM技术对欧洲及地中海无须鳕中其他产地的无须鳕进行鉴定[50],同时,Tomas C等[26]也将HRM技术运用于鳕鱼种类鉴定.他们首先运用600 bp序列分析,结果证明区分效率不好,在此基础上设计了七对特异性引物,筛选出最合适的引物,并将其应用于33个实际样品检测中,表1列举了一些HRM技术在肉制品类的检测方法信息.
2.2 乳制品类
乳制品掺假形式有多种形式,如掺入非乳产品水、豆浆增加奶液体积,减少成本,或者掺入一些低品质的奶,以次充好.为了明确乳制品中的乳品质量,对乳组分的检测是必不可少的.HRM技术在乳品或乳制品的掺假中也有较好的应用.Ganopoulos I等[51]首次将HRM方法应用于乳及乳制品的掺假鉴别,他们根据羊线粒体的D-loop基因序列以及牛的tRNA设计物种特异性引物,采用HRM技术分析出菲达奶酪(羊乳奶酪)中的牛乳成分,准确地确定0.1%以内牛奶的存在,以及量化不同商业羊乳酪产品中绵羊奶与山羊奶混合物的比例.同时,他们也采用此方法快速检测和定量了莫扎特(水牛乳奶酪)中以及其他水牛乳制品中的牛乳成分,奶酪中掺入牛乳含量的最低水平为1%[52],表1列出了相关研究的统计信息.

表1 HRM分析动物源性成分检测技术信息及相关文献列表
3 HRM技术在食品植物源性成分检测中的应用
3.1 谷物及其制品
鉴别植物物种和品种对农业、工业和消费者都至关重要.谷物掺假主要是用非原产地产品代替原产地产品或者用其他难以从外形区分的低值产品代替优质产品.Ioannis Ganopoulos和他的团队为HRM技术在植物源性成分的鉴定中做出了很大的努力,他们将DNA条形码与SSR (Simple Sequence Repeats)技术相结合,由于每个豆类品种的熔解曲线都不相同,可以经济、有效的鉴别豆类物种,实现了豆类品种形象、直观以及可视化区分[53-56],另外他们以RM241微卫星标记作为靶基因,检测出印度香米的1%的非香米成分[57],对于橄榄油的掺假认证,他们则是根据线粒体rbcL区域基因条码设计引物,用HRM方法检测橄榄油中的其他植物油成分,可检测到1%橄榄油和菜籽油混合物[58].此外,Vietina M等[59]采用特异性引物,比较橄榄油和榛子、玉米等八种植物油的熔解曲线,建立了经济有效的橄榄油鉴别方法.Montemurro C等[60]则使用了对微卫星标记引物采用HRM技术鉴别具有PDO认证的橄榄油的掺假鉴别,区分了9种不同品种的橄榄油,结果证明DCA18卫星标记结合HRM可以鉴别出原产地保护橄榄油中的非原产地保护橄榄油,表2列出了相关研究的统计信息.
3.2 水果及饮料类
水果掺假的主要形式是在优质果汁中加入其他品种或者用非原产地品种代替原产地品种.目前,已有很多研究将HRM技术应用于水果及其制品真伪鉴别和质量控制中.Distefano G等[61]采用HRM鉴别了15种柑橘,并将此方法与毛细管电泳对比,结果证明在同样的条件下,HRM检测到66个等位基因,而CE只检测到44个,说明HRM不仅是用于SSR标记的基于电泳的方法的高效且成本有效的替代方法,而且还用于揭示SSR中存在的更多SNP.Ganopoulos I等[23]同样比较了该方法与毛细管电泳方法,通过检测10种微卫星,建立了PDO认证樱桃成分的HRM方法.Jaakola L等[27]对8种野生浆果物种进行鉴别,发现扩增子(188~359 bp)的HRM分析适用鉴定浆果物种,从而实现了野生浆果的快速、高通量鉴别.Mackay J F等[62]建立了快速鉴别葡萄种类的方法,一个未知的葡萄品种可以在3 h内完成验证,因此HRM方法比微卫星标记分析的方法更加快速.
此外,HRM技术还实现了水果饮料的掺假鉴定鉴别.例如,Faria M A等[22]以植物通用性基因-线粒体trnL基因中的500 bp片段为靶基因,采用HRM方法鉴别果汁中芒果、橘子、梨、菠萝和桃子成分,在芒果、橘子等五种水果中基因序列平均差异为27.7%,其中桃和梨差异最小为5.9%,菠萝和橘子差异最大46%;并且根据熔解曲线成功鉴别出了芒果与橘子的混合比例.Pereira L等[25]采用HRM技术,通过熔解曲线分析鉴别叶子、未发酵的葡萄汁和红酒三个样品,实现了对葡萄酒样品的真实性鉴定,具体详见表2所示.
3.3 其它特色高值食品
除了谷物和水果类食品,HRM技术还应用于香辛料[63]、辣椒[64]、沙棘[65]、藏红花[66,67]等特色高值食品的掺假鉴定.此外,利用HRM技术可以实现对人参[68]、金银花[69]、苦杏仁[70]、三七[71]等药食同源食品的真实性及质量安全的快速检测,展示了良好的应用前景,表2列出了其它应用HRM技术检测方法的统计.
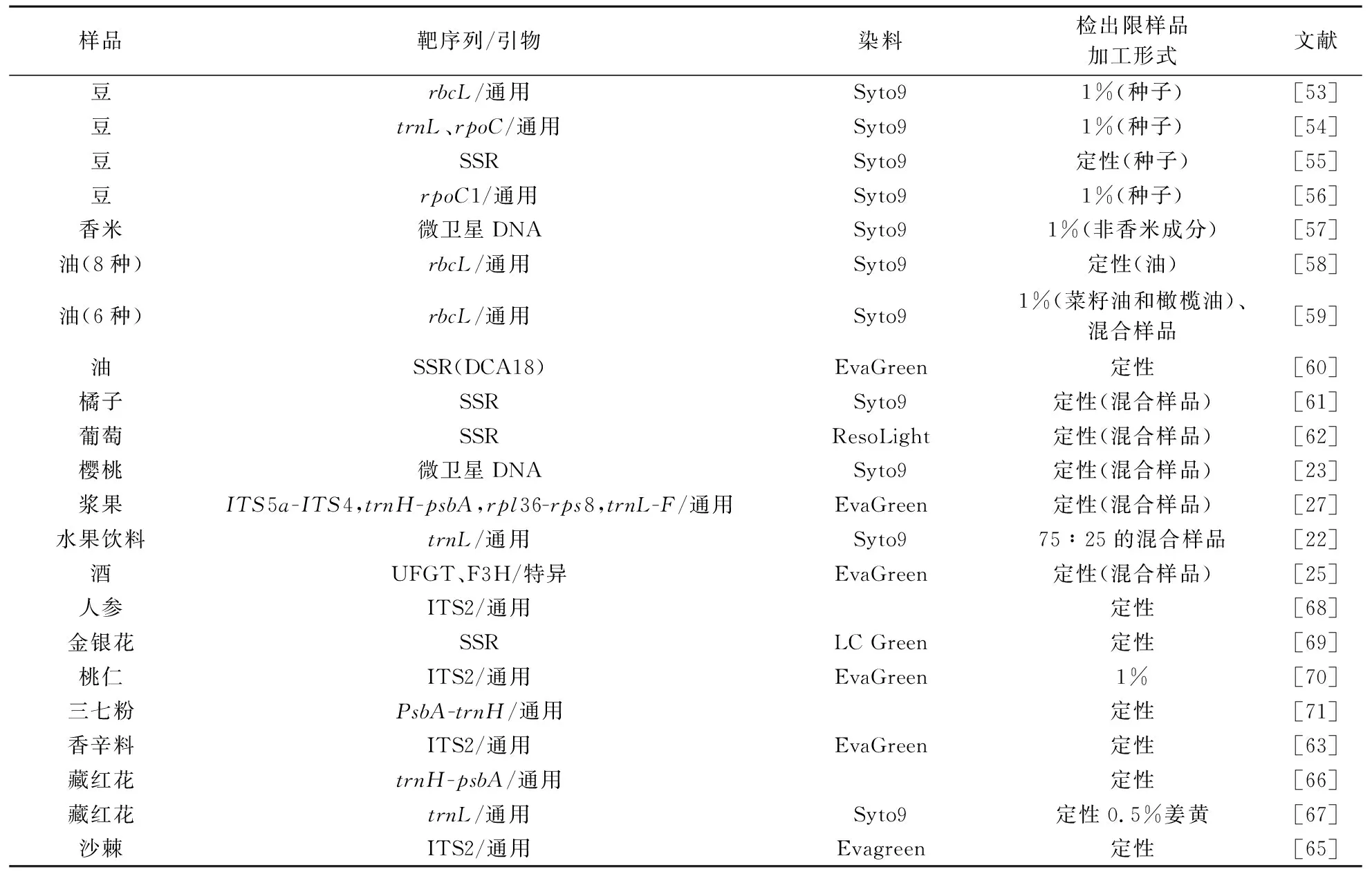
表2 HRM分析的植物源性成分检测技术信息及相关文献列表
4 总结
相比于其它PCR检测技术,HRM用于食品真实性掺假检测具有许多关键优势,如简单,准确,闭管,低成本,高灵敏度和高特异性、高通量等.此外,HRM分析对PCR扩增产物无损伤,因此还可以采用电泳、测序等方法进一步确证实验结果.通过DNA模板提取、DNA目的基因选取、PCR扩增、HRM分析等实验条件的优化与精巧设计,多种常见的掺假加工食品,如肉制品、牛奶、橄榄油、果汁、海产品等均可通过HRM分析实现快速鉴别与溯源检测(如表1和表2所示).这些研究表明,HRM分析方法是区分食品中掺伪的有效检测工具,只需很简单地将待测样品熔解曲线与参考样品的熔解曲线进行比对就可以验证食品样品的真实性.
但是,HRM用于食品鉴定分析也存在一些亟需解决的问题:首先,HRM分析主要是依据熔解曲线的差异,因此对于样品扩增产物存在多个熔解域或者不同样品的熔解曲线非常类似,将会导致HRM分析变得非常困难,此时可能需要进行多次引物设计和实验优化;其次,尽管已有报道成功利用HRM对食品的掺假比例进行了半定量分析,但仍需开展更多更为详细的实验用以验证定量结果的精确性;再次,食品的种类繁多、基质复杂,这些因素都会影响HRM分析的准确度和重现性,但由于各种掺假鉴别检测方法的适用性各不相同,此时可以将HRM和其它多种检测方法相互配合使用,以确保得到可靠的实验结论;最后,HRM食品分析目前还存在着依赖饱和荧光染料和仪器等方面的局限,需要开发出更高荧光性能、更低成本的染料和仪器,以增加HRM食品分析技术的实用性和推广价值.
相信随着HRM技术的发展、HRM染料和仪器的开发、HRM实验方法的改进以及多种其它实验技术的联合应用,可以更好地发挥HRM及各类分析检测技术的特长,并提高食品物种来源鉴定方法的准确性与实用价值,从而为治理多变的掺假行为提供必要的科技手段支撑.

