溶藻弧菌TolB蛋白的生物信息学分析
伍娜娜,康 超,荣 娜,刘 祥*,陈春琳,陈 琛,丁 锐,吴三桥
(1.陕西理工大学 生物科学与工程学院/中德天然产物研究所,陕西 汉中 723001; 2.陕西省天麻山茱萸工程技术研究中心,陕西 汉中723001)
溶藻弧菌(Vibrioalginolyticus)是隶属于弧菌科弧菌属的嗜盐嗜温性革兰氏阴性杆菌,广泛分布于海洋、河口、海水养殖池等水体环境中[1],可引起水产贝、虾、蟹、鱼类等败血症和胃肠炎[2-6],给水产养殖业带来巨大经济损失[7]。同时该菌是一种人畜共患致病菌,可污染人类的食物,引起腹泻、创伤感染、中耳炎等多种疾病[8-10],严重危害人类健康。抗生素是防治溶藻弧菌感染的主要化学药物[11],但长期使用抗生素,难免出现药物残留、细菌耐药性提高等问题。因此,迫切需要研发一种新型疫苗来防治溶藻弧菌疾病。
溶藻弧菌转运蛋白TolB是一种周质蛋白[12],与外膜脂蛋白Pal相互作用以介导内外层之间的接触,可促进运输并保持膜完整性,其运动依赖于生物聚合物转运[13]。庞欢瑛等[8]用溶藻弧菌TolB蛋白免疫石斑鱼发现,溶藻弧菌TolB蛋白可激活石斑鱼体内的特异免疫反应,且对石斑鱼的免疫保护率达76%,表明溶藻弧菌TolB蛋白有较好的免疫保护功能,能有效抵抗溶藻弧菌对机体的感染,是一种很好的候选疫苗蛋白。
为进一步提高溶藻弧菌TolB蛋白的免疫功能,借助生物信息学软件,为溶藻弧菌转运蛋白TolB构建系统进化树,预测和分析其基本理化性质、信号肽和跨膜结构、二级结构与卷曲螺旋、三级结构以及优势的B、T细胞抗原表位,设计重组表位多肽疫苗,为溶藻弧菌TolB蛋白疫苗的研制,尤其是多表位串联疫苗的研究奠定基础。
1 材料和方法
1.1 材料
依据NCBI数据库中的溶藻弧菌转运蛋白TolB序列(登录号:WP_005387925.1),共含450个氨基酸,序列如下:MIRRLLLGMFVLFSSMTNVANAALELVITDGIDSARPIAVVPFKWEGTQALPTDVSAVIASDL-QRSGKFSPVPTSKMPQTPFSESEVNFDAWTNLGVDA-LLTGSIKQNDQGDYVINYQLVDIVRGQLTGGKSKAL-GSDGELVLSKDHVLFNKVATVQGPRMREYAHRISD-LVYEQLTGDRGAFMTRIAYVVVNDKDRFPYQLRVA-DYDGYNERLVLRSKQPLMSPAWSPDGKKLAYVSFQ-NGQAEIFIMNIYTGEREKITSYPRHNGAPRFSPDGNK-LAIVLSKTGSLHVYTFDLNTRKLTQITRGRSNNTEPF-WHPDGKSLIFTSDRGGKPQIYQVNLGSGSIDRLTWQ-GSQNLGGQITPDGRFLVMVNRSNAGFNLAKQDLET-GALQVLTKTLLDESPSIAPNGGMVVYSSIYNKKNVL-SMVSIDGRFKARLPATNGRVRAPAWSPFL。
1.2 方法
1.2.1 进化关系分析 利用DNAMAN 8.0软件,将NCBI数据库公布的不同菌株TolB蛋白的氨基酸序列进行同源性分析,采用MEGA 5.0软件构建系统进化树。
1.2.2 理化性质分析 采用ExPASy-ProtParam(http://web.expasy.org/protparam/)网络在线软件对溶藻弧菌TolB蛋白相对分子质量、亲水性、等电点、脂肪指数、稳定性进行预测分析;采用ProtScale analysis方法预测亲水性图谱。
1.2.3 信号肽、跨膜结构与高级结构分析 采用Signal P 4.1(http://www.cbs.dtu.dk/services/SignalP/)软件对溶藻弧菌TolB蛋白进行信号肽预测;利用TMHMM Serverv.2.0(http://www.cbs.dtu.dk/services/TMHMM/)隐马尔科夫模型对其跨膜结构进行分析。利用SOPMA、SWISS-MODEL在线预测软件,分别对溶藻弧菌TolB蛋白进行二级、三级结构预测。
1.2.4 蛋白质相互作用网络分析 通过String蛋白质相互作用预测网站(http://www.string-db.org/),预测溶藻弧菌TolB蛋白与其他蛋白质的相互作用关系网络。
1.2.5 细胞抗原表位分析 综合BepiPred 2.0(http://www.cbs.dtu.dk/services/BepiPred/)方法和ABCpred(http://www.imtech.res.in/raghava/abcpred/ABC_submission.html)方法预测溶藻弧菌TolB蛋白的B细胞表位,获得其优势肽段。细胞毒性T淋巴细胞(CTL)抗原表位采用在线软件nHLAPred(http://www.imtech.res.in/raghava/nhlapred/comp.html),运用神经网络与量化矩阵法进行预测; 通过ProPred在线软件预测辅助T细胞(Th)抗原表位。
1.2.6 串联表位重组预测 为了筛选抗原性较好的组合作为多表位疫苗的最佳氨基酸序列,首先将获得的优势抗原表位按照B细胞、CTL及Th抗原表位顺序依次编号,其次在相邻表位间添加4个甘氨酸(GGGG)进行柔性分割,再利用DNASTAR 7.1软件对获得的B、T表位肽段进行不同排列组合优化,再将其翻译为核酸序列,从而获得最终的重组表位多肽及核苷酸序列。
2 结果与分析
2.1 溶藻弧菌TolB蛋白氨基酸序列的同源性与系统发生分析
采取生物信息学软件DNAMAN 8.0对不同菌株的TolB蛋白氨基酸序列同源性进行分析,结果显示,TolB蛋白在不同种类的细菌中序列一致性较强, TolB蛋白的功能在这些细菌中具有相似性(图1)。利用MEGA 5.0软件构建系统进化树,同一菌属在进化分支上位置较近,其中溶藻弧菌、副溶血性弧菌、霍乱弧菌和费氏弧菌进化距离更近(图2)。这4种菌的TolB蛋白序列具有较高同源性,推测TolB蛋白免疫动物产生的特异性抗体,可能对这4种菌的感染存在交叉免疫保护作用。
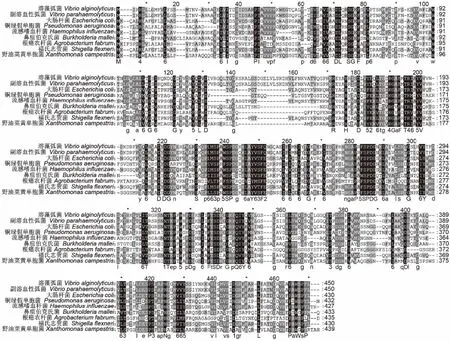
图1 TolB蛋白氨基酸序列同源性分析

图2 TolB蛋白氨基酸序列系统进化关系分析
2.2 溶藻弧菌TolB蛋白理化性质分析
通过ExPASy-ProtParam在线预测软件对溶藻弧菌TolB蛋白进行理化性质预测,结果显示,其相对分子质量为49737.67,等电点为9.49,脂肪指数(Aliphatic index)为86.20;不稳定指数(II)为33.71,表明溶藻弧菌ToIB蛋白属于稳定蛋白;平均亲水性(GRAVY)为-0.273,表明溶藻弧菌TolB蛋白为亲水性蛋白(图3)。
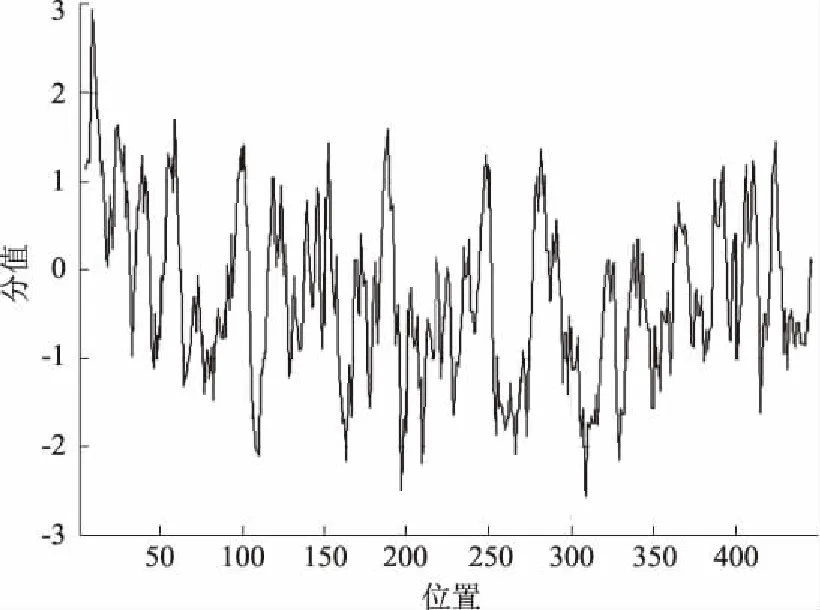
图3 溶藻弧菌TolB蛋白疏水性分析
2.3 溶藻弧菌TolB蛋白信号肽与跨膜结构分析
采用Signal P 4.1软件对溶藻弧菌TolB蛋白进行信号肽预测,结果显示,溶藻弧菌TolB蛋白的信号肽序列由N端的22个氨基酸残基组成(1—22位),切割位点在第22—23个氨基酸残基(图4)。应用TMHMM Serverv 2.0软件对溶藻弧菌TolB蛋白跨膜结构进行预测,结果显示,TolB蛋白没有跨膜区,所有区域均在细胞膜外,是一种外膜蛋白(图5)。
2.4 溶藻弧菌TolB蛋白高级结构预测
使用SOPMA在线预测软件对溶藻弧菌TolB蛋白进行二级结构预测,可信度为82.00%,α-螺旋、β-转角和无规则卷曲占比分别为18.67%、11.33%和40.00%(图6)。可见,溶藻弧菌TolB蛋白无规则卷曲含量较高,该部位可能存在抗原表位。通过SWISS-MODEL在线预测软件模拟溶藻弧菌TolB蛋白三维空间结构(图7A),发现溶藻弧菌TolB蛋白主要由无规则卷曲和α-螺旋构成,其次是β-转角,与二级结构预测结果具有一致性。溶藻弧菌TolB蛋白三维空间结构模型覆盖率为100%,可靠性较高(图7B)。
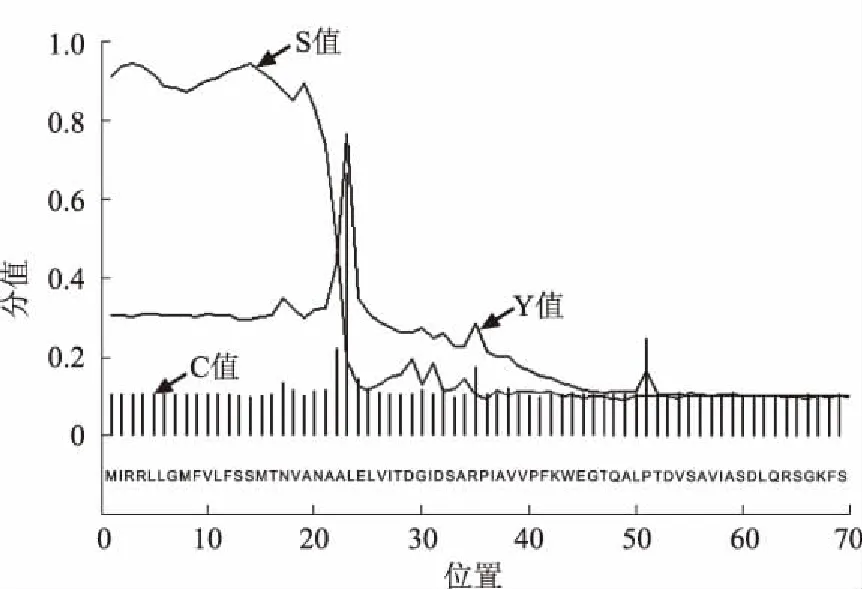
图4 溶藻弧菌TolB蛋白信号肽预测

图5 溶藻弧菌TolB蛋白跨膜区预测

c:无规则卷曲; e:β-片层; h:α-螺旋; t:β-转角图6 溶藻弧菌TolB蛋白二级结构预测
2.5 溶藻弧菌TolB蛋白作用网络分析
对溶藻弧菌TolB蛋白进行预测,结果显示,溶藻弧菌TolB与10种蛋白质存在相互作用,其中pal蛋白、lky蛋白、tolQ蛋白、ybgF蛋白与TolB蛋白作用更为紧密(图8)。
2.6 溶藻弧菌TolB蛋白B细胞抗原表位预测
综合ABCpred方法和BepiPred 2.0方法预测溶藻弧菌TolB蛋白B细胞抗原表位,获得细胞优势抗原表位为64—79、171—181、254—264、428—435位(表1—2)。

图7 溶藻弧菌TolB蛋白三级结构预测

图8 溶藻弧菌TolB蛋白相互作用蛋白质预测
2.7 溶藻弧菌TolB蛋白T细胞抗原表位分析
2.7.1 溶藻弧菌TolB蛋白CTL抗原表位预测 CTL表位预测采用nHLAPred软件,运用神经网络与量化矩阵法,选用HLA-A2、HLA-A*0201、HLA-A*0202、HLA-A*0203,HLA-A*0205五种分子结合肽(表3),获得TolB的CTL抗原表位为148—156位的VLFNKVATV。

表1 ABCpred 方法预测溶藻弧菌TolB蛋白B细胞抗原表位的肽段位置

表2 BepiPred 2.0方法预测溶藻弧菌TolB蛋白B细胞抗原表位的肽段位置

表3 溶藻弧菌TolB蛋白CTL抗原表位预测

续表3 溶藻弧菌TolB蛋白CTL抗原表位预测
2.7.2 溶藻弧菌TolB蛋白Th抗原表位预测 应用在线软件ProPred对溶藻弧菌TolB蛋白进行Th抗原表位预测,选用DRB1-0101、DRB1-0102、DRB1-0301 三种不同多肽类型(表4)。综合相同抗原表位序列分析得到,溶藻弧菌TolB蛋白的Th抗原表位是26—34位的LVITDGIDS。

表4 溶藻弧菌TolB蛋白Th抗原表位预测
2.8 溶藻弧菌TolB蛋白重组串联抗原表位的设计
为得到抗原性较好的串联表位序列,将获得的B、T抗原表位进行编号,在相邻表位间添加4个甘氨酸(GGGG)作为柔性片段,再用DNASTAR 7.1,将B细胞表位设置为epitope1—epitope4,CTL表位设置为epitope5,Th表位设为epitope6,分析线性表位的各种排列方式,对不同的排列组合进行优化,选取最佳顺序为epitope1-epitope6-epitope3-epitope2-epitope5-epitope4(图9)。转化成氨基酸序列为:QRSGKFSPVPTSKMPQGGGGLVITDGIDSGGGGGEREKITSYP-RGGGGLVYEQLTGDRGGGGGVLFNKVATVGGGGG-RFKARLP(下划线为柔性片段)。翻译成核酸序列为CAACGTAGTGGTAAATTTAGCCCAGTTCCAACG-AGCAAAATGCCACAAGGTGGCGGTGGCGTGCTGTT-CAATAAAGTAGCCACTGTTGGTGGCGGTGGCGGTG-AACGTGAGAAAATTACTTCATACCCACGTGGTGGC-GGTGGCTTGGTGTATGAGCAGTTGACTGGCGACCG-TGGCGGTGGCGGTGGCTTGGTCATTACCGATGGTA-TTGATTCAGGTGGCGGTGGCGGTCGATTCAAAGCT-AGATTACCG(下划线为柔性片段核酸序列)。

图9 溶藻弧菌TolB蛋白重组表位多肽抗原指数分析
3 结论与讨论
生物信息学分析是目前分析蛋白质结构与功能的重要手段[14-15],可进行蛋白质进化关系、理化性质及高级结构的准确预测[16],尤其在蛋白质的抗原表位分析和设计方面,有降低试验盲目性,提高工作效率等特点,在疫苗研制上被应用广泛[17]。
溶藻弧菌TolB氨基酸序列系统进行发生分析显示,溶藻弧菌、副溶血性弧菌、霍乱弧菌和费氏弧菌亲缘关系较近,表明溶藻弧菌TolB蛋白对这4种菌的感染可能存在交叉免疫保护作用,这为蛋白质多肽疫苗的研制奠定了基础。这4种菌形态上均为弧菌,可见本研究得到的分子学分类结果与形态学分类结果相一致。预测发现,溶藻弧菌TolB蛋白为亲水性蛋白,无跨膜结构,存在信号肽序列,表明溶藻弧菌TolB蛋白位于细胞膜外。因而,TolB蛋白与宿主免疫系统存在直接的相互作用,推测TolB蛋白易于激活宿主的免疫功能,从而具有较高的免疫原性[8]。溶藻弧菌TolB蛋白二级结构中无规则卷曲占40.00%,而此结构易形成盘旋、扭曲,暴露在蛋白质外层,成为优势细胞抗原表位的可能性较大[18],为抗原表位的存在奠定基础。
目前, B细胞表位的常用预测方法有BepiPred、ABCpred和DNASTAR[19]。BepiPred方法主要是利用隐马尔可夫模型以及氨基酸的特定性质进行线性表位的预测[20];基于人工神经网络算法的ABCpred方法,预测结果准确率较高[21]。同时使用2种方法,可提高预测的准确性[22]。本研究结合BepiPred 2.0与ABCpred方法对溶藻弧菌TolB蛋白B细胞表位预测,并结合二级结构分析结果,选取抗原性较好的无规则卷曲位置作为B细胞表位序列,最终获得溶藻弧菌TolB蛋白B细胞表位为64—79、171—181、254—264、428—435位。这为串联表位疫苗的设计提供了理论依据。
CTL细胞表位是抗原中与MHC-Ⅰ类分子结合后,经过抗原呈递作用,可激活CTL细胞免疫的短肽,常见预测CTL细胞表位的方法有神经网络与量化矩阵法、IEDB、SYFPEITHI、BIMAS、IMTECH、NetCTL和NetMHC等[18,23-26],在肿瘤、病毒、细菌和寄生虫CTL抗原表位预测上均有应用[24,27]。本研究采用神经网络与量化矩阵法对溶藻弧菌TolB蛋白的CTL表位分析,结果得到该蛋白CTL表位为148—156位的VLFNKVATV,这些溶藻弧菌TolB蛋白的肽段可能与MHC-Ⅰ类分子结合,经过呈递作用,最终活化CTL细胞的细胞毒作用。
Th细胞表位是抗原中与MHC-Ⅱ类分子结合后,会增强机体免疫反应能力的短肽,表达于APC表面,而被CD4+T细胞识别结合,活化Th细胞以辅助B细胞产生抗体[28]。本试验通过选取3类不同等位基因的Th表位进行分析,获得溶藻弧菌TolB蛋白的Th表位区段为,26—34位的LVITDGIDS,这些Th表位序列可能与MHC-Ⅱ类分子结合形成复合物,经抗原呈递后激活机体的免疫反应。表位疫苗是一种可同时携带多个抗原表位及辅助性表位的疫苗,具有安全性好、易操作和可控等优点[29]。刘昆梅等[30]设计的多表位疫苗,不仅结构合理且有较强的反应原性。预测溶藻弧菌TolB蛋白细胞表位,对研发TolB蛋白表位疫苗具有重要意义。
本研究对溶藻弧菌TolB蛋白的生物学分析,成功预测到其理化性质和结构特征,并得到了抗原性较好的重组多肽。为TolB蛋白的深入研究以及疫苗和免疫诊断试剂的研制奠定了理论基础。然而,该蛋白新合成的重组多肽免疫保护功能还有待于更深层次的研究和阐释。

