互花米草BADH基因的克隆与定量表达分析
刘 振,张 侠,尹海波,陈世华,郭善利
(烟台大学 生命科学学院,山东 烟台 264005)
长期以来,对土地不合理的利用(不合理轮作、过度施用化肥、不合理浇灌、过度放牧等)及对植被资源的过度开采,导致土地受到不同程度的盐渍化威胁,荒漠戈壁滩的面积也不断扩大,同时,盐渍化和干旱也成为制约农业发展的重要非生物胁迫因素。因此,如何有效地开发利用盐碱地、干旱地成为社会关注的重点。
互花米草(Spartinaalterniflora)是一种禾本科米草属的多年生草本植物,适宜生长在潮间带,起源于美国大西洋沿岸和墨西哥湾,引进中国后主要分布在沿海滩涂地带。互花米草叶互生、具盐腺,是挖掘耐盐基因良好的生物材料。1996年Wood等[1]研究发现,禾本科植物含有甜菜碱醛脱氢酶基因。甘氨酸甜菜碱(Glycine betain,以下简称甜菜碱)是以胆碱为底物,丝氨酸为原料,在胆碱单加氧酶的催化下先生成甜菜碱醛,再通过甜菜碱醛脱氢酶(BADH)的氧化作用生成的[2-3]。甜菜碱作为植物中重要的渗透调节剂,在植物遭受盐碱、干旱等逆境胁迫时,帮助植物维持细胞渗透平衡,并可保护蛋白酶活性,激活抗逆基因表达,显著提高植物的抗逆能力。目前已从菠菜[4]、辽宁碱蓬[5]、异苞滨藜[6]、大麦[7]、结缕草[8]、盐节木[9]、柳树[10]等植物中克隆出BADH基因。将BADH基因转入小麦[11]、水稻[12]、大豆[13]、玉米[14]、棉花[15]、羽衣甘蓝[16]等植物使其耐盐性或耐旱性得到不同程度的提高。本研究拟从盐生植物互花米草中克隆BADH基因,对其进行生物信息学及表达分析,为进一步研究其耐逆功能和分子机制提供理论依据。
1 材料和方法
1.1 试验材料
互花米草种子采集于山东莱州海滨,浸泡处理后4 ℃保存。将保存的种子种植于基质中(1/2椰土+1/2黑土),在25 ℃、光照/黑暗为16 h/8 h的环境下培养2周。取长势一致的植株移到小方盆中,继续培养至4~5叶龄[17]。用600 mmol/L的NaCl溶液浇灌4~5叶龄幼苗48 h,剪取幼嫩叶片,液氮速冻后-80 ℃保存,用于BADH基因的克隆。用600 mmol/L的NaCl溶液、20%的 PEG溶液分别对幼苗进行浇灌和喷洒处理,分别胁迫0、3、6、12、24、48 h,每个处理重复3次。洗样,剪取幼嫩叶片,液氮速冻后-80 ℃保存,用于BADH基因的表达分析。
大肠杆菌DH5α为烟台大学植物发育分子生物学实验室保存;PCR相关试剂、pMD18-T Vector、T4DNA连接酶、限制性内切酶、DNA凝胶回收试剂盒均购自TaKaRa;BIOZOL RNA Kit购自BIOFLUX公司;Reverse Transcriptase试剂盒购自Promega公司;氨苄青霉素购自Sigma公司;其他试剂多为国产分析纯;引物由北京华大六合基因公司合成。
1.2 试验方法
1.2.1 互花米草BADH基因的克隆 取冻存的用于基因克隆的互花米草叶片,液氮研磨,利用BIOZOL RNA Kit提取RNA,使用超微量紫外分光光度仪检测其纯度和浓度,用1%的琼脂糖凝胶电泳检测其完整性。利用Reverse Transcriptase试剂盒体外反转录合成cDNA。根据烟台大学植物发育分子生物学实验室转录组测序结果,获得BADH基因的中间片段,在此基础上设计RACE引物(S31-BADH:5′-CCAAGATTACTGAGAGGAAGCCTG-3′;S32-BADH:5′-CCACCTTCAGAGAGACCCTATTGG-3′;S51-BADH:5′-CCAATAGGGTCTCTCTGAAGGTGG-3′;S52-BADH:5′-CAGGCTTCCTCTCAGTAATCTTGG-3′),以cDNA为模板,进行PCR扩增。反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,68 ℃延伸90 s,30个循环;68 ℃充分延伸10 min。DNA凝胶回收试剂盒回收目的片段,加尾,与pMD18-T Vector连接,转化DH5α感受态细胞,酶切,挑选阳性克隆送华大基因公司测序。比对分析测序结果,拼接获得互花米草BADH全长cDNA序列,登陆NCBI网站(http://www.ncbi.nlm.nih.gov)进行Blast比对,确认其为互花米草BADH基因,将其命名为SaBADH基因。根据拼接获得的全长cDNA序列,设计引物(SaBADH1-oxF:5′-CTCTAGACACCCAAAGCCCAAGCTCAGTG-3′;SaBADH1-oxR:5′-GGTACCCACACGACTTCAGCACATGGTAC-3′),以cDNA为模板,扩增SaBADH基因。反应条件为:94 ℃预变性7 min;94 ℃变性30 s,55 ℃退火30 s,68 ℃延伸120 s,35个循环;68 ℃充分延伸10 min。将扩增产物回收,加尾,连接,转化,酶切,挑选阳性克隆送测序,确认获得正确的SaBADH基因的pMD18-T 克隆载体。
1.2.2 互花米草BADH基因的生物信息学分析 利用NCBI数据库(https://www.ncbi.nlm.nih.gov/gorf/gorf.html)进行Blast比对分析,取部分高度相似(相似度>70%)的同源序列,利用MEGA 6进行同源序列比对,构建N-J进化树,分析SaBADH与其他植物BADH的进化关系。利用Expasy软件(https://web.expasy.org/protparam)分析SaBADH蛋白的基本理化性质。利用PredictProtein软件(https://www.predictprotein.org/)预测SaBADH的二级结构和亚细胞定位。利用InterProScan软件(http://www.ebi.ac.uk/interpro/search/sequence-search)分析蛋白质的结构域。利用SWISS-MODEL软件(https://swissmodel.expasy.org/)进行三维建模,预测其三级结构。
1.2.3 互花米草BADH基因的表达分析 取冻存的用于表达分析的互花米草叶片,用BIOZOL RNA Kit提取RNA,用Reverse Transcriptase试剂盒合成cDNA,稀释20倍作为qRT-PCR的模板。根据SaBADH基因的cDNA全长序列,设计定量引物(SaBADH-RTF:5′-TAAGTGGTCACAGCACACGGAAC-3′,SaBADH-oxR:5′-GGTACCCACACGACTTCAGCACATGGTAC-3′)。以tub为内参,进行PCR反应得到扩增曲线。反应条件为:95 ℃预变性10 min;95 ℃变性10 s,57 ℃退火15 s,72 ℃延伸20 s,40个循环)。循环结束后,从72 ℃缓慢升温至95 ℃获得熔解曲线。
1.3 数据分析
采用Excel 2003软件绘图,利用SPSS 19.0软件进行统计分析。本研究采用单因素方差分析,进行方差齐性检验和LSD分析。
2 结果与分析
2.1 互花米草BADH基因的克隆
采用RACE技术获得的SaBADH基因的两端序列见图1,将其与本课题组实验室通过转录组测序得到的中间片段进行拼接,得到SaBADH基因cDNA的全长序列,在NCBI网站进行Blast比对,发现SaBADH与细叶结缕草、二穗短柄草、高粱氨基酸的BADH相似性分别达到96%、87%、86%,且氨基酸数量基本相同,确认拼接得到了SaBADH基因。根据SaBADH基因cDNA的全长序列设计引物,以cDNA为模板,扩增SaBADH基因(图1),获得SaBADH的克隆载体pMD18-T ∶∶SaBADH。
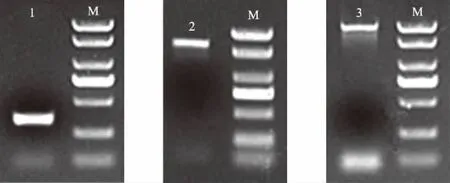
M:Marker 2000 plus;1:互花米草SaBADH基因5′RACE产物;2:互花米草SaBADH基因3′RACE产物;3:互花米草SaBADH基因全长产物图1 互花米草SaBADH基因电泳结果
2.2 互花米草BADH基因的生物信息学分析
SaBADH基因的cDNA全长1 983 bp,开放阅读框1 515 bp,编码504个氨基酸(图2)。Expasy软件预测SaBADH蛋白分子质量为54.388 ku,理论等电点为5.45,不稳定系数为33.37,脂肪系数为88.89,平均亲水系数为-0.080,为稳定的亲水性蛋白[18]。PredictProtein软件预测SaBADH蛋白的二级结构由43.65%的H、17.06%的E、39.29%的L组成,SaBADH蛋白定位于叶绿体。InterProScan分析SaBADH具有碱醛脱氢酶结构域。SaBADH的三级结构预测显示其为椭球形。SaBADH的Blast比对发现,互花米草与细叶结缕草、二穗短柄草、高粱的相似性达到86%以上。从N-J进化树(图3)中可知,互花米草BADH与结缕草属细叶结缕草BADH亲缘关系最近,其次是短柄草属二穗短柄草、高粱属高粱、蜀黍属谷子等禾本科单子叶植物的BADH,与棉花、山萮菜等双子叶植物的BADH亲缘关系较远。

单下划线为叶绿体定位序列;双下划线为十缩肽;阴影为酶功能相关残基;*为终止密码子图2 互花米草BADH的核苷酸序列及其所编码的氨基酸序列
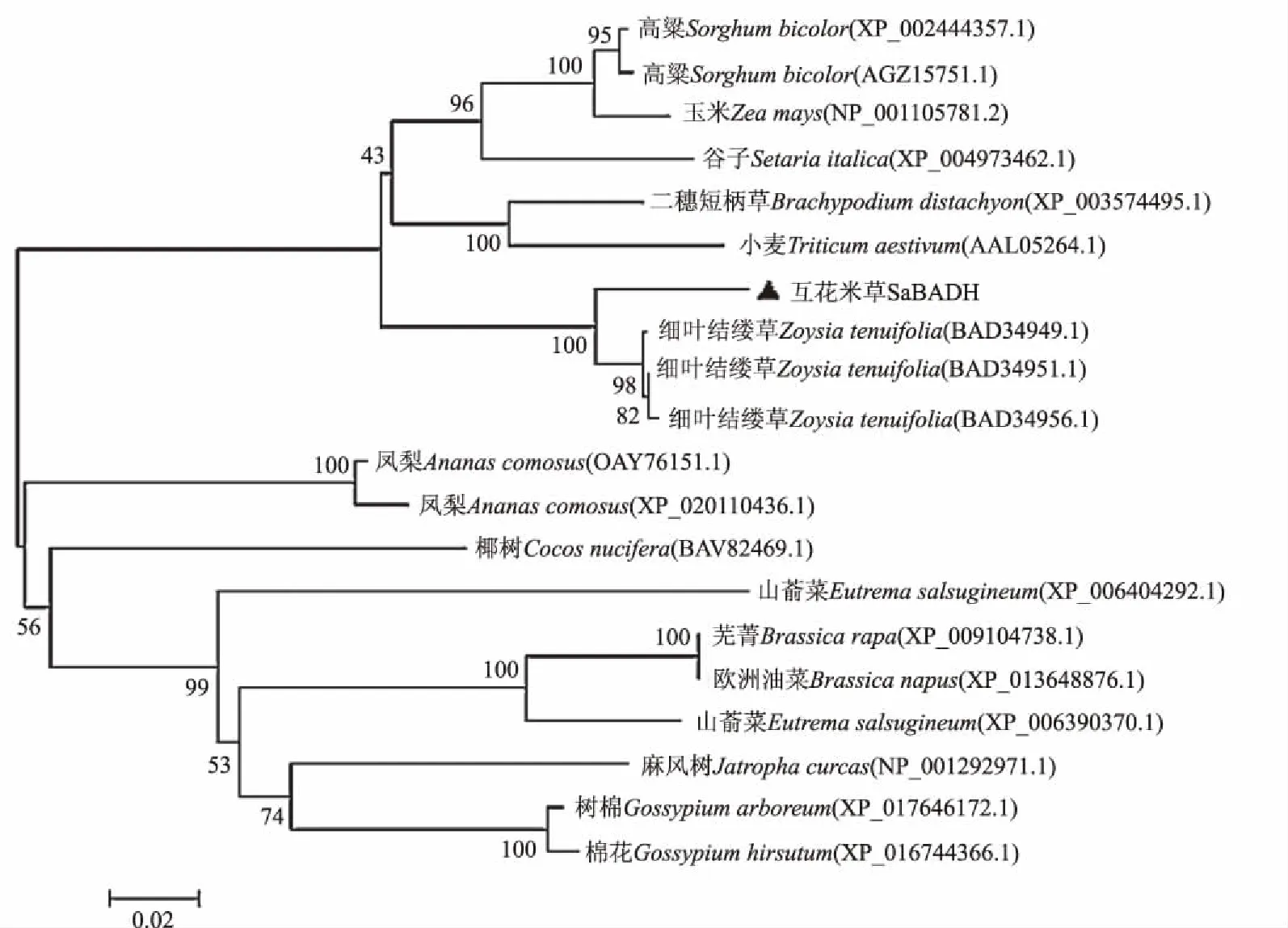
图3 互花米草和其他植物的BADH系统进化树
2.3 互花米草BADH基因的表达分析
对在600 mmol/L NaCl和20% 的PEG不同胁迫时间处理下的互花米草的qRT-PCR分析结果表明(图4),随着处理时间的延长,SaBADH基因的表达呈现先上升后下降的趋势,分别在处理24、12 h时达到最大值,分别为对照的7、4倍,且与对照相比差异达到极显著水平,表明SaBADH受NaCl、PEG诱导表达,这与互花米草的耐盐耐旱有密切关系。
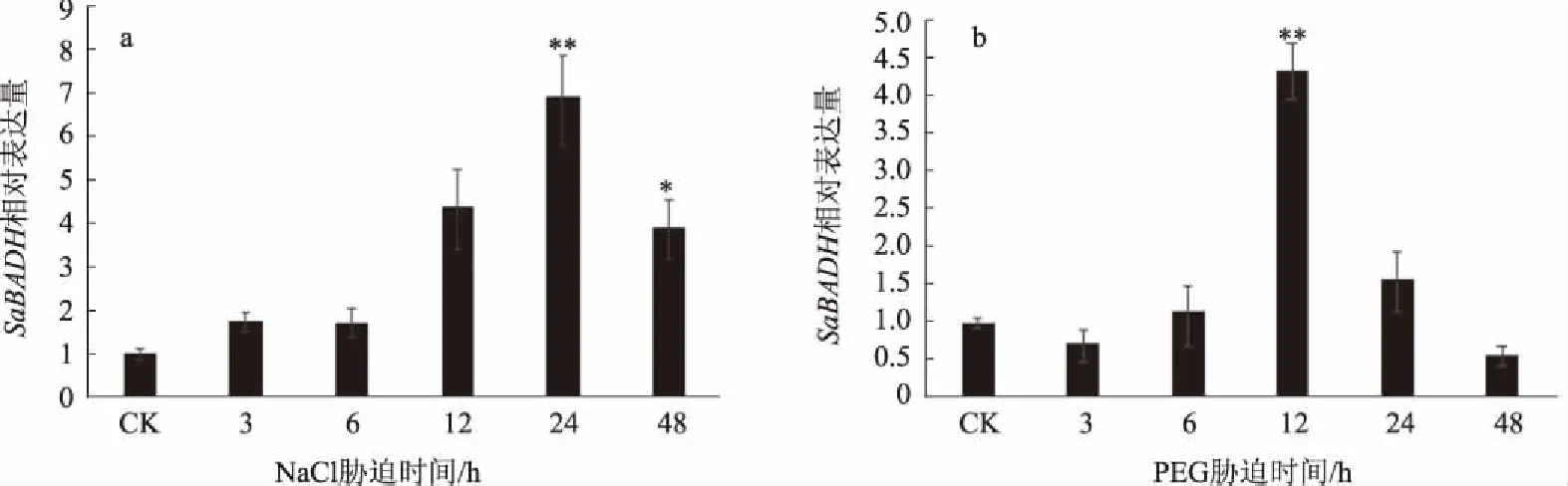
*、**分别表示在0.05、0.01水平差异显著图4 互花米草BADH在NaCl、PEG胁迫下的定量表达分析
3 结论与讨论
BADH是甜菜碱合成过程中的关键酶,在植物耐逆过程中起重要作用[18-20],随着全球土地盐渍化和干旱等非生物胁迫因素的加剧,研究植物的耐逆基因意义愈发重大。目前,已经克隆出多种植物耐逆相关基因,主要有渗透物质合成酶基因、功能蛋白基因、信号转导相关基因等[21]。本研究通过RACE技术,从互花米草中克隆出BADH基因的全长cDNA序列。生物信息学分析预测SaBADH为稳定的具有椭球形三级结构的亲水性蛋白,定位于叶绿体。已有报道指出,BADH定位于叶绿体的序列为QLFIDGE[22],推测SaBADH蛋白的氨基酸序列中的QLFIGGE指导其定位到叶绿体。InterProScan分析SaBADH具有碱醛脱氢酶结构域。有报道指出,碱醛脱氢酶结构域有保守的VTLELGGKSP十缩肽[23],推测SaBADH蛋白的氨基酸序列中VSLELGGKSP是该酶的保守十缩肽。系统进化分析显示,SaBADH是序列保守的蛋白质,单子叶与双子叶BADH、禾本科与非禾本科BADH在进化上有一定的差异,这与植物分类学上的亲缘关系一致。为进一步探讨SaBADH的耐盐机制,本研究利用qRT-PCR仪对SaBADH在600 mmol/L NaCl、20%的PEG胁迫处理下的表达量进行了相对定量表达研究。结果发现,SaBADH的相对表达量发生了很大变化,这说明SaBADH受NaCl、PEG诱导表达。在NaCl胁迫处理时,随着处理时间的延长SaBADH的相对表达量逐渐增加,处理24 h时达到最大,约为对照的7倍,且差异达到极显著水平,之后SaBADH的相对表达量下降;在PEG胁迫处理时,随着处理时间的延长SaBADH的相对表达量逐渐增加,在处理12 h时达到最大,约为对照的4倍,且差异达到极显著水平,之后SaBADH的相对表达量下降。由此可见,SaBADH在盐胁迫和干旱胁迫下基因表达上调,通过增加SaBADH的表达量来抵御盐和干旱胁迫对自身的毒害,这与互花米草在植物耐逆机制方面有较保守的功能密切相关。
随着土壤盐渍化和干旱问题的日益严重,利用基因工程技术培育耐盐耐旱新品种对于开发利用盐碱、干旱土地有重要意义。本实验室下一步将构建SaBADH的过量表达载体,转模式植物拟南芥,进一步研究SaBADH的耐逆功能与分子机制。

