渗透压对嗜线虫致病杆菌YL001生长及抑菌活性的影响
李忝珍,张淑静,刘 启,王 茜,王永宏,2,张 兴,2
(1西北农林科技大学 无公害农药研究服务中心,陕西 杨凌 712100;2陕西省生物农药工程技术研究中心,陕西 杨凌 712100)
嗜线虫致病杆菌(Xenorhabdusnematophila)是寄生于小卷蛾线虫(Steinernemacarpocapsae)肠道内的一种革兰氏阴性细菌,随线虫进入昆虫体内,在血淋巴中大量繁殖,产生毒素并分解昆虫的营养物质,使其患败血症死亡[1-2],同时产生活性物质抑制其他杂菌的生长[3]。嗜线虫致病杆菌能产生多种次生代谢产物,这些次生代谢产物具有多种化学结构,在医药和农业上具有广泛的生物活性[4]。水溶性苯并芘类化合物(Xenocoumacins,XCN)和酰胺类化合物(Nematophin) 是X.nematophila产生的主要抑菌活性物质[5-6]。其中Xenocoumacins包括Xenocoumacin 1和Xenocoumacin 2(以下简称XCN1和XCN2),XCN1具有较高的抑菌活性,XCN2无抑菌活性,在一定条件下XCN1可以向XCN2转化,XCN1对疫霉病菌及细菌都表现出较好的抑制作用[7-8]。Nematophin不仅对枯草芽孢杆菌等病原细菌有较强的抑制作用,而且还对临床上耐药性高的金黄色葡萄球菌也表现出较高的活性[9-10]。
嗜线虫致病杆菌次生代谢产物的产生与外界环境条件(温度、pH等)密切相关[11]。环境渗透压作为一种重要的环境因子,其变化会改变胞内水活度及细胞膜透性,影响胞内大分子物质的结构,从而造成细胞在结构和生理上的损伤[12-13],甚至导致细胞死亡。当环境渗透压发生变化,微生物往往会启动多种渗透压响应机制来避免或减轻细胞受到的伤害,如自身合成或胞外转运相容性溶质[14-15]、改变代谢途径[16]或细胞膜的特性[17]等,从而影响菌体生长及次级代谢产物的产生。Delgado等[18]研究发现,适当的渗透压不利于乳酸菌B96菌体生长,但更有利于刺激细菌素的产生。张甲庆等[19]研究发现,在渗透压胁迫后植物乳杆菌KLDS1.0391活菌数量、葡萄糖代谢及细菌素合成能力均下降。嗜线虫致病杆菌由侵染期的斯氏线虫携带进入昆虫寄主体内,主要在昆虫血淋巴中繁殖[1],昆虫血淋巴不仅营养丰富,而且具有较高浓度的无机盐[20],这就迫使菌体的生长、毒素和抑菌活性物质产生必然处于较高的渗透压环境中。此外,在发酵过程中,随着培养基营养成分的消耗,高浓度的底物、产物及有害物质的积累,也会带来较高的渗透胁迫[21],进而影响嗜线虫致病杆菌的生长及次生代谢产物的产生。Crawford等[9]研究发现,渗透压能调控嗜线虫致病杆菌的代谢,菌体通过转运L-脯氨酸可激发隐藏代谢产物的产生,但是关于渗透压对嗜线虫致病杆菌的生长、抑菌活性及抑菌活性物质产生的影响仍鲜有报道。
本课题组早期研究发现,嗜线虫致病杆菌YL001具有广泛的抑菌活性[22]。为了明确渗透压对嗜线虫致病杆菌YL001生长及抑菌活性物质产生的影响,本研究以NaCl为渗透压调节物质,考察嗜线虫致病杆菌YL001在不同渗透压条件下生长、抑菌活性变化及抑菌活性物质酰胺类化合物和XCN产生的变化,以期为进一步提高YL001菌株抑菌活性及其开发利用奠定基础。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株 嗜线虫致病杆菌嗜线虫致病杆菌YL001菌株(以下简称YL001),从采自陕西杨凌的斯氏线虫(Steinernemasp.)YL001中分离鉴定获得,由西北农林科技大学无公害农药研究服务中心提供。
1.1.2 供试病原菌 供试病原细菌枯草芽孢杆菌(Bacillussubtilis)、苏云金芽孢杆菌(Bacillusthuringiensis)、蜡状芽孢杆菌(Bacilluscereus)、猕猴桃溃疡病菌(Pseudomonassyringae)、水稻白叶枯病菌(Xanthomonascampestris)、金黄色葡萄球菌(Staphylococcusaureus)及供试病原真菌水稻稻瘟病菌(Magnaporthegrisea)、番茄灰霉病菌(Botrytiscintrea)、小麦赤霉病菌(Fusariumgraminearum)、棉花黄萎病菌(Verticiliumdahliae)、苹果轮纹病菌(Physalosporapiricola)、苹果炭疽病菌(Clomerelacinyulate)、油菜菌核病菌(Sclerotiniasclerotiorum)、玉米弯孢病菌(Curvularialunata(Wakker) Boed)、黄瓜炭疽病菌(Colletotrichumorbiculare)、水稻纹枯病菌(Thanatephoruscucumeris)、苹果树腐烂病菌(ValsamaliMiyabe et Yamada),均由西北农林科技大学无公害农药研究服务中心提供。
1.1.3 培养基 种子活化NB液体培养基:牛肉膏3 g,蛋白胨5 g,超纯水1 000 mL。共生菌鉴别培养基NBTA[23]:牛肉膏3 g,蛋白胨5 g,氯化三苯基四氮唑0.040 g,溴麝香百里酚蓝0.025 g,琼脂18 g,超纯水1 000 mL。病原细菌培养基为NA培养基:牛肉膏3 g,蛋白胨5 g,琼脂18 g,超纯水1 000 mL;发酵培养基TSB[24]:胰蛋白胨17 g,大豆胨3 g,K2HPO42.5 g ,葡萄糖2.5 g,NaCl 5 g,超纯水1 000 mL。各培养基初始pH用0.1 mol/L NaOH和0.1 mol/L HCl调节至7.0~7.2,在121 ℃灭菌30 min后备用。
1.2 发酵培养
挑取种管保存的YL001单菌落接种于NB培养基,于28 ℃、180 r/min活化24 h后划线接种于NBTA平板,25 ℃培养48 h,用接种环挑取初生型单菌落,再次接种于 NB 培养基中,28 ℃、180 r/min振荡培养至OD600为 1.00,作为种子按体积分数10%的接种量接种于NaCl质量浓度分别为0,5,10,20,30,40 g/L的TSB发酵培养基中,于28 ℃、180 r/min培养72 h。
1.2.1 发酵液上清液制备 将YL001进行批量发酵获得共生菌发酵液,于4 ℃、9 000 r/min离心 15 min, 得发酵液上清液,用于抑菌活性测定。
1.2.2 发酵液甲醇提取物制备 将发酵液上清液用 D101 大孔吸附树脂柱吸附24 h,去离子水冲洗3次后用甲醇进行洗脱,洗脱液减压浓缩去甲醇后,冷冻干燥得发酵液甲醇提取粗制品。
1.3 发酵过程中参数测定方法
1.3.1OD600测定 采用比浊发[25]测定。将不同培养时间的发酵液稀释10倍后,用紫外分光光度计测定600 nm波长下的吸光值。本研究用OD600表征细胞生物量,以培养时间为横坐标,以吸光值为纵坐标绘制生长曲线。
1.3.2 pH测定 采用pH计测定不同培养时间发酵液的pH值。
1.3.3 还原糖含量测定 采用3,5-二硝基水杨酸法[26]测定不同培养时间发酵液中残余还原糖含量,检测波长为520 nm。
1.4 不同NaCl质量浓度下YL001发酵液抑菌活性的测定
1.4.1 对细菌抑菌活性的测定 采用琼脂扩散法[27]测定病原细菌对不同渗透压条件下嗜线虫致病杆菌YL001发酵液上清液的敏感性。待测发酵液上清液用量为75 μL,以TSB培养基为对照,以100 μg/mL链霉素为药剂对照,28 ℃培养 24 h,采用十字交叉法测量抑菌圈直径。
1.4.2 对真菌抑菌活性的测定 采用生长速率法[28]测定不同渗透压条件下嗜线虫致病杆菌YL001发酵液上清液对植物病原真菌菌丝生长的抑制作用。以相同质量浓度NaCl培养基作为空白对照,在25 ℃黑暗条件下培养5 d,采用十字交叉法测量各菌落直径,计算抑制率。
菌落生长直径(mm)=菌落直径-4.0(菌饼直径);

1.4.3 对番茄灰霉病的防治作用 采用活体组织法[29],在番茄果实上测定不同渗透压条件下嗜线虫致病杆菌YL001发酵液上清液对番茄灰霉病菌(Botrytiscintrea)的抑制效果。采摘健康新鲜、大小均一的番茄果实(带蒂),表面用体积分数75%酒精擦拭消毒后晾干。保护作用测定方法为,先将发酵上清液喷施于番茄表面,25 ℃保湿培养 24 h后接种番茄灰霉病菌菌饼;治疗作用测定方法为,先在保湿条件下接种番茄灰霉病菌菌饼,24 h后再喷施发酵上清液。每处理3次重复,以1 000 mg/L的 多菌灵作为药剂对照,无菌水为空白对照,5 d后检查结果,计算相对防效。
病斑直径(mm)=测量直径-4.0(菌饼直径);
1.5 不同NaCl质量浓度下抑菌物质Nematophin和Xenocoumacins含量分析
1.5.1 Nematophin含量 采用HPLC定量分析不同渗透压条件下YL001甲醇提取物中抑菌活性物质Nematophin的含量。按照1.2.2节方法,各处理使用100 mL发酵液上清液制备获得甲醇粗提物,将其溶于10 mL 50%甲醇/水(体积比)制成样品,经0.22 μm微孔滤膜过滤后进行液相分析。色谱条件:色谱柱Thermo C18 column (250 mm×4.6 mm×3.5 μm) HPLC 柱;色谱流速1 mL/min ;流动相为45%甲醇/水(体积比),20 min。检测波长254 nm;液相进样量10 μL;柱温30 ℃。
精确称量标准品Nematophin,加50%甲醇/水(体积比)制成质量浓度分别为7.812 5,15.625,31.25,62.5,125,250 μg/mL的标准溶液,按照上述色谱条件分别吸取6个标准品溶液10 μL进样,以标准品质量浓度为横坐标(x),色谱峰面积为纵坐标(y)绘制标准曲线,拟合回归方程并确定相关系数。
1.5.2 Xenocoumacins含量 采用API2000 LC-MS系统测定Xenocoumacins的相对含量(样品处理参照1.5.1节)。色谱条件:色谱柱Agilent C18 column(150 mm×4.6 mm×3.5 μm);流动相0~22 min 5%~95%(0.1%甲酸)乙腈,22~24 min 95%~5%乙腈,24~30 min 5%乙腈,流速0.5 mL/min;检测波长280 nm;进样体积 1 μL;ESI喷雾电压[8]。物质相对含量计算如下:
1.6 数据处理
本研究中所有数据均为3次重复试验的平均值,试验数据用SPSS 20.0和Excel 2013进行分析,采用Origin 2016进行图形处理。
2 结果与分析
2.1 不同NaCl质量浓度对YL001菌株生长代谢的影响
2.1.1 菌株的生长动态 渗透压对嗜线虫致病杆菌YL001菌株细胞生长的影响如表1所示。由表1可以看出,不同NaCl质量浓度条件下YL001菌株呈现出相同的生长趋势, 培养0~36 h过程中YL001菌体大量生长,培养36 h后达到稳定期;同时YL001菌株的生长量随着培养基中NaCl质量浓度的增大逐渐下降。NaCl质量浓度分别为0,5 g/L时,YL001菌体生长旺盛,显著优于其他处理;NaCl质量浓度为40 g/L时,YL001菌株生长最慢。发酵72 h后,NaCl质量浓度为0 g/L时菌体生物量最大,吸光值达到0.63,分别是5,10,20,30,40 g/L NaCl处理的1.01,1.13,1.50,1.85,3.00倍。这说明YL001菌体生物量随渗透压的增大而下降,低渗透压条件有利于YL001菌株生长。
2.1.2 pH值的变化 由表2可知,不同渗透压条件下YL001发酵液pH变化呈现相同趋势。培养0~12 h,pH下降;培养12 h后,pH开始上升。培养12 h后,0,5,10,20,30,40 g/L NaCl条件下YL001菌株发酵液的pH值分别降低至6.74,6.05,5.91,5.55,6.25,6.69,此后pH值逐渐上升,发酵结束时不同处理YL001菌株发酵液pH值分别为8.84,8.69,8.53,7.92,7.61,7.07。培养前期,YL001菌株大量利用碳源,使发酵液中有机酸含量升高,导致pH值下降;随着菌体量的迅速增加,氮源分解速度加快,氨基氮含量升高,致使pH值迅速上升。NaCl质量浓度为0,5,10 g/L时,发酵前后pH值变化较大,说明低渗透压条件下YL001菌株生长代谢旺盛,细胞生长较快;而40 g/L条件下pH变化幅度较小,说明高渗透压条件下YL001生长较慢。

表1 渗透压对嗜线虫致病杆菌YL001菌株细胞生长的影响Table 1 Effect of osmotic pressure on growth of YL001
注:同列数据后标不同小写字母表示差异显著(P<0.05)。下表同。
Note:Different lowercase letters in each row mean significant difference (P<0.05).The same below.

表2 渗透压对嗜线虫致病杆菌YL001菌株发酵液pH值的影响Table 2 Effect of osmotic pressure on pH of YL001 fermentation liquid
2.1.3 还原糖的变化 由表3可以看出,在发酵培养期间,不同NaCl质量浓度下YL001生长代谢所消耗还原糖的速率存在差异,随着培养基中NaCl质量浓度的增大,培养基残糖含量增加,40 g/L NaCl处理残糖含量显著高于其他处理。残糖含量均在0~36 h迅速降低,36 h后缓慢降低并逐渐趋于稳定。发酵结束时,发酵液中的残糖含量存在显著差异,NaCl质量浓度为0,5,10,20,30,40 g/L条件下发酵液中残糖含量分别为0.31,0.30,0.30,0.35,0.40,0.60 g/L,其中NaCl质量浓度为0,5,10 g/L时,残糖含量无显著差异,随着NaCl质量浓度的进一步增大,残糖含量增加且差异越来越显著。这表明,低渗透压下YL001对还原糖的利用率较高,高渗透压条件下,YL001对还原糖的利用率显著降低。
2.2 不同NaCl质量浓度对YL001菌株抑菌活性的影响
2.2.1 对细菌的抑菌活性 由表4可知,不同渗透压条件下,YL001菌株发酵液对6种细菌均有一定的抑制作用,尤其对枯草芽孢杆菌、蜡状芽孢杆菌和金黄色葡萄球菌存在较好的抑菌效果,如NaCl质量浓度为0 g/L时,抑菌圈直径分别达到21.83,20.67和21.00 mm,但随着渗透压的增大,抑菌圈直径逐渐减小,抑菌作用减弱。在NaCl质量浓度为0,5,10 g/L 时,YL001菌株发酵液对苏云金芽孢杆菌、蜡状芽孢杆菌、猕猴桃溃疡病菌和金黄色葡萄球菌的抑菌圈直径无明显差异,当培养基中NaCl质量浓度增大到20,30,40 g/L时,抑菌圈直径随渗透压的增大显著降低,特别是对蜡状芽孢杆菌,由0,5,10 g/L NaCl的20.67,20.00,19.00 mm下降到20,30,40 g/L NaCl时的15.33,12.00,10.00 mm。这表明YL001发酵上清液对细菌的抑菌活性随着渗透压的增大而逐渐降低。
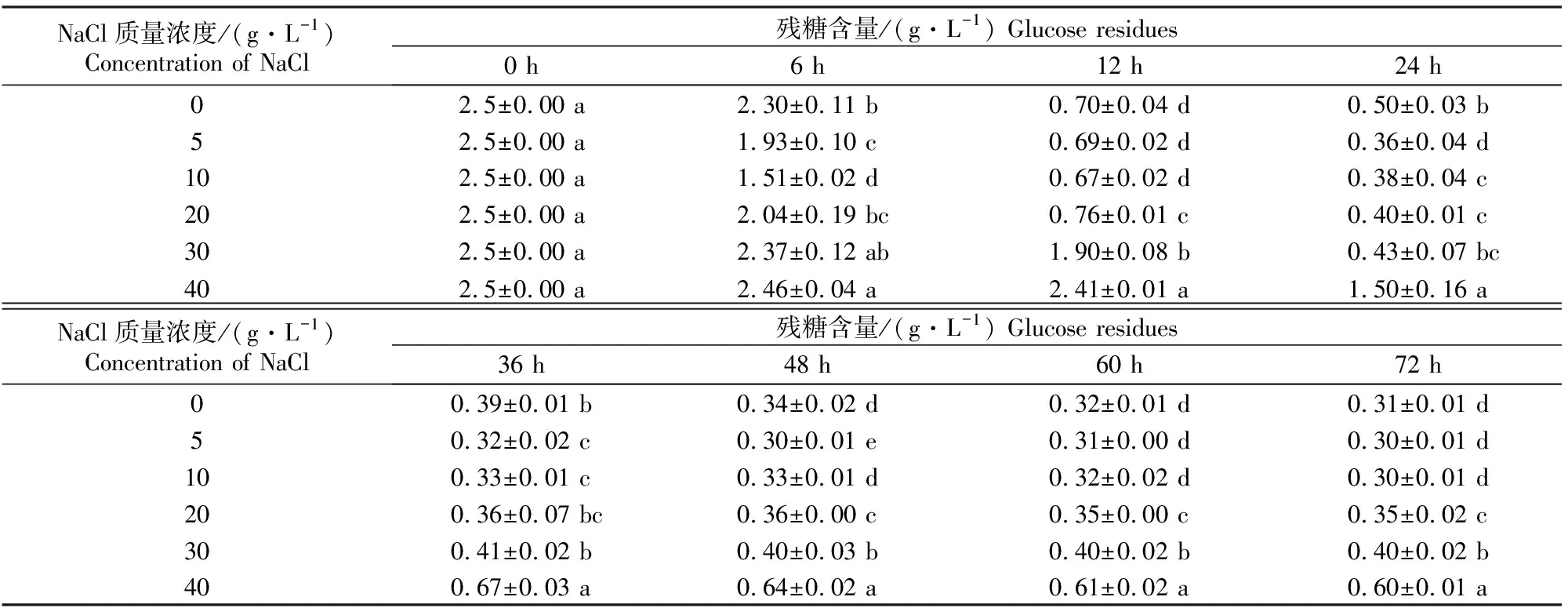
表3 渗透压对嗜线虫致病杆菌YL001菌株还原糖含量变化的影响Table 3 Effect of osmotic pressure on glucose residues of YL001

表4 渗透压对嗜线虫致病杆菌YL001菌株发酵上清液抗细菌活性的影响Table 4 Effects of osmotic pressure on antibacterial activity of YL001
2.2.2 对真菌的抑菌活性 从表5可以看出,不同渗透压条件下,YL001菌株发酵液对不同植物病原真菌的抑制作用有一定的差异,其中对水稻稻瘟病菌、番茄灰霉病菌、苹果树腐烂病菌、苹果轮纹病菌、苹果炭疽病菌、水稻纹枯病菌、油菜菌核病菌具有较好的抑菌效果,在NaCl质量浓度为0 g/L时,抑制率均在80%以上,同5 g/L时相比并无显著差异,但随着NaCl质量浓度的进一步增大,YL001菌株发酵液对真菌的抑制作用呈逐渐减弱的趋势,特别是对油菜菌核病菌,由0,5 g/L时的88.36%,82.69%下降到10,20,30,40 g/L时的71.94%,59.10%,42.69%,11.64%。这表明YL001发酵上清液对病原真菌的抑菌活性随着渗透压的增大而逐渐降低。

表5 渗透压对嗜线虫致病杆菌YL001菌株发酵上清液抗真菌活性的影响Table 5 Effects of osmotic pressure on antifungal activity of YL001
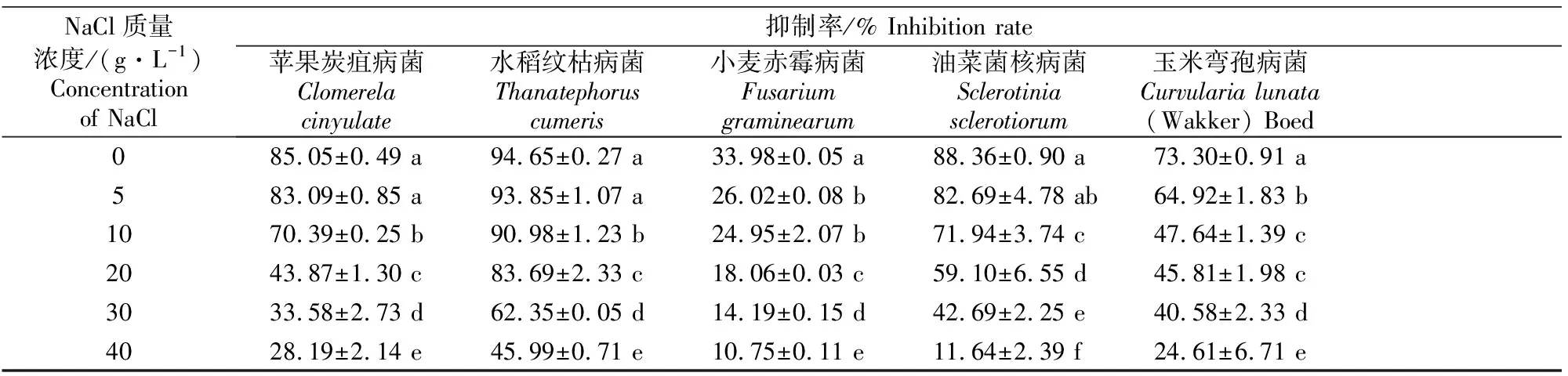
表5(续) Continued table 5
2.2.3 对番茄灰霉病的防治效果 由图1可知,不同渗透压条件下,YL001发酵液对番茄灰霉病有一定的室内药效,且随着渗透压的逐渐增大,YL001发酵上清液对番茄灰霉病的保护作用和治疗作用逐渐减小。治疗作用在NaCl质量浓度为0,5,10 g/L时差异不显著,但显著高于20,30,40 g/L NaCl处理的防效;保护作用在NaCl质量浓度为0,5 g/L时差异不显著,但显著优于10,20,30,40 g/L NaCl处理的防效。其中,0 g/L条件下对番茄灰霉病的保护效果为68.98%,是40 g/L时(39.18%)的1.8倍,显著低于对照药剂的防效(80.04%);0 g/L条件下对番茄灰霉病的治疗效果为43.37%,是40 g/L时(6.62%)的6.6倍,显著低于对照药剂的防效(67.87%)。

同种作用标不同小写字母表示差异显著(P<0.05)。下图同Different lowercase letters mean significant difference (P<0.05).The same below图1 不同渗透压下嗜线虫致病杆菌YL001菌株发酵液对番茄灰霉病的室内药效Fig.1 Inhibitory effect of YL001 on Botrytis cintrea under different osmotic pressures
2.3 不同NaCl质量浓度对YL001抑菌活性物质产生的影响
2.3.1 对Nematophin产生的影响 经回归分析,Nematophin标准品质量浓度(x)与色谱峰面积(y)的回归方程为y=11 892x(R=0.999 6),说明色谱峰面积与标准品质量浓度呈现良好的线性关系,可以满足定量分析要求。由图2可知,不同NaCl质量浓度条件下,YL001发酵液代谢产物中抑菌活性物质Nematophin含量有较大差异。 NaCl质量浓度为0 g/L时,Nematophin含量为13.84 μg/mL,分别是5 g/L(10.03 μg/mL)、10 g/L(8.49 μg/mL)、20 g/L (5.34 μg/mL)、30 g/L(2.53 μg/mL)、40 g/L(1.57 μg/mL)的1.37,1.63,2.59,5.47,8.82倍。表明渗透压对YL001抑菌活性物质Nematophin的产生表现出较强的抑制作用,渗透压越低Nematophin产量越高,反之越低。
2.3.2 对Xenocoumacins产生的影响 Xenocoumacins包括XCN1和XCN2,其中XCN1具有较高的抑菌活性,XCN2无抑菌活性,在一定条件下XCN1可以向XCN2转化。如图3所示,随NaCl质量浓度的升高,XCN1的相对含量呈现出显著下降趋势,XCN2的相对含量则先升高后降低。其中抑菌活性物质XCN1在NaCl质量浓度为0 g/L时相对含量最高,分别是NaCl质量浓度为5,10,20,30,40 g/L时的1.26,1.98,3.84,7.69,28.55倍;XCN2的相对含量在NaCl质量浓度为5 g/L条件下达到最大值,显著高于其他处理。说明渗透压对Xenocoumacins的产生有较大影响,低渗透压条件更有利于代谢产物Xenocoumacins的积累,高渗透压条件不利于Xenocoumacins的积累。

图2 渗透压对嗜线虫致病杆菌YL001菌株产Nematophin的影响Fig.2 Effect of osmotic pressure on Nematophin accumulation of YL001 strains
3 讨论与结论
渗透压作为一种重要的物理参数,影响多种病原细菌的生长与致病力[30]。徐莹等[31]通过研究植物乳杆菌 T102发现,培养基中添加质量分数为1%的NaCl时,菌体生长量较添加5%的NaCl时提高16.23%,细菌素合成能力提高59.60%。Crawford等[9]研究发现,适当的渗透压能刺激嗜线虫致病杆菌ATCC19061次级代谢产物中异腈类化合物及吲哚类化合物的产生,但不利于Nematophin的产生。本研究发现,以NaCl为渗透压调节剂时,低渗透压有利于嗜线虫致病杆菌YL001菌体生长、抑菌活性提高及抑菌活性物质Nematophin、Xenocoumacins的产生,而高渗透压不利于YL001菌体生长及抑菌活性物质的产生。低渗透压条件下YL001菌体生长代谢旺盛,菌体生长量在NaCl质量浓度为0,5 g/L时与40 g/L时相比分别提高了2.00,1.95倍,甲醇提取物中Nematophin的含量分别提高7.82,5.39倍,XCN1相对含量则分别提高27.55,21.66倍,因此推测,低渗透压条件下发酵液抑菌活性较高可能与菌体生长旺盛引起抑菌活性物质Nematophin及XCN1的产量增加有关,高渗透压条件下则相反。
在昆虫血淋巴高渗透压环境中除含有较高的盐度外,还含有较高的溶质浓度,如醇类、氨基酸类、糖类等,菌体可能通过在胞内大量积累这些物质,调节其对高渗透压的适应性与耐受性[14]。有研究表明,嗜线虫致病杆菌能在胞内积累L-脯氨酸来缓解高渗透压带来的不适,并能增强菌体代谢产物产生,从而使菌体保持较高的致病力[9]。对嗜线虫致病杆菌YL001来讲,其是否能通过利用上述高浓度的溶质来应对高渗透压环境及提高代谢物的产生仍需进一步研究。

