太湖贡湖湾水体中微囊藻毒素的时空分布及健康风险评估
丁剑楠 ,张闪闪,武旭跃,王靖国,邹华 *
1. 江南大学环境与土木工程学院,江苏 无锡 214122;2. 江苏省水处理技术与材料协同创新中心,江苏 苏州 215009
随着全球经济的快速发展,水体富营养化已成为人类面临的重大环境问题之一(Smith,2003)。在中国,由水体富营养化引起的蓝藻水华问题尤为突出。蓝藻水华的爆发会引起水质恶化,造成巨大的社会和经济损失。其中,微囊藻(Microcystis)、颤藻(Oscillatoria)、项圈藻(Anabaenopsis)、念珠藻(Nostoc)和浮丝藻(Planktothrix)等藻类还会向水环境释放微囊藻毒素( Microcystis, MCs) (Kaebernick et al.,2001;Van Apeldoorn et al.,2007)。MCs是一类具有环状七肽结构的有机化合物,其结构稳定,不易挥发,耐高温,加热煮沸后不失活,通常以痕量形式赋存于水体中,常规的水处理技术对其处理效果十分有限(杨翠云等,2009)。
MCs能够直接破坏生物细胞结构,引发细胞溶解,诱导细胞凋亡和癌变,引起基因突变和DNA损伤(黄艺等,2013)。生态毒理研究表明,MCs会抑制微生物生长,减弱水生动物的繁殖能力,引起内分泌干扰效应,甚至导致个体死亡(Chen et al.,2016;Hou et al.,2016;杨翠云等,2009)。人体长期饮用受 MCs污染的水会对肝脏造成损伤,诱发肝癌、肠癌,并可能产生遗传毒性(王伟琴等,2010)。因此,水环境中,尤其是饮用水源地的 MCs污染问题引起了国内外学者的长期高度关注。
太湖作为中国华东地区最大的淡水湖泊以及周边居民的重要饮用水源地,其蓝藻水华问题由来已久,随之而来的 MCs污染也严重威胁着该地区的饮用水安全。2003—2013年,Shi et al.(2015)利用卫星监测对蓝藻爆发期间太湖水体(未包括贡湖湾、胥口湾和东太湖)的MCs污染状况进行了长期研究,在监测期间,太湖水体中MCs 质量浓度范围为 1.01~7.86 μg·L-1,平均达到2.97 μg·L-1,高于世界卫生组织(WHO)推荐的MCs饮用水含量标准(1.0 μg·L-1)。虽然自 2007年无锡饮用水危机爆发以来,太湖 MCs污染问题得到了有效遏制,并在 2009—2011年期间出现下降趋势,但是,从2012年起,太湖水体中MCs污染水平又出现了小幅回升,表明 MCs的污染仍是现阶段太湖水环境保护领域不容忽视的问题(Shi et al.,2015)。
目前,MCs的相关研究主要集中在生物毒性和环境赋存等方面,而基于人体健康的 MCs风险评估工作相对较少。开展 MCs污染健康风险评估能够明确其毒性、暴露程度与人体健康效应的关系,对科学实施 MCs污染的环境管理具有重要意义(黄艺等,2013)。现阶段有限的 MCs健康风险评估多是基于慢性暴露情景,在急性事件的评估中存在过高估计水污染事件危害程度的可能性(郑丙辉等,2012)。自然水体中,MCs的浓度常随水华爆发而呈周期性变化,故人群会在某一时间段面临较高的MCs急性风险。因此,在MCs的健康风险评估中,需要引入其急性毒性阈值,避免再采用现有由慢性实验得出的较严苛的标准。
贡湖湾位于太湖东北部,是无锡、苏州等周边城市的重要饮用水源地,湖体与梅梁湾直通,北部经长广溪与五里湖相连,面积 164 km2,平均水深 1.82 m。本研究以太湖贡湖湾为研究区域,开展为期一年的逐月监测,分析贡湖湾水体中MCs污染的时空分布特征,并结合急慢性毒性阈值,对其进行健康风险评估。成果可为太湖水源地的 MCs污染防治提供理论基础和技术支撑,对保障周边居民的饮用水安全具有重大意义。
1 材料与方法
1.1 仪器与试剂
多功能水质参数仪(Hanna Instruments,美国);溶解氧仪(SG6,Mettler-Toledo公司,中国);C18固相萃取小柱(500 mg,6 mL,Waters公司,美国);全自动固相萃取仪(Auto SPE-06D,Reeko公司,美国);超声波破碎仪(Biosafer900-92,赛飞有限公司,中国);酶标仪(Multiskan MK3,Thermo Scientific,美国);高速离心机(5804R,Eppendorf公司,德国);混合纤维素脂微孔滤膜(0.45 μm,海宁创伟过滤设备器材厂,中国);酶联免疫试剂盒(Beacon公司,美国);甲醇(HPLC级,沪试,中国)。
1.2 样品采集
共选定贡湖湾区域内 11个监测点进行采样分析,包括沙渚南(S1)、沙渚(S2)、锡东(S6)、金墅湾(S9)、上山(S11)等水厂取水地,以及周边主要河流长广溪(S3)、尚贤河(S4)、蠡河(S5)、望虞河(S7)、金墅港(S8)、石帆港(S10)等河口(图1)。
在 2013年 3月—2014年 2月期间,每月 15日左右进行样品采集。用有机玻璃采水器分别采集距表层约0.5 m的水样,并转移至1 L棕色广口玻璃瓶,采集的水样于 24 h内进行各指标的测定。在采样现场使用塞氏盘法测定透明度(SD),使用溶解氧仪和多功能水质参数仪测定温度、溶解氧(DO)、电导率、pH等水体理化指标。同时,采集1 L水样,并用10 mL鲁哥氏液固定水样,用于蓝藻生物量测定。
1.3 指标测定
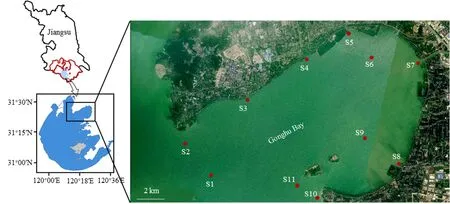
图1 贡湖湾采样点Fig. 1 Sampling sites in Gonghu Bay
采集的水样分析指标主要有:叶绿素 a(Chla)、总氮(TN)、总磷(TP)和蓝藻生物量。Chla含量采用丙酮萃取分光光度法进行测定(陈宇炜等,2000);TN含量采用碱性过硫酸钾消解紫外分光光度法进行测定(GB11894-89);TP含量采用钼酸铵分光光度法进行测定(GB 11893—89)。测定蓝藻生物量的水样经48 h静置沉淀后,利用虹吸轻轻吸掉上清液,浓缩至 50 mL,采用光学显微镜对蓝藻细胞进行鉴定、计数和体积测量,最后计算藻细胞密度和藻类生物量(藻细胞湿重)(金相灿,1990)。
对水样预处理后,采用固相萃取法(SPE)对水样中的 MCs进行萃取,并采用酶联免疫法(ELISA)测定总微囊藻毒素(TMC)和胞外微囊藻毒素(EMC)含量。具体处理方法如下:
水样预处理:取20 mL水样过0.45 μm混合纤维素酯微孔滤膜(过滤时泵压不超过 0.05 Mpa),收集滤液用于测定 EMC含量。其余的水样,按5%比例加入冰醋酸;在-20 ℃和25 ℃下反复冻融水样 3次,超声 30 min,再用高速离心机将水样离心 3次(5000 r·min-1,30 min);取离心后的上清液,用0.45 μm混合纤维素酯微孔滤膜过滤;收集滤液用于TMC含量测定。
MCs萃取:使用全自动固相萃取仪对 C18-SPE柱进行活化、上样、淋洗、洗脱收集,对收集到的溶液进行氮吹浓缩至近干,再用甲醇定容至 1 mL,待测。具体设定参数及步骤见表1。
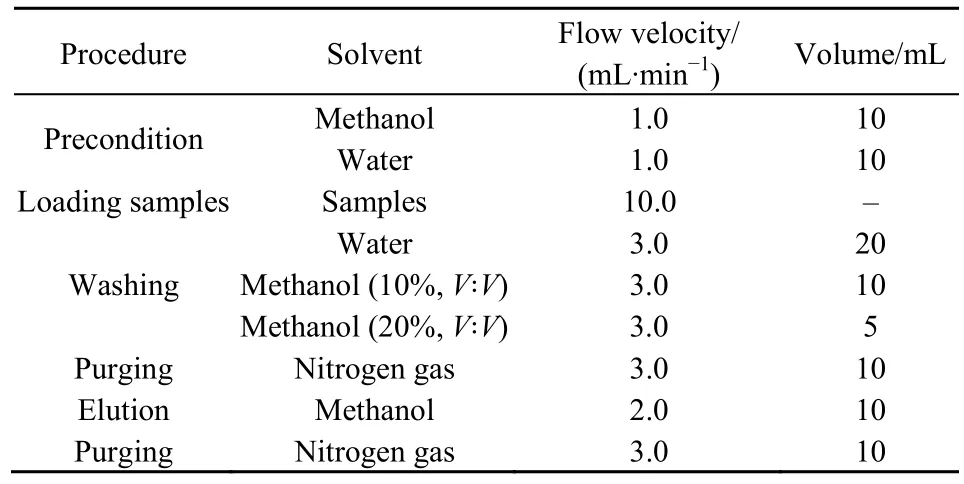
表1 MCs萃取步骤和相关参数Table 1 Procedures and relevant parameters of MCs extraction
ELISA检测:ELISA试剂盒的原理是直接竞争酶联免疫反应,通过一种单克隆抗体来识别检测MCs。按照 ELISA试剂盒使用方法加入酶标记物、标样、样品等相关试剂培育,培育完成后加入洗涤液洗去多余的未结合的抗体位点,并加入底物使其发生颜色反应至变为蓝色,蓝色越深说明MCs浓度越低,最后在450 nm波长下进行读板。
采用加标回收实验验证方法准确性。使用阴性水样 Microcystin-LR(MC-LR)标准溶液进行平行测定(n=5)。添加水平为 0.3、0.8、1.0 μg·L-1,回收率为 86%~91%,相对标准偏差为 7.3%~15.2%,结果表明该方法精确度和重现性较好。
1.4 健康风险评估
由于 MCs的致癌性研究目前尚处于探索阶段,缺乏权威可靠的数据,因此综合考虑,参照优化的美国环保局(USEPA)推荐的模型,采用风险指数法(HI)对贡湖湾水源地水质中 MCs进行非致癌健康风险评估(詹晓静等,2015)。计算公式如下:

式中,RfD为 MCs的最大暴露参考剂量,目前缺少关于MCs的RfD参考值,采用国际上公认的日耐受摄入量(TDI)进行替代(USEPA,1986),WHO推荐的 MC-LR的 TDI值为 0.04 μg·kg-1·d-1,但是尚无 Microcystin-RR(MC-RR)的参考数值,有研究认为 MC-RR的毒性参考剂量为 MC-LR的 5倍(孟元华等,2016),且 MCLR是目前已知且较为常见的藻毒素,因此本研究基于从严法则,沿用 MC-LR的毒性数据对 MCs进行风险评估;CDI为日暴露量,mg·kg-1·d-1。
饮水途径日暴露量计算方法为
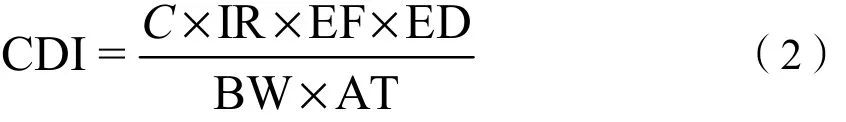
式中,C为水体污染物的浓度,μg·L-1;IR为日饮水量,L·d-1;EF为暴露频率,由于饮水是每日必须的,故暴露频率值取 365 d·a-1;ED为暴露历时,a;BW为平均体重,kg;AT为平均暴露时间(对于非致癌风险该值为 ED×365 d)。根据WHO和EPA的建议,IR取2 L·d-1,ED取30 a,BW取70 kg。
2 结果与讨论
2.1 贡湖湾水体MCs的污染特征
如图 2a所示,监测期间,贡湖湾水体的蓝藻生物量显现出较明显的空间和季节差异,其中,6月、8月在长广溪口(S3),8月、10月在尚贤河口(S4)处蓝藻生物量较高。相应地,贡湖湾水体中EMC浓度在靠近西北岸的S3、S4和S5点处较高,这可能与贡湖湾的水文气候和生态环境有关。夏季太湖地区主要为偏东南风,风速多小于 4 m·s-1,有利于微囊藻上浮并逐渐向西北部水域富集(孔繁翔等,2007);另外,贡湖湾东南部靠近苏州地区,大型水生植物较为茂盛,对水体和沉积物中磷营养盐的吸收量较大,导致沉积物中Fe/Al-P含量较低,因此当有风浪影响时,北部区域更易引起沉积物中磷的释放而导致藻类生物量的增加(章婷曦等,2007)。在7月和9月,蓝藻生物量的平均水平出现明显的低值,这可能是由于在该时段,太湖水体扰动较小,蓝藻大量浮聚在水面,水下0.5 m处采集到的蓝藻较少。

图2 贡湖湾各采样点水体中蓝藻生物量(a)、TMC(b)浓度和EMC(c)浓度月际变化Fig. 2 Monthly variations of cyanobacterial biomass (a) and concentrations of TMC (b) and EMC (c) in water of different sampling points in Gonghu Bayn=11
由图2b可知,贡湖湾水体中TMC浓度从3月起逐月上升,在9月达到极大值;另外,在 11月TMC平均浓度显著上升,达到全年监测期间的最大值(0.10 μg·L-1)。这种时间变化趋势与 Su et al.(2015)在 2013年 7月—2014年 6月期间对北太湖区域的调查结果基本一致。比较发现,MCs浓度的高值出现时间相较于蓝藻生物量高值略有滞后,可能是因为 MCs为内毒素,生理性分泌很少,只有在藻类大面积死亡,蓝藻细胞破裂后才会大量释放(Carmichael,1994)。另外,11月太湖水位较低可能是导致该时段 MCs含量较高的原因之一。EMC浓度的时间变化趋势与 TMC基本一致,同样在蓝藻生物量峰值出现一个月后显著提高,且在11月浓度较高(图2c),平均浓度达到0.07 μg·L-1。进一步证明蓝藻大面积死后向环境水体释放 MCs,以及水位降低产生的浓缩效应可能是贡湖湾水体MCs浓度升高的主要原因。
监测期间,贡湖湾水体中 TMC的平均浓度为0.06 μg·L-1,其中 8月在长广溪口(S3)水体中检测到的最高浓度(0.12 μg·L-1)低于 WHO 推荐的MCs饮用水含量标准(1.0 μg·L-1)及加拿大规定的饮用水MCs上限标准值(0.5 μg·L-1)。自2008年以来,贡湖湾水体中 MCs浓度呈下降趋势,其最高检测浓度已从 2008年的 11.68 μg·L-1降至2012 年的 0.20 μg·L-1(Wang et al.,2010;王靖国等,2014)。本研究的结果则表明,2012年之后贡湖湾 MCs赋存水平仍呈持续降低趋势。据调查,土耳其 Eğirdir湖水体中 MCs的最高浓度为13.5 μg·L-1(Gurbuz et al.,2016),而越南 Hoan Kiem 湖 MCs的最高浓度则达到了 46.0 μg·L-1(Duong et al.,2014)。Vasconcelos et al.(2010)调查了墨西哥中部各湖泊、水库中的 MCs赋存状况,发现其浓度范围高达 4.9~78.0 μg·L-1。2012年,Zhang et al.(2015)在中国最大淡水湖泊——鄱阳湖水体中检出了 MCs的广泛赋存,其最高浓度达到7.97 μg·L-1。通过比较发现,现阶段贡湖湾水体中 MCs浓度处于较低水平。然而,自然状态下 MCs在水体中降解缓慢(苏雅玲等,2013),并能在水生生物体内累积(Figueiredo et al.,2004)。不同浓度的 MCs在贡湖湾水源地是否会产生危害以及危害程度尚不明确,因此有必要针对贡湖湾水源地开展 MCs的影响因素研究和相关风险评估。
2.2 MCs赋存的影响因素
如表 2所示,贡湖湾水体中 TMC浓度与 TN含量呈极显著负相关(t=3.166,P=0.002)。Liu et al.(2008)和王靖国等(2014)对太湖的调查同样发现,水体中 MCs浓度与 N含量呈负相关关系。贡湖湾中TN含量的最高值出现在4月,此时藻类尚未大量生长繁殖,MCs浓度较低;而 8—9月 MCs污染较严重时,MCs的合成消耗了部分N,导致水体中 TN含量进一步降低。此外,夏季太湖水体中的高等水生植物生物量增多,大量 N被水生植物固定,导致水体中溶解性 TN相对较低,同样会导致溶解性 TN与蓝藻生物量和 MCs含量呈负相关。然而,Wang et al.(2010)和王经结等(2011)分别在2008年和2009年对太湖进行调查,发现MCs浓度与N含量呈显著正相关性。范亚民等(2018)在 2014年 8月对贡湖湾某水厂的水源水进行监测,同样发现了 MCs浓度与 TN呈显著正相关关系。以上结果表明,由于气候环境等因素的改变,在不同时间段和不同湖区,太湖水环境中 MCs浓度与 TN的关系并不一致。因此,针对太湖不同湖区开展长期监测,深入分析N含量对MCs赋存的影响机制十分必要。

表2 TMC浓度与环境因子的相关性Table 2 Relationship between TMC concentration and environmental factors
在本研究中,贡湖湾水体的 TMC浓度与 TP含量呈显著正相关(t=1.965,P=0.038),与氮磷比(N/P)呈极显著负相关(t=2.842,P=0.004)(表 2)。范亚民等(2018)对贡湖湾某处水源地的监测同样发现,TP与MCs浓度呈显著正相关。然而,潘晓洁等(2006)发现,滇池水体中 MCs浓度与 TP含量相关性不显著。杨柳燕等(2011)对全国 86个水生态系统调查分析发现,当水体中N/P比值小于 29时,蓝藻在浮游植物中为优势种;N/P比值小于 29时,蓝藻比重下降。本研究中,N/P与蓝藻生物量呈显著负相关,与 MCs浓度呈极显著负相关,基本符合杨柳燕等(2011)的推论,6月前贡湖湾水体中 N/P比值高于 29;在 10月,TP比水华暴发前期高,N/P比值逐步下降并且小于 29,此时蓝藻成为优势种,导致 MCs浓度增加。
贡湖湾水体中 MCs浓度与温度的相关性不显著。Johnston et al.(2003)认为,在蓝藻生长的适宜条件下,如水温较高、透明度较低、水体扰动较小,会产生较多毒素。Lehman et al.(2008)认为,低水流速度、高水温条件与微囊藻细胞密度、MCs含量、藻类 Chla等高度相关。而谢平(2008)研究发现,高温不是蓝藻水华暴发的充分必要条件,温度对其造成影响主要是通过更替藻类的优势种,并且该影响与其他因素(如N/P)共同发挥作用。通常情况下,微囊藻的最佳生长温度为 25 ℃,最适合微囊藻产毒的温度为 28 ℃,而且在不同温度下,优势藻种会有所差异,由此MCs的产量也不相同(晁建颖等,2011;吴溶等,2010),因此,温度和蓝藻生物量、MCs浓度的相关性并不显著。
2.3 贡湖湾水体MCs非致癌风险评估
本研究结合 HI风险指数模型,将 WHO推荐MC-LR 的 TDI值 0.04 μg·kg-1·d-1,WHO 建议饮用水中 MCs的质量浓度指导值(1.0 μg·L-1),以及郑丙辉等(2012)提出的 MC-LR急性暴露安全阈值(4.0 μg·L-1)代入公式,计算风险指数结果,基于从严原则,将水体 MCs风险划分为极低、低、中、高、极高5个等级(表3)。

表3 风险指数与风险程度对应关系Table 3 Corresponding relationship between HI value and risk degree
根据改进的 HI风险指数模型,结合评价标准对贡湖湾水体 MCs进行非致癌风险评估,结果如图3所示。监测期间的不同月份中,贡湖湾水体中MCs的HI风险指数范围为0.024~0.070,总体上处于极低或低风险水平,其中在11月MCs的风险指数较高(图3a)。另外,贡湖湾水体中MCs的HI风险显现出了较明显的空间差异(图 3b)。在位于贡湖湾南岸且靠近外太湖的 S10点(石帆港河口),MCs的风险指数较低,而位于贡湖湾西北岸的S3、S4、S5点显现出了相对较高的MCs非致癌风险。2008年Wang et al.(2010)检测出贡湖湾水体中MCs的最高浓度达到了11.68 μg·L-1,其HI风险指数高达8.34,呈现出极高的风险等级。比较发现,近年来贡湖湾水源地的 MCs风险得到了一定程度的缓解,但仍存在一定风险,需要继续加强监管,进一步改善水质现状。
3 结论
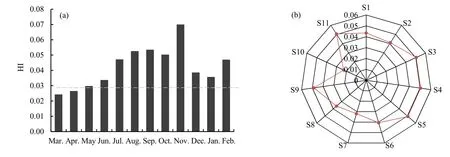
图3 贡湖湾水体MCs风险指数月际(a)和空间(b)变化Fig. 3 Monthly (a) and spatial (b) variations of HI value in water of Gonghu Bay
(1)对贡湖湾11处监测点进行1年的逐月监测,发现贡湖湾水体中的 MCs浓度整体处于较低水平,其中靠近西北岸的水体中 MCs浓度相对较高;贡湖湾水体中 MCs浓度水平具有明显的时间差异,极高值的出现较蓝藻生物量的高值略有滞后,其中 11月 MCs的平均浓度最高,TMC平均浓度达到 0.10 μg·L-1。
(2)对 MCs浓度与环境因素的相关性进行分析发现,贡湖湾水体中 MCs浓度与 N/P间具有显著的负相关性,表明N、P等营养元素的含量变化会影响贡湖湾水体中 MCs污染水平;相较之下,温度对贡湖湾水体MCs浓度水平的影响不显著。
(3)通过非致癌风险指数模型,对贡湖湾水体中 MCs进行风险评估,结果显示贡湖湾水体的MCs污染总体上处于极低或低风险水平,其中在11月风险指数相对较高;另外,靠近西北岸的S3、S4、S5点显现出了相对较高的风险等级。

