应用高效液相色谱-质谱/质谱联用技术检测贝达喹啉血药浓度
朱慧 刘忠泉 谢莉 郭少晨 王彬 付雷 陆宇
结核病是由结核分枝杆菌(MTB)引发的慢性传染病,在全球范围广泛流行,严重危害人类健康。据世界卫生组织(WHO)[1]2017年全球结核病报告,2016年世界范围内约有1040万例新发患者,估算全球耐多药和单耐利福平结核病患者约60万例,其中耐多药结核病(MDR-TB)约占82%。2016年结核病仍然排在全部死亡原因中的前10位,约有167万例死于结核病[1]。WHO估算2016年中国约有新发结核病患者89.5万例,现有抗结核药物不能满足临床治疗需求,新型抗结核药物的开发迫在眉睫。
贝达喹啉是首个被美国食品药品监督管理局(FDA)批准上市的治疗MDR-TB的药物。2016年12月,贝达喹啉在中国被批准上市。鉴于贝达喹啉有心脏QT间期延长等不良反应,WHO指南建议加强治疗期间药物不良反应检测和监管,防止贝达喹啉滥用及耐药性的产生[2-3]。对抗结核药物进行血药浓度监测(therapeutic drug monitoring,TDM),是指导临床个体化给药的较好手段,对观察药物相互作用、减少药物不良反应方面有着积极的作用[4-5]。关于贝达喹啉血药浓度的检测方法仅有国外的一篇报道,国内尚无相关报道[6]。本文针对贝达喹啉建立了快速、准确的高效液相色谱-质谱/质谱联用(HPLC-MS/MS) 检测方法,检测临床服用贝达喹啉患者的血药浓度,以便及时了解患者服药后的状况,给医生提供用药指导,从而达到提高疗效、降低不良反应的目的。
材料和方法
一、仪器与试剂
1200 型高效液相色谱系统购自美国Agilent 公司, 配备电喷雾(ESI) 离子源的G6410B 型三重串联四极杆质谱仪, 其他设备还包括Milli Q 纯水机,Mettler Teledo XS 105 型 1/10万分析天平等。贝达喹啉(上海瀚香生物科技有限公司,产品批号20150317);甲醇(美国Fisher 公司), 色谱纯(产品批号086535); 甲酸(分析纯); 水为去离子水。
二、方法
1. 对照品溶液的配制:精密称取贝达喹啉10 mg, 溶于甲醇中配制成2 mg/ml 的储备液,置-80 ℃冰箱内保存, 使用时稀释至所需浓度。
2. 高效液相色谱条件:分析柱为Agilent ZORBAX SB-C18(2.1 mm×100 mm, 3.5 μm); 柱温为 25 ℃; 流动相: 甲醇-水(含0.1% 甲酸, 5 mmol/L甲酸胺) (85∶15); 流率: 0.3 ml/min;进样量2 μl。样品分析时间为3.0 min。
3. 质谱条件:离子化方式为电喷雾电离;离子极性为正离子;检测方式采用多反应监测, 母离子和子离子分别为质荷比(m/z)555.2→58.3;质谱参数如下:毛细管电喷雾电压(capillary) 为4 kV, 去溶剂气温度为 350 ℃,去溶剂气体流率为10 L/min, 碰撞能(collision energy) 为80 eV。
4. 样品处理方法及质控样制备:健康人空白血浆室温解冻后, 精密量取90 μl, 加入贝达喹啉对照品储备液至总体积100 μl,制成终浓度0.1、0.2、0.5、1.0、2.0、5.0 μg/ml的含药血浆。旋涡混匀后加入乙腈溶液200 μl,旋涡振荡混匀后,4 ℃,离心力13 800×g离心10 min,取上清液置于进样瓶中,进样2 μl 检测。采用同样的方法每日配制浓度为0.2、1.0、4.0 μg/ml的贝达喹啉含药血浆各5份,连续3 d,作为低、中、高浓度的质量控制样品,用以考察方法学的各项指标。
5. 样品稳定性考察:(1) 室温放置稳定性考察,取低、中、高浓度样品(0.2、1.0、4.0 μg/ml)各3份, 室温下放置4 h 后, 按方法项4处理、检测。(2)冻融稳定性考察,取低、中、高浓度样品(0.2、1.0、4.0 μg/ml), 冻存于-80 ℃冰箱内, 取出后室温自然解冻; 再冷冻12~24 h, 重复循环2次, 得到3次冻融样品, 按方法项4处理、检测。(3)处理后样品放置稳定性考察,取低、中、高浓度样品(0.2、1.0、4.0 μg/ml),按方法项4处理后, 室温放置4 h 后再次检测, 4 ℃放置24 h后再次检测。(4)长期冻存稳定性考察,取低、中、高浓度样品(0.2、1.0、4.0 μg/ml),-80 ℃冰箱内保存1周,2周后按方法项4加入乙腈沉淀蛋白后离心,取上清进行检测。
三、结核病患者血样采集及前处理
对已入组“中国国家卫生和计划生育委员会-比尔及梅琳达·盖茨基金会结核病防治合作项目”的12例结核病患者进行血药浓度检测,患者来源于北京胸科医院,服用贝达喹啉的剂量均为2周内,每日1次,每次400 mg;2周后,1周3次,每次200 mg,口服。签署知情同意书后,患者于服药5 h后采集静脉血2 ml(峰浓度),服药前采集静脉血2 ml(谷浓度),两种剂量各采集峰浓度和谷浓度血样一次。血样在4 ℃条件下,1348×g离心15 min,取上清100 μl 加入乙腈溶液200 μl;旋涡振荡混匀后,在4 ℃ 条件下,13 800×g离心10 min,取上清液置于进样瓶中,进样2 μl 检测。
结 果
一、检测方法的特异性
空白血浆加入对照品的色谱图见图1。在本研究的测定条件下,采用高效LC-MS/MS联用方法分析人血浆中贝达喹啉的浓度,其出峰时间为1.9 min 左右,6份人空白血浆来源于6名健康志愿者。图1显示,在贝达喹啉出峰处没有吸收峰,说明空白血浆中没有杂质对贝达喹啉的分离测定造成干扰。贝达喹啉分子结构及定量子离子结构见图2, 母离子和定量子离子为m/z555.2→58.3。
二、标准曲线的建立
按照方法项4,配制标准曲线样品。以药物浓度(X)为横坐标, 药物峰面积(Y)为纵坐标, 进行加权回归, 得回归方程, 绘制标准曲线。考察3 d 内3条标准曲线,r均大于0.99, 1/X加权。贝达喹啉典型标准曲线方程为:
Y=166 617.845 806X-340.413 190r=0.998
在0.1~5.0 μg/mlY与X呈良好线性关系。
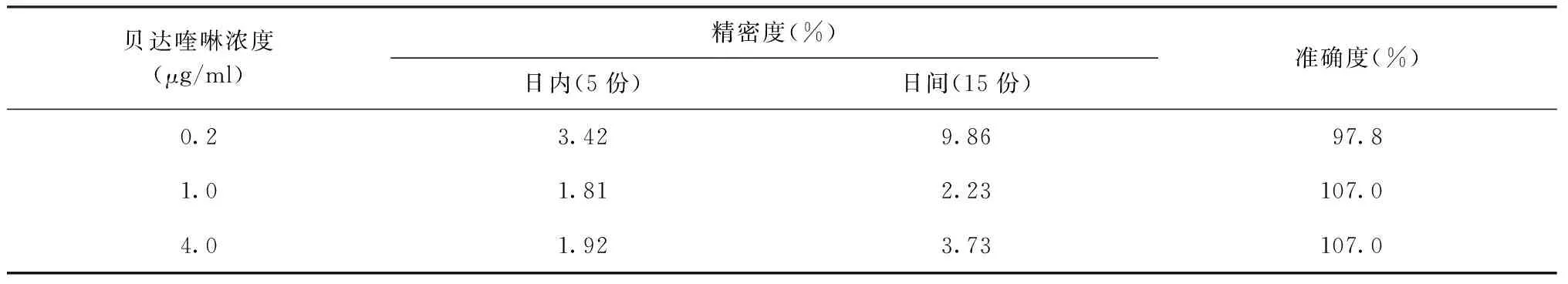
三、 HPLC-MS/MS检测方法的精密度及准确度
相对标准偏差(RSD)=标准偏差(SD)/计算结果的算术平均值,表1中日内精密度是5次测量结果的RSD,日间精密度是15次测量结果的RSD,准确度=测量值/理论值。取方法项4配制的低、中、高浓度的质控样品, 每浓度制作3个分析批,每一浓度每批5个样品,日内平行测定5次,计算日内精密度;连测3 d,计算日间精密度。结果见表1。

图1 空白血浆和含贝达喹啉(1.0 μg/ml)的血浆色谱图

图2 贝达喹啉的分子结构和定量离子结构
贝达喹啉浓度(μg/ml)精密度(%)日内(5份)日间(15份)准确度(%)0.23.429.8697.81.01.812.23107.04.01.923.73107.0

表2 不同条件下HPLC-MS/MS检测3种浓度贝达喹啉的稳定性

表3 不同检测指标采用HPLC-MS/MS检测3种浓度贝达喹啉的效果
上述稳定性结果见表2, 在本研究考察的各种储存条件下, 储存样品的测定值与理论值之间的偏差均符合要求(RSD小于10%,则符合要求), 说明样品在这些条件下的稳定性良好。
四、 储备液稳定性
用新配制的对照品溶液配制标准曲线, 外标法考察30 d 前配制的对照品储备液(- 80 ℃保存), RSD小于10%,准确度在±15%以内,符合要求,说明贮备液在30 d 内保持稳定。
五、基质效应
分别配制对照品低、中、高浓度(0.2、1.0、4.0 μg/ml)各3 份。分别用3种方法制备(1、2、3组),1组用流动相加入不同浓度贝达喹啉溶液配制,2组是用空白血浆加入2 倍体积乙腈沉淀蛋白后, 离心取上清(13 800×g离心10 min,同方法项4),再加入不同浓度贝达喹啉溶液后制得。3组是用空白血浆加入不同浓度贝达喹啉, 乙腈沉淀蛋白后, 离心取上清制得(13 800×g离心10 min,同方法项4)。将1、2、3组的响应值分别用A、B、C表示,则基质效应=100%×B/A,萃取回收率=100%×C/B,方法效率=100%×C/A,结果见表3。
六、结核病患者血药浓度的检测
对12例患者稳态后的峰浓度(服药后5 h)和谷浓度(服药前)进行检测。当服用400 mg,每日一次时,峰浓度为(3.17±1.14) μg/ml(1.48~4.82 μg/ml),谷浓度为(1.12±0.64) μg/ml(0.22~2.32 μg/ml);当剂量为200 mg,每周3次时,峰浓度为(2.01±0.87) μg/ml(0.70~3.97 μg/ml),谷浓度为(0.65±0.30) μg/ml(0.19~1.12 μg/ml)。
讨 论
贝达喹啉是近50年来第一个上市的抗结核新药,属二芳基喹啉类药物,它通过抑制结核分枝杆菌三磷酸腺苷(ATP)合成酶而发挥抗结核治疗作用,尤其在MDR-TB和广泛耐药结核病的治疗中,贝达喹啉的重要地位日益凸显[7-10]。自2013年WHO发布贝达喹啉可用于治疗MDR-TB患者的暂行策略指导方案后,至少在46个国家用于MDR-TB患者的治疗,数篇报道结果显示,含贝达喹啉的治疗方案可获得良好的疗效,提高痰结核分枝杆菌培养阴转率[11-14]。
2016年12月,我国国家食品药品监督管理总局批准将富马酸贝达喹啉片作为联合治疗的一部分,用于成人(≥18岁)耐多药肺结核的治疗。贝达喹啉可使患者QT间期延长且有肝毒性,该产品说明书中黑框警告,警示患者和卫生保健专业人员该药物可能影响心电活动,可能导致异常和潜在的致命心脏节律。WHO指南建议首剂服药后2周进行相关监测,此后每月监测1次,直至1年;这就需要建立快速、便捷的检测方法,对临床患者的血药浓度进行治疗监测。
贝达喹啉结构中含有溴,早期有报道使用高效液相色谱-电感耦合等离子体质谱法对其进行检测[15-17]。Douša 等[18]用手性柱和紫外检测器分析了贝达喹啉手性结构。而贝达喹啉的HPLC-MS/MS检测方法,国内尚无报道。本实验室配备AB 4000 QTRAP液质联用仪及Agilent 1200-6410B 液质联用仪,及多种C18分析柱,经多次预实验,优化峰形及出峰时间,最终确定使用Agilent 1200-6410B液质联用系统,ZORBAX SB-C18柱用于本实验方法学的建立,标准曲线范围参考文献报道。本实验需要样本量较少,仅100 μl血浆即可完成数次检测,且血浆样本使用了简便的溶剂沉淀去蛋白法;文献[6]中使用去离子水-乙腈和缓冲液(含乙酸铵、乙酸和三氟乙酸)作为流动相的梯度洗脱法,本研究使用了相对便宜的甲醇溶液取代乙腈,也未加入三氟乙酸,更方便经济;进样量2 μl也小于文献的5 μl;稳定性考察进样器室温即可,不用10 ℃控温。采用本色谱法测定人血浆中贝达喹啉,其出峰时间为1.9 min左右,可以快速检测大批量样本,适用于贝达喹啉的临床监测及药代动力学研究。
“中国国家卫生和计划生育委员会-比尔及梅琳达·盖茨基金会结核病防治合作项目”在中国实施“抗结核新药引入和保护机制项目”(NDIP项目),项目在我国第一批6家医院、第二批10家医院使用富马酸贝达喹啉全球捐赠项目的药品。2018年2月24日,该项目第1例患者在北京胸科医院纳入。笔者对北京胸科医院NDIP项目中患者贝达喹啉的血药浓度进行了监测,目前临床入组12例均进行检测,共48份标本,检测结果均在标准曲线范围内,检测方法应用良好。当每日服用贝达喹啉400 mg剂量时,5 h后血药浓度最高可达4.82 μg/ml,谷浓度则在0.22 μg/ml~2.32 μg/ml间。由此可见,不同患者个体间差异较大,需要对临床服用贝达喹啉的患者进行血药浓度监测,对血药浓度明显增高的患者密切关注不良反应,对血药浓度低下的患者可建议医生调整给药剂量。
本研究建立了贝达喹啉单一药物的检测方法,后期可以通过分析贝达喹啉的常用给药方案,建立贝达喹啉和其他抗结核药物的联合检测方法,以获取更多的信息。随着项目纳入患者例数的增多,可获取更多样本开展监测,将获得更多的数据并结合疗效分析,为贝达喹啉的临床应用提供更多的参考。
综上所述,本研究建立了人血浆中贝达喹啉的快速、便捷的HPLC-MS/MS检测方法,可用于临床服用贝达喹啉的结核病患者的血药浓度监测及药代动力学研究。此外,本研究也是首次报道服用贝达喹啉患者的血药峰浓度、谷浓度,可为临床上贝达喹啉的应用提供一定参考。
由笔者目前的研究结果来看,患者的个体差异较大,虽然目前入组患者例数不多,但年龄、性别分布有一定代表性。随着入组患者例数的增加,方法若有不完善处,在后续试验中应加以完善。此方法能满足目前临床研究的需要。

