苦碟子中对香豆酰转移酶基因克隆分析与功能验证
李天真 周威 殷华 张同存 刘涛
(1. 天津科技大学,天津 300457;2. 中国科学院天津工业生物技术研究所,天津 300308)
苦碟子又名苦荬菜,学名抱茎苦荬菜(Ixeris sonchifoliaHance),为菊科苦荬菜属草本植物,主要分布于我国北部、东部地区。苦碟子干燥全草可入药,味苦、辛、性寒,具有清热解毒、活血化瘀及排脓止痛之功效[1]。苦碟子注射液是以苦碟子为原料提取精制而成的静脉注射液,具有多种药理功效,如抗血小板聚集,抑制血栓形成,降低血管阻力等作用。苦碟子注射液的化学成分复杂,含有酚酸类、黄酮类、核苷类和倍半萜内酯类等多种化合物[2-4],其中酚酸类化合物有绿原酸和二咖啡酰奎尼酸等[5-7]。由于酚酸类化合物具有酚羟基或苯烯结构,具有广泛的生理活性(如抗氧化[8]、抗紫外线[9]、抗肿瘤作用[10]、抑菌[11]等),在食品、医药、化妆品原料方面有着广泛的用途[12-13]。因此,植物体内的酚酸类化合物生物合成受到广泛的研究。
绿原酸(Chlorogenic acid),化学名3-O-咖啡酰奎尼酸(3-O-caffeoylquinic acid),是一种新型的抗氧化剂,在食品和医药领域都有广泛用途。目前已报道植物中绿原酸生物合成途径存在3种:(1)香豆酰辅酶A作为酰基供体,在对香豆酰转移酶(HQT或者HCT)的催化作用下与奎尼酸缩合生成香豆酰奎尼酸,进而在香豆酸-3-羟化酶作用下生成绿原酸;(2)酰基供体为咖啡酰葡萄糖苷,其经丝氨酸羧肽酶(SCPL)的作用下与奎尼酸缩合生成绿原酸;(3)对香豆酰转移酶(HCT)催化莽草酸与香豆酰辅酶A合成香豆酰莽草酸,进而在香豆酸-3-羟化酶作用下生成咖啡酰莽草酸。对香豆酰转移酶(HCT)催化咖啡酰辅酶A与奎尼酸合成绿原酸。在途径1和3中,对香豆酰转移酶(HCT)是绿原酸生物合成的关键酶,属于BAHD酰基转移酶家族,该酶类的氨基酸序列具有两个高度保守的催化活性区域“HXXXDG”和“DFGWG”。目前在多种植物中都有HCT酰基转移酶的报道,如Lellemand等[14]从中果咖啡(Coffea canephora)中扩增得到HCT基因;Legrand等[15]从菊苣(Cichorium intybus)中获得两条HCT酰基转移酶,并证明具有在植物体中催化绿原酸合成的活性。此外,在金银花[16]、朝鲜蓟[17]等多种植物中也有HCT酰基转移酶的报道。
目前,苦碟子中HCT酰基转移酶类尚未见报道。为研究苦碟子中酚酸类化合物的生物合成及关键基因功能鉴定,本研究对苦碟子叶片转录组进行了高通量测序,并结合生物信息学分析以及RT-PCR技术,得到一条HCT全长基因。通过氨基酸序列比对和系统发育分析,对其氨基酸特点进行分析。在大肠杆菌中对该基因与对香豆酰辅酶A连接酶(At4CL)进行共表达,并通过饲喂前体物咖啡酸和奎尼酸实现了绿原酸的合成,证明该酶为HCT酰基转移酶。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 本实验室保存的菌株大肠杆菌transT1用于质粒的扩增及基因克隆,大肠杆菌BL21(DE3)用于蛋白的过表达及绿原酸的合成。质粒pET28a与质粒pCDFDuet购于Novagen公司。
1.1.2 植物材料 本实验所用苦碟子为温室培育3个月的幼苗,选取3个月以上的叶片作为实验材料,置于液氮速冻后,于-80℃保存备用。苦碟子转录组数据及总 RNA 的抽提是由华大公司完成。
1.1.3 试剂及培养基 KOD-plus-New高保真DNA聚合酶购自东洋坊生物科技有限公司;限制性内切酶NcoⅠ、Hind Ⅲ、BamHⅠ购自Fermentas公司;反转录试剂盒购自TransGen Biotech公司;T4连接酶购自TaKaRa Biotechnology公司;异丙基-β-D-硫代半乳糖苷(IPTG)购自北京索莱宝生物科技有限公司;咖啡酸、奎尼酸购自天津希恩思化学试剂有限公司。
LB培养基:酵母粉5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L,用于质粒的构建、扩增、种子液的准备;M9Y培养基:酵母粉0.5 g/L,磷酸氢二钠12.8 g/L,磷酸氢二钾3 g/L,NaCl 0.5 g/L,氯化铵1 g/L,葡萄糖2 g/L,硫酸镁2 mmol/L,氯化钙0.1 mmol/L。适量的抗生素:链霉素 200 μg/mL,卡那霉素50 μg/mL。
1.2 方法
1.2.1 cDNA的合成及基因PCR扩增 以1 μg苦碟子总RNA为模板,以Oligo(dT)18为引物,按TransScript反转录酶说明书所述反应条件,合成单链cDNA。取1 μL反转录产物,在50 μL体系中进行目的基因的PCR扩增。IsHCT的引物为IsHCT-5FNcoⅠ:CATGCCATGGGAAGTGATCAGAAGATG ATGATG(下划线为NcoⅠ酶切位点);IsHCT-3RHind Ⅲ:CCCAAGCTTTTACAATTCATACAAAAA CTTCTC(下划线为Hind Ⅲ酶切位点)。PCR条件为:94℃预变性2 min,98℃变性10 s,58℃复性30 s,68℃延伸1.5 min,共30个循环,最后72℃延伸10 min,凝胶电泳回收目的片段。
At4CL(GenBank:KX817185.1)来自植物拟南芥(Arabidopsis thaliana),以拟南芥全长cDNA为模板,PCR引物为At4CL-5F-NcoⅠ:AAAACCATGGCGCCACAAGAACAAGCAG( 下 划 线为NcoⅠ 酶 切 位 点 )At4CL-3R-BamH I:AAAAGGATCCTCACAATCC-ATTTGCTAG(下划线为BamHⅠ酶切位点),PCR条件同上,凝胶电泳回收目的片段。
1.2.2 载体构建 pET28a质粒和IsHCT分别用NcoⅠ和Hind Ⅲ双酶切,载体和基因片段通过琼脂糖凝胶电泳回收,用T4 DNA连接酶对载体和片段进行连接,转化大肠杆菌transT1,获得重组载体pET28a-IsHCT。pCDFDuet质粒和At4CL分别用NcoⅠ和BamH I双酶切,载体和基因片段通过琼脂糖凝胶电泳回收,用T4 DNA连接酶对载体和片段进行连接,转化大肠杆菌transT1,获得重组载体pCDFDuet-At4CL。
1.2.3 重组菌构建 将载体pET28a-IsHCT和pET28a分别转化至大肠杆菌BL21(DE3),获得重组菌BL21(DE3)/IsHCT和 BL21(DE3)/W 用 于 蛋白表达。将载体pET28a-IsHCT与载体pCDFDuet-At4CL共同转化至大肠杆菌BL21(DE3),获得重组菌BL21(DE3)/IsHCT-At4CL。再将载体pET28a和pCDFDuet共同转化至大肠杆菌BL21(DE3),获得重组菌BL21(DE3)/WW,作为对照菌株,用于发酵培养。
1.2.4 SDS-PAGE检测蛋白表达 分别挑取重组菌BL21(DE3)/W和BL21(DE3)/IsHCT的单克隆于5 mL液体LB中,37℃过夜培养;按体积比为1∶50转接至50 mL液体LB培养基中,37℃培养至OD600为0.6-0.8,加入终浓度0.5 mmol/L的IPTG于30℃进行蛋白诱导6-8 h后,收集菌液2 mL,12 000 r/min离心10 min;加入1 mL的50 mmol/L Tris HCL缓冲液(pH 7.4)重悬菌体,取40 μL重悬液于1.5 mL离心管中,加入10 μL的5×loading buffer,沸水浴10 min,12 000 r/min 离心 10 min,上样量 5 μL。
1.2.5 重组菌发酵培养 挑取重组菌BL21(DE3)/IsHCT-At4CL和BL21(DE3)/MM菌株单克隆于5 mL液体LB中,37℃过夜培养;按体积比为1∶50转接至50 mL液体LB培养基中,37℃培养至OD600为0.6-0.8,加入终浓度0.5 mmol/L的IPTG于16℃进行蛋白诱导12 h,收集菌体于50 mL离心管中,4 000 r/min离心10 min,更换M9Y培养基,同时在培养基中添加2 mmol/L的咖啡酸和2 mmol/L的奎尼酸,30℃培养24 h,取上清进行HPLC检测。
1.2.6 绿原酸的HPLC和LC-MS分析鉴定 取1 mL发酵液,12 000 r/min离心10 min,收集上清。HPLC检测系统是岛津液相色谱仪;检测条件为:HPLC流动相A = 水(含0.1%甲酸),B = 甲醇;流速 = 1 mL/min,溶液配比为等浓度梯度,洗脱条件:0-25 min 80% A和20% B;25-30 min 100% B;31-40 min 80% A 和20% B。进样量20 μL;液相色谱柱为 Agela Innoval MP C18柱(4.6×250 mm);UV检测波长为310 nm。
LC-MS检测:配有紫外检测器的安捷伦1260系统和配有ESI离子源探针的bruker microQ-TOFⅡ质谱仪。检测条件包括:Agela Innoval MP C18柱(4.6×250 mm);UV检测波长为310 nm;流动相A= 水(含0.1%甲酸),B = 甲醇;流速 = 1 mL/min,溶液配比为等浓度梯度,洗脱条件:0-25 min 80%A 和 20% B;25-30 min 100% B;31-40 min 80% A和20% B。进样量20 μL;ESI正离子源,分子量扫描范围50-800。

图1 IsHCT基因扩增片段凝胶电泳
2 结果
2.1 IsHCT基因的克隆
通过苦碟子的转录组数据分析,发现一条HCT基因序列,该基因具有完整编码区的转录本,长度为1 320 bp,根据该ORF的序列设计基因的扩增引物,用RT-PCR方法扩增获得了完整基因(图1),命名为IsHCT基因(GenBank:MH151086)。

图2 IsHCT氨基酸序列分析
2.2 IsHCT蛋白序列分析
IsHCT与已报道的对香豆酰转移酶,包括来源菊苣(Cichorium intybus)中的 CiHCT(ANN12610.1)、金银花(Lonicera japonica)中的 LjHCT(AFS68800.1)、桔 梗(Platycodon grandiflorus) 中 的 PgHCT(AEM63676.1)、刺苞菜蓟(Cynara cardunculus var.Scolymus) 中 的 CsHQT(ACJ23164.1) 和 烟 草 中(Nicotiana tabacum L.)的 NtHCT(XP_016484287.1),进行氨基酸序列比对,发现该酶含有BAHD酰基转移酶保守序列 HXXXDG 和 DFGWG(图2)。
2.3 IsHCT蛋白序列同源性及系统发育分析
利用NCBI数据库对IsHCT氨基酸序列进行同源比对,结果(图3)显示,IsHCT的氨基酸序列与菊苣中的 CiHCT(ANN12611.1)的序列同源性高达95%。通过 MEGA5.10软件构建系统进化树,发现IsHCT与菊苣的CiHCT遗传距离最近,二者聚为一小支。
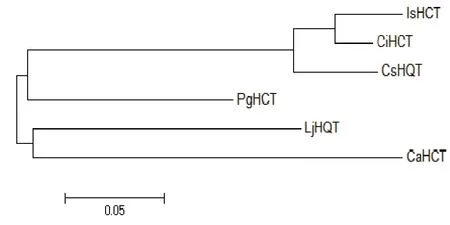
图3 IsHCT基因系统发育分析
2.4 载体pET28-IsHCT的构建和验证
将扩增的IsHCT分别用NcoⅠ和HindⅢ双酶切,同时对载体pET28用相同的酶酶切,将IsHCT片段插入到载体pET28a中得到重组载体pET28a-IsHCT(图4-B)。对重组载体用NcoⅠ,Hind Ⅲ酶切验证,pET28a-IsHCT得到大小为1.3 kb和5.3 kb的两条带(图4-A),与理论条带大小一致,并送金唯智公司进行测序验证。
2.5 蛋白IsHCT SDS-PAGE分析
菌株BL21(DE3)/W和BL21(DE3)/IsHCT按照1.2.4的方法进行培养并诱导蛋白表达,通过对其全细胞蛋白SDS-PAGE分析发现,蛋白大小为48.27 kD(图 5)。
2.6 大肠杆菌发酵菌株的构建
将载体pET28a-IsHCT与pCDF-At4CL共转入到大肠杆菌 BL21(DE3)中,得到重组菌株BL21(DE3)/IsHCT-At4CL。并将载体 pET28a和pCDFDuet 转入BL21(DE3)作为上述菌株的对照菌株BL21(DE3)/WW。对重组菌进行两步法发酵,并在第二步转换M9Y培养基时向培养基中添加咖啡酸和奎尼酸。本研究中所构建的绿原酸在大肠杆菌中的合成途径如图6所示。
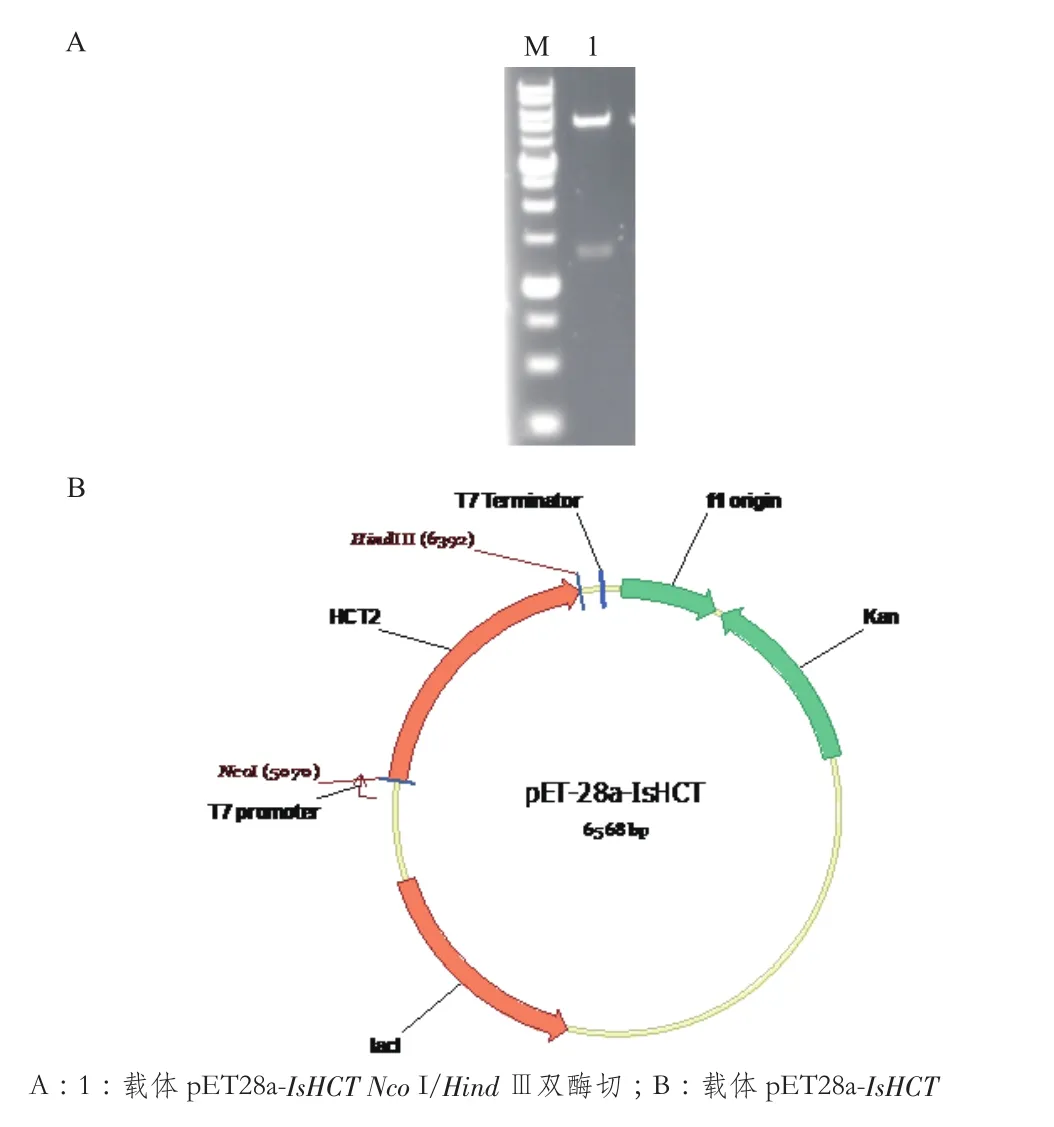
图4 载体pET28a-IsHCT的构建
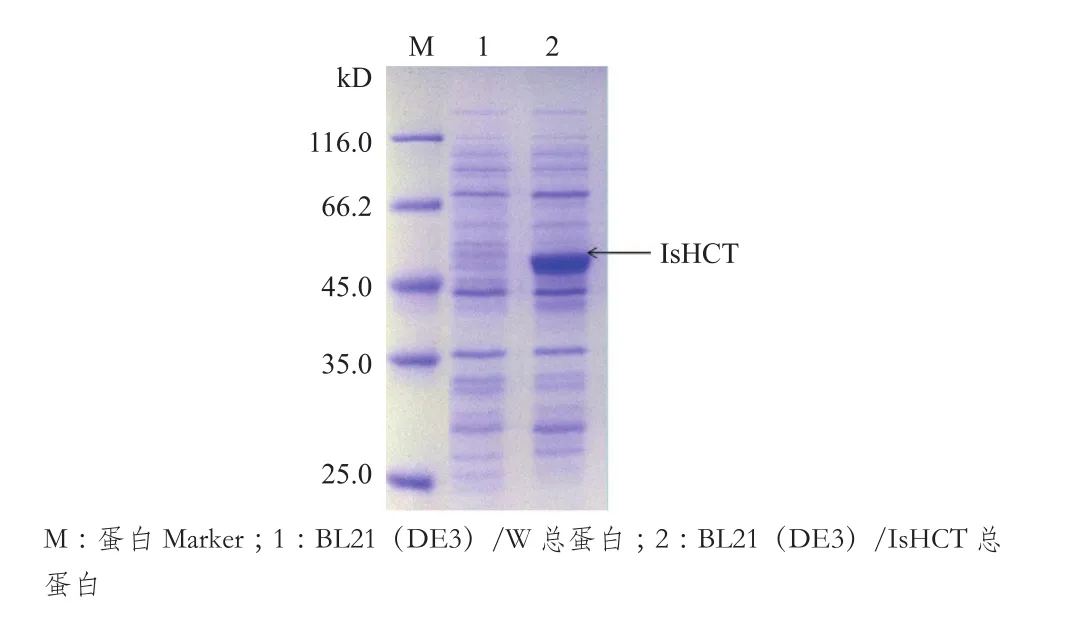
图5 BL21(DE3)/W与BL21(DE3)/IsHCT的SDSPAGE检测图
2.7 绿原酸HPLC检测及LC-MS鉴定
取24 h的发酵液进行HPLC检测,在16 min处有新化合物的产生,与绿原酸标准品的峰保留时间(Rt)一致(图7-A)。绿原酸的分子量为354,LC-MS检测结果显示16 min峰的[M+H]+= 355,确定该峰对应的化合物为绿原酸(图7-B)。
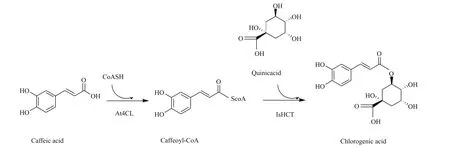
图6 绿原酸的合成途径
3 讨论
苦碟子中含有多种酚酸类化合物,如绿原酸、单咖啡酰酒石酸、菊苣酸等,但是这些化合物在苦碟子中的分子机制尚有待深入研究。本研究在对苦碟子转录组分析的基础上,筛选出一条HCT基因。该基因序列长1 320 bp,编码439个氨基酸。系统进化分析得出其与菊苣CiHCT同源性高达95%,其次与CsHQT同源性也很高,且IsHCT与CiHCT、CsHQT聚为一大分支。据文献报道,CiHCT参与了菊苣植物体内的绿原酸的合成[15],推测出IsHCT很有可能是参与了苦碟子中绿原酸等酚酸类物质合成的重要功能基因。
HCT作为植物体苯丙素类化合物合成途径的关键酶,在植物体次生代谢物(酚酸类化合物、木质素、黄酮类物质等)合成过程及代谢物量的平衡中起着重要作用[18]。有研究表明,降低植物中HCT基因的表达量,对香豆酰辅酶A则更多的被查尔酮合酶催化生成黄酮类物质[19]。此外,HCT不仅可以催化咖啡酰辅酶A与奎尼酸合成绿原酸,还可以逆向催化绿原酸生成咖啡酰辅酶A与奎尼酸,从而促使更多底物用于木质素的合成[20]。本研究获得了苦碟子中的IsHCT序列,通过体内酶实验,验证了IsHCT具有香豆酰转移酶功能,能催化绿原酸的合成,为苦碟子中绿原酸的合成研究及其在苦碟子中次级代谢物间的调控机制研究奠定重要的基础。后续研究可以通过调控IsHCT基因的表达等进而调控苦碟子中绿原酸的含量,对提高苦碟子药材的品质具有重要意义。
4 结论
本研究从苦碟子中扩增出IsHCT基因,有酰基转移酶的保守区域HXXXDG和DFGWG,与菊苣中CiHCT基因相似性高达95%。通过IsHCT基因在大肠杆菌中过表达及前体饲喂实现了绿原酸的合成,明确了IsHCT基因具有对香豆酰转移酶功能。

