可手术胃肠道肿瘤患者血清TK1表达及其临床意义
胃肠道肿瘤是常见的恶性肿瘤,有关肿瘤指标或标志方面的研究报道文献较多,但对于细胞质胸苷激酶1(Thymidine kinase 1,TK1)的研究尚不多见。TK1与细胞的增殖有关,在DNA的合成中将胸腺嘧啶核苷转换为单磷酸胸腺嘧啶,是嘧啶补救合成途径中的关键调节酶[1]近期有研究有表明肿瘤细胞中高水平的TK1可以从细胞周期中的S期一直持续到M期,TK1的表达水平与DNA的合成具有一致性,在增殖细胞中水平升高[2],提示TK1的表达水平可以作为肿瘤细胞生长、增殖的一种标志物。研究表明TK1水平升高与多种恶性肿瘤的较差预后相关,如慢性淋巴细胞白血病、卵巢癌、乳腺癌、前列腺癌和结直肠癌等[3-5]。因此,本研究化学发光法检测65例可手术的胃肠道肿瘤患者的血清TK1表达情况,分析其与可手术胃肠道肿瘤患者临床病理特征之间的关系及其临床意义。
1 材料与方法
1.1 病例资料
本院2016年1月—2017年9月本院住院患者65例,其中胃癌29例、结直肠癌36例。均为能手术切除的病例,而将有远处转移的或不能手术切除的晚期病例均排除在外。对65例患者手术切除的大体病理标本保存的蜡块,均经病理学复查确诊明确无误,并且术前均未为化疗或放疗。其中,男40例,女25例,年龄23~82岁,平均年龄(64.02±1.82)岁。按照国际AJCC标准对患者术后进行TNM分析,其中I期24例,II期24例,III期10例,IV期7例。随访至2018年9月,随访时间为11~22个月,TK1阳性和阴性表达患者各失访1例。
本研究经过医院伦理委员会批准通过,术前均签注知情同意书。
1.2 方法
1.2.1 仪器与设备 TK1试剂盒、GIS-1型化学发光数字成像分析仪均购自华瑞同康生物技术(深圳)有限公司。所有研究工作均在本院肿瘤科实验室完成。
1.2.2 TK1测定 患者空腹抽血5 ml,30 min内高速离心,取血清备用。制备抗体稀释液、洗液、封闭液。将内含硝酸纤维素膜的膜板平放在一张干净的滤纸上,不同浓度的标准品按1号、2号、3号的顺序点样到A1、A2、A3位置上,每孔3 μl;待测血清按每孔3μl顺序点后面的膜上,室温下自然晾干。打开膜板,将膜放入反应盒内,用配置后的稀释液振摇洗膜2次,每次5 min。弃去洗涤液,加封闭液,室温下振摇封闭1 h。加一抗(TK1-IgY),4℃下过夜。弃去反应液,用洗液漂洗3次后,振摇洗涤3次,每次5 min。加而抗(生物素化抗IgY二抗),室温下振摇反应40 min,弃去反应液,用洗液漂洗3次后,振摇洗涤3次,每次5 min。加链酶亲和素-酶复合物,室温下振摇反应1 h。弃去封闭液,用洗液漂洗3次后,振摇洗涤3次,每次5 min。加ECL发光试剂,过膜浸湿,精确反应1 min。将膜放入CIS-1型化学发光成像分析系统内进行分析。上述重复3次。取3次测量值均数,测量值波动范围为(平均数±0.5)mg。
1.3 参考值
依据既往的大样本临床试验研究数据确定的血清TK1的参考值,即血清TK1水平0.0~2.0 pmol/L为正常,>2.0 pmol/L为异常[6]。
1.4 统计学方法
采用SPSS 19.0统计学软件,计量资料以(均数±标准差)表示,采用t检验;计数资料以(n,%)表示,采用χ2检验,相关分析采用Spearman进行等级相关分析,以P<0.05表示差异具有统计学意义。
2 结果
2.1 术前血清TK1表达与临床病理特点的关系
总阳性表达6例,阳性率9.23%。其中36例肠癌患者TK1阳性3例、阴性33例,而29例胃癌患者TK1阳性3例、阴性26例,两者之间比较,差异无统计学意义(χ2=0.08,P>0.05).考虑到胃癌和肠癌两者之间TK1的表达无明显差异,同时鉴于本组资料相对偏少,因此将两者合并后再进一步进行统计学分析。SPSS Pearson相关性结果表明:血清TK1的表达男性明显较多,差异有统计学意义(χ2=4.13,P<0.05),并且TK1表达与Her-2的表达呈正相关关系(r=0.746,P<0.05),而与年龄、T分期、分化程度、淋巴结转移、有无贫血之间均无相关关系。胃癌、结直肠癌患者血清TK1表达与临床特征的关系,见表1。
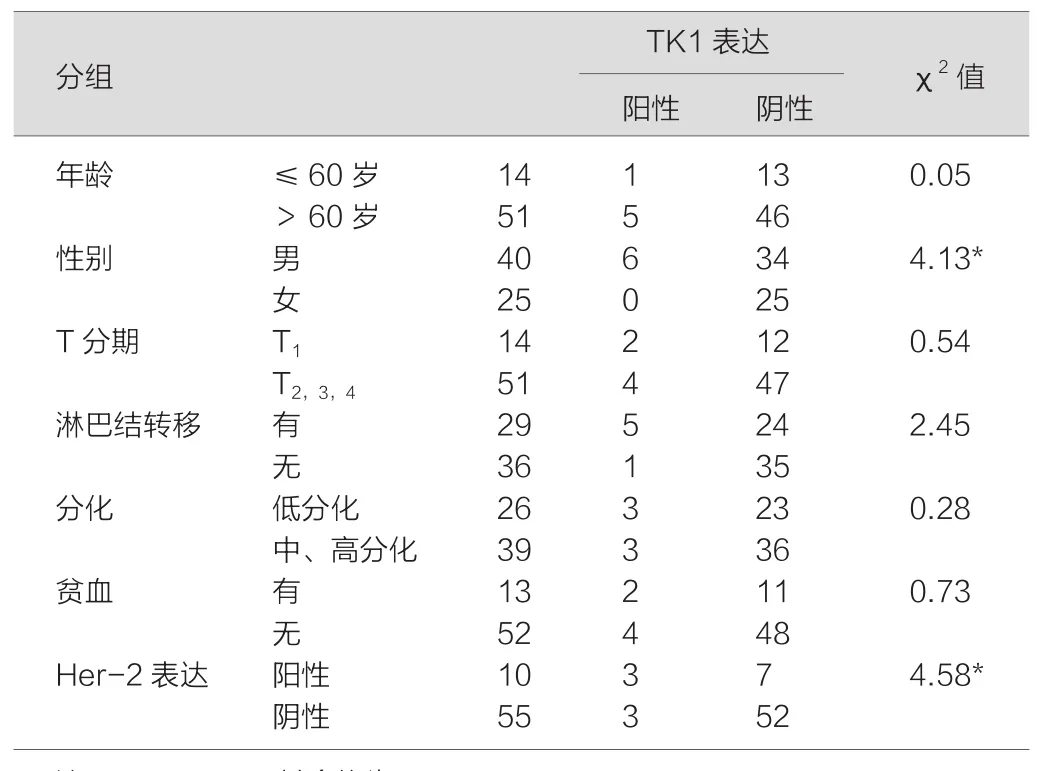
表1 胃癌、结直肠癌患者血清TK1表达与临床特征的关系
2.2 血清TK1水平与Ki-67、Hb的关系及其相关性
血清TK1表达水平与Ki-67、Hb水平的关系,见表2和表3。SPSS Pearson相关性结果表明:TK1表达阳性患者的Ki-67水平高于阴性患者,呈正相关性(r=0.396,P<0.01),而与Hb水平无相关性(r=-0.261 6,P>0.05)。

表2 TK1阳性、阴性患者Ki-67、Hb水平比较
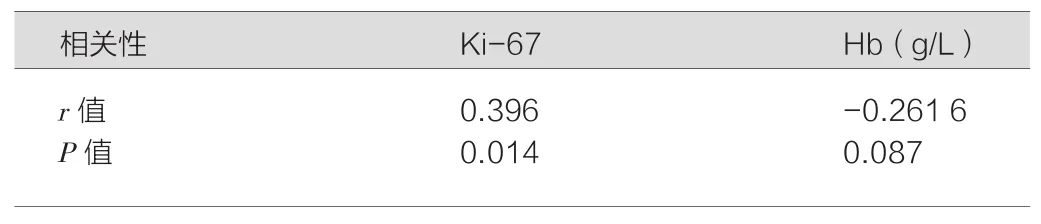
表3 血清TK1水平与Ki-67、Hb的关系及其相关性
2.3 65例患者手术前后三次血清TK1表达水平的比较
对65例患者进行了血清TK1水平共6个月的追踪随访,以动态观察其手术前后以及与化疗等治疗之间的关系,测定了3次血清TK1水平,即术前1次、术后1个月(化疗前)和术后6个月(化疗结束后)共3次。3次检测中,共有TK1阳性9例,其中术前TK1阳性6例(具体结果见表3,病例号1~6);术后1个月阳性6例,其中新增阳性3例(见表4,病例号7~9);术后6个月阳性6例,均为术前和术后1个月阳性患者,并无新增病例。

表4 术前、术后1个月、术后6个月血清TK1阳性病例情况
2.4 随访结果
随访至2018年9月,结果为:TK1阳性死亡3/6(50.0%)、存活3/6(50.00%),TK1阴性死亡5/59(8.47%)、存活54/59(91.53%),两者比较,差异具有统计学意义(χ2=6.498,P<0.01)。
3 讨论
TK1是细胞周期中S期DNA合成的关键调节酶[7],参与DNA合成和修复,与细胞增殖活动密切相关[8],在肿瘤细胞增殖过程中明显升高,近期有研究[9]表明食道癌、胃癌、结直肠癌等患者的血清TK1的阳性率高于正常对照组,并且TK1在多种恶性肿瘤中表达上调,预示着预后不良[3-5,10]。并且对于治疗有较大的价值,在肺癌、宫颈癌和肝癌等治疗中都有临床意义[11-12],表明TK1能够表示肿瘤细胞的增殖程度、因而可以判断肿瘤的恶性程度,进而可以判断肿瘤的治疗效果和预后。
本次研究结果表明TK1阳性率为9.23%(6/65),低于Bagegni等[13]TK1在结肠癌中的阳性率59.21%,出现这种现象的原因是多方面的,可能本研究入组对象均为手术患者,没有转移等IV期晚期患者,可能影响了TK1的阳性率。同时发现TK1表达与患者的T分期、淋巴结转移、分化程度等均无相关关系,与Liu MH等[14]TK1在胃癌、结肠癌和肺癌等中随着分期有增高趋势不相一致,与Miettinen等[10]在晚期非小细胞肺癌中与淋巴结转移无关的结果一致、但与其TMN分期有关的结果不一致。本研究分析选择的病种及其病情程度(即分期等)有关不完全相同有关,比如Liu MH等[14]文章中包含了肺癌等病例,而Miettinen等[10]基本为晚期病例,他们应用的是TMN分期,包括了很多有转移在内的IV期患者,而本研究中入组患者均为符合手术治疗适应证者,患者均无晚期病例或T分期者。这可能是引起结果不完全一致的主要原因。当然也不排除由于本研究样本量太小,对于确切的原因,有待于进一步深入研究。
研究发现TK1的表达与患者的性别、Her-2的表达和Ki-67的水平具有相关性。目前临床普遍认为:Her-2是胃癌的独立的不良预后因素,虽然在肠癌中的研究略少,与胃癌患者中表达结果相符。Ki-67是胃肠道肿瘤患者疾病严重程度、预后评估的重要指标,通常来说Ki-67阳性表达越高,表明肿瘤恶性程度越高,患者治疗预后越差。因此,胃肠道恶性肿瘤患者术前加强患者Ki-67表达水平能评估患者疾病严重程度,有助于指导患者手术治疗,使得患者的治疗更具科学性[11]。但是,本研究中亦存在诸多不足,一方面本研究时间及随访时间较短,可能对本研究结果产生偏差;另一方面实验中纳入的病例数较少,上需要大样本容量进一步验证。
综上所述,胃肠道癌症患者术前血清TK1的表达与Her-2表达和Ki-67表达有关。检测术前血清TK1对于指导合理治疗和判断患者的预后有一定意义。

