贻贝盐溶蛋白特性分析及其ACE抑制肽的酶法制备
乔美玲,刘汉雄,樊凤娇,涂茂林,于翠平,杜 明,*
(1.大连工业大学食品学院,国家海洋食品工程技术研究中心,辽宁 大连 116034;2.哈尔滨工业大学化工与化学学院,黑龙江 哈尔滨 150001)
贻贝(Mytilus)属软体动物门,瓣鳃纲,异柱目,贻贝族,贻贝科,俗称“海红”(北方)、“淡菜”(干品)等,其肉质鲜美,营养丰富,素有“海中鸡蛋”的美称,是人们喜爱的海产贝类,也是我国沿海常见的一种海鲜产品,在我国山东、浙江、辽宁和福建等沿海省份养殖海域广阔,主要品种为紫贻贝(M. edulis)和厚壳贻贝(M. crassitesta Lischke)。养殖贻贝生长快,纯天然,无污染,品质好,产量大[1]。根据2016年和2017年检数据表明,贻贝的产量在2015年和2016年分别为84.5万 t和87.9万 t。目前,贻贝加工除了少量加工成冻品、罐头和干品外,大都以活鲜品销售,产品较为单一,严重影响了贻贝资源的高效利用。近年来,研究人员对海洋生物尤其是贝类活性成分的研究已取得一定成果,加工企业也利用这些研究成果成功开发出相应的海洋功能食品,如牛磺酸[2]、蛋白功能食品[3]、海洋多糖[4]和多不饱和脂肪酸[5]等产品,并获得了相当好的经济效益。我国现有的相关研究主要集中在贻贝的形态、分类、初级加工和捕捞养殖等方面,国外则主要集中在贻贝的毒素[6]等方面,鲜有报道关于贻贝盐溶性蛋白酶酶解产物的血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制活性的研究[7]。因此,本研究以贻贝为原料,提取贻贝的盐溶性蛋白,并对其分子质量分布、粒度分布和热变温度进行分析,通过3 种蛋白酶酶解蛋白,评价酶解产物的ACE抑制活性。用质谱鉴定多肽的氨基酸序列,结合分子对接技术中打分分数、关键氨基酸作用位点和氢键等相互作用筛选抑制活性最高的多肽,探讨其发挥活性的机理,从而为充分利用贻贝资源,开发具有ACE抑制活性的贻贝多肽提供理论依据。
1 材料与方法
1.1 材料与试剂
贻贝采购于辽宁省大连市新长兴市场,活体运输至实验室。
ACE、胰酶、三氟乙酸(均为色谱纯) 西格玛奥德里奇贸易有限公司;胰蛋白酶 美国Ameresco生物试剂公司;中性蛋白酶 北京索莱宝科技有限公司;乙腈、甲醇 美国Spectrum化学试剂公司;甲酸 阿拉丁试剂有限公司;其他试剂均为分析纯。
1.2 仪器与设备
T25匀浆机 艾卡仪器设备有限公司;CF16RXII离心机 日立有限公司;5KDN-103F自动定氮仪、二十孔消化炉 上海纤检仪器有限公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限公司;BSA1245万分之一天平 赛多利斯科学仪器有限公司;μ-DSC微量热仪 法国塞塔拉姆仪器公司;1260高效液相色谱仪安捷伦科技有限公司;HSE-12B固相萃取仪 天津市恒奥科技发展有限公司;TTL-DC型多功能氮吹仪 北京同泰联科技发展有限公司;IMPCT反向高效液相超高解析度四极杆-飞行时间串联质谱仪 布鲁克科技有限公司;Zetasizer 3000HSA激光粒度仪 英国Malvern仪器公司。
1.3 方法
1.3.1 贻贝盐溶性蛋白的制备
将新鲜的贻贝洗净,剥壳,去足丝。沥干多余水分,剪碎,8 000 r/min匀浆。按照料液比1∶3(g/mL)加入0.05 mol/L pH 7的磷酸缓冲溶液,于4 ℃磁力搅拌30 min,8 000 r/min离心去除上清液,重复2 次,沉淀物按照料液比1∶3加入0.1 mol/L pH 7的含有2 mol/L NaCl的磷酸盐缓冲溶液,8 000 r/min离心得到的上清液即为贻贝盐溶性蛋白[8-10]。
1.3.2 贻贝盐溶性蛋白的特性分析
参考GB 5009.5—2010《食品中蛋白质的测定》第1法测定粗蛋白含量;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)测定蛋白分子质量分布;激光粒度仪测定蛋白粒度分布;μ-DSC微量热仪测定蛋白热变性温度。
1.3.3 贻贝盐溶性蛋白酶解液的制备
分别采用胰蛋白酶、中性蛋白酶和胰酶对贻贝盐溶性蛋白进行酶解。参考文献[11-13]并适当修改,确定条件分别为:温度45 ℃,pH 8.5,时间3 h,2 g/100 mL蛋白溶液;温度50 ℃,pH 7.0,时间4 h,2 g/100 mL蛋白溶液;温度40 ℃,pH 8.0,时间4 h,2 g/100 mL蛋白溶液;待pH值、温度条件到达后,按照5 000 U/g加入相应的酶,分别进行酶解。沸水浴15 min灭酶,冷却至室温后,8 000 r/min离心取上清液,真空冷冻干燥制备得到酶解多肽粉。酶解液的分子质量分布测定采用孙娜等[14]的方法。
1.3.4 贻贝盐溶性蛋白酶解液ACE抑制活性测定
贻贝多肽ACE抑制率的测定参考贾梦蛟等[15]的方法,并作适当修改。取50 μL 5 mmol/L马尿酰-组氨酰-亮氨酸(HHL)与20 μL的样品混合,于37 ℃恒温水浴5 min,加入20 μL 0.1 U/mL ACE溶液,充分混合,37 ℃恒温水浴60 min后,反应分解产生马尿酸,加入20 μL 2 mol/L HCl溶液中止反应,离心取上清液,加入进样瓶中,波长228 nm处进行检测。样品用pH 8.3、含0.3 mol/L NaCl的硼酸盐缓冲溶液配制成6 种不同的质量浓度,测定活性半抑制浓度(IC50),空白为硼酸缓冲溶液。绘制浓度-抑制率曲线,得到回归方程,通过曲线方程计算抑制率为50%时所对应的浓度值,即IC50值[16]。ACE抑制率计算如下所示:

1.3.5 酶解液多肽的前处理及质谱鉴定
酶解液通过C18小柱除去大蛋白和盐分。首先把小柱安装在固相萃取仪中,用真空泵保证其真空状态,用1 mL甲醇冲洗3 次,0.1%甲酸溶液冲洗3 次,每次1 mL,完成柱子的活化。然后加入1 mL样品,多肽附着在柱子上,用0.1%甲酸溶液冲洗3 次,达到除去大蛋白和除盐的目的。最后用80%甲醇溶液分3 次,每次500 μL收集多肽溶液。用氮气吹干溶液,得到固体多肽备用[17]。
样品上质谱前用0.1%的甲酸溶液复溶,并用1%的甲酸溶液调节pH 2~3。色谱条件为:色谱柱C18(150 mm×3 mm,3 μm,100 Å);上样量:10 μL;流动相:水相为0.1%甲酸溶液,有机相为0.1%甲酸-乙腈溶液。梯度洗脱条件:流速0.4 mL/min,0~10 min为10%有机相和90%水相,10~15 min为35%有机相和65%水相,15~30 min为50%有机相和50%水相,30~32 min为80%有机相和10%水相,32~40 min为10%有机相和90%水相[17-18]。串联质谱数据MASCOT搜库,选择双壳纲库与贻贝库(2017年3月下载于NCBI:https://www.ncbi.nlm.nih.gov/pubmed/)检测参数设置为:前体离子误差10-6,子离子误差1 u,允许2 个位点误切,假阳性率≤1%,胰蛋白酶酶解产物设置固定的酶切位点,其他参数为默认参数,在上述检索条件下所得分值有显著性意义(P<0.05)被认定为有效的鉴定结果[19]。
1.3.6 多肽分子对接及机理分析
ACE广泛分布于哺乳动物组织中并对血压起着关键的调节作用。ACE抑制肽通过抑制ACE来达到降血压的作用[20],所以多肽与ACE的相互作用效果可以表征降血压活性的强弱。本研究采用分子对接技术,模拟多肽与ACE相互作用,具体操作如下:用DS中的Build and edit protein工具输入鉴定出的多肽序列,并在Minimize Ligands中优化多肽结构,多肽命名为对接配体。另一方面连接网络从PDB数据库中找到并打开所需要的蛋白1O86(图1),在Prepare protein中优化蛋白结构,主要包括去水加氢、补全丢失的氨基酸等,并将蛋白定义为对接受体。选择CDDOCK程序将配体对接到受体中去,根据所得结果中-CDOCKER Energy值,完成ACE抑制活性多肽的初步筛选[16,20],之后结合多肽氨基酸的组成特点及相互作用力进一步筛选出较优的多肽构像,即进一步完成活性较高多肽的筛选。

图1 分子对接蛋白受体1O86Fig. 1 Molecular docking protein receptor 1O86
2 结果与分析
2.1 贻贝盐溶性蛋白基本性质

图2 贻贝盐溶性蛋白的SDS-PAGE分析Fig. 2 SDS-PAGE of salt-soluble protein from Mytilus edulis
由图2可知,贻贝盐溶性蛋白主要分布在200~250、97.2~116 kDa和小于43 kDa三部分,其所对应的蛋白种类主要为肌球蛋白重链、副肌球蛋白、肌动蛋白。盐溶性蛋白中副肌球蛋白,即泳道中颜色较深、分布在100 kDa附近的条带,所占比例较大,结果与某些鱼类和文蛤盐溶性蛋白的电泳条带分布情况基本相似[21]。
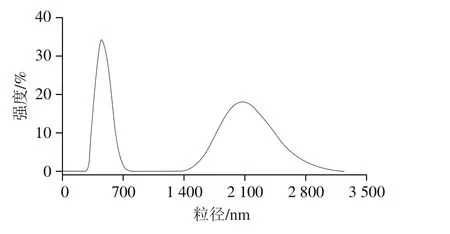
图3 贻贝盐溶性蛋白粒度分析Fig. 3 Particle size analysis of salt-soluble protein from Mytilus edulis
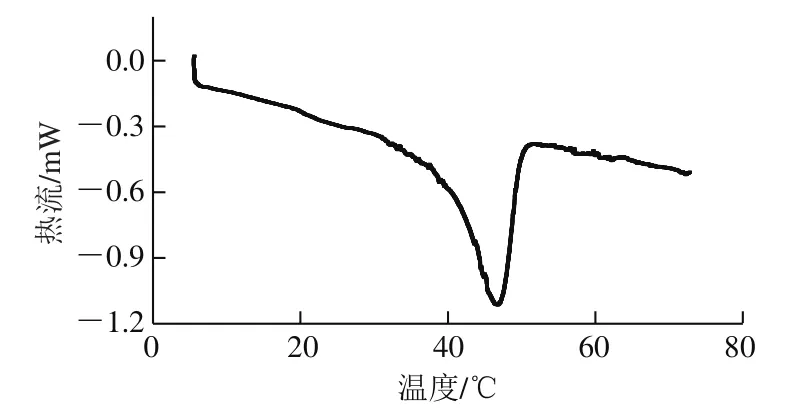
图4 贻贝盐溶性蛋白热变性温度的测定Fig. 4 Thermal denaturation temperature of salt-soluble protein
由图3可知,蛋白的粒径主要分布在两大部分,一部分为350~700 nm,另一部分为1 400~2 800 nm左右,平均粒径为572.3 nm,比鱼类蛋白平均粒径大100~250 nm[22-23],这可能与盐溶性蛋白中不同种蛋白的比例有一定的关系。盐溶性蛋白中的肌球蛋白的变性温度在40~60 ℃之间,是热稳定性较差的蛋白质[24],而同样身为盐溶性蛋白的肌动蛋白是热稳定性最强的蛋白质,其开始变性的温度为71 ℃[25],由图4可知,贻贝盐溶性蛋白的热变性温度是46.5 ℃,比文献报道[26]的41.7 ℃略高,原因可能是贻贝肌动蛋白与肌球蛋白比例比鱼的较高,所以导致蛋白整体的变性温度变高。
2.2 贻贝盐溶性蛋白酶解液中多肽分子质量分布
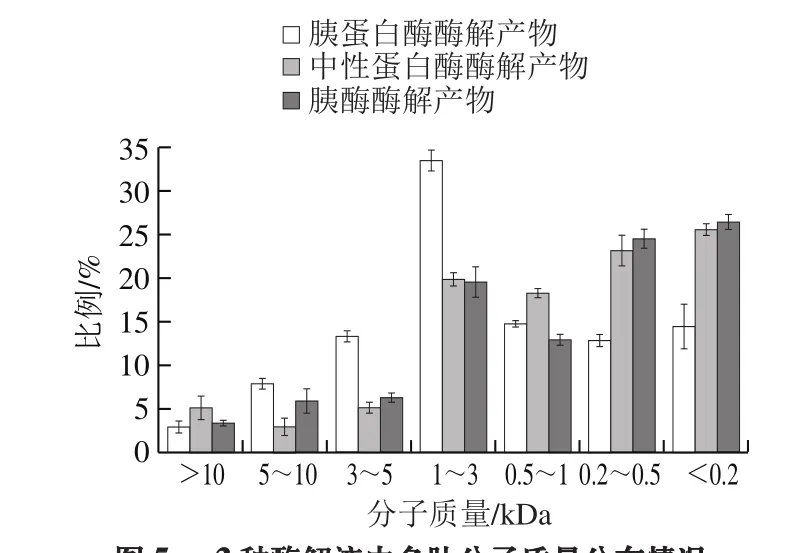
图5 3 种酶解液中多肽分子质量分布情况Fig. 5 Molecular mass distribution patterns of three hydrolysates
如图5所示,整体来说,分子质量大于5 kDa的比例较小,结合SDS-PAGE数据可知,肌原纤维蛋白大都在40 kDa以上,所以3 种酶的酶解条件的选择都较为合适,最终的酶解效果较为理想。其中分子质量在0.5~3 kDa的区间,胰蛋白酶酶解产物多肽所占比例较大,大概为47%,显著高于其他两种酶解产物,可能原因是胰蛋白酶具有特定的酶切位点,使得蛋白酶解产物较为单一,使得分布在该区域的多肽较多,比例较高。另一方面,在各自酶的最适条件下的3 种水解度分别为:11.75%、9.93%和22.16%。胰酶酶解产物的水解度显著高于其他两种,原因可能是因为胰酶是一种混合酶,多种酶一起发挥作用,使得水解度较高。
2.3 酶解物ACE抑制活性测定结果
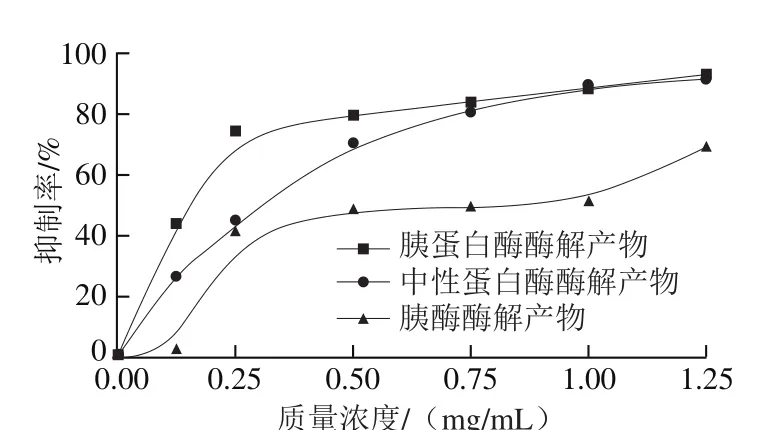
图6 3 种酶解液的ACE抑制活性Fig. 6 ACE inhibitory activities of the three hydrolysates
从图6可以看出,随着样品质量浓度的增加,抑制率都呈现上升的趋势,当到达某一质量浓度时,趋于平缓,符合一般活性趋势。但是,当质量浓度低于0.75 mg/mL时,胰蛋白酶酶解产物的抑制率始终大于其他两个样品,当大于0.75 mg/mL之后,胰蛋白酶酶解产物与中性蛋白酶酶解产物的抑制率基本相同,并且趋于平缓。胰酶酶解产物在0.5~1.0 mg/mL时,抑制率趋于平缓,为48%左右。3 种酶解产物的拟合方程为:y=16.26+177.32x-97.61x2;y=4.47+167.05x-79.37x2;y=1.73+104.27x-44.79x2。IC50值分别为215.96、321.75、637.67 μg/mL,比付金霞[27]、郝记明[28]等的1.74、1.32 mg/mL结果显著较低,故具有一定的优势。
2.4 多肽序列的鉴定及活性机理

表1 胰蛋白酶酶解多肽能量值及与ACE作用的氨基酸Table 1 -CDOCHER energy of peptides from tryptic hydrolysate and amino acid residues bound to ACE
通过质谱分析,并结合数据库比对,得到了1 600多条多肽序列。Lim等[29]报道小分子质量的多肽因为适应ACE的结合位点,所以其具有较高的活性,所以本研究挑选出不大于10 个氨基酸的多肽进行分子对接模拟,最终根据-CDOCKER Energy值的大小,初步筛选出180 分以上的多肽序列(11 条)进行下一步的分析。这些多肽序列为:GQLEISNVR、ELEDSLDSER、WIAEEADK、ADFESQIK、LEEAEAQALK、IFDAIEK、VEFLDDSNR、LYDIDVAK、SLLEHAER、AAVDDLTR、ISMLEEDIMK(表1),根据它们的分值及与多肽作用的ACE上的氨基酸,同时根据文献[30]的查阅可初步确定的活性部位氨基酸残基为His353-Ala354-Ser355-Ala356-Val380-His38-Glu384-His387-Glu411-Lys511-Phe512-His513-Val518-Tyr520-Arg522-Tyr523,11 个多肽结合的氨基酸个数分别为18、19、19、16、16、16、21、22、18、16、20,其中关键的氨基酸数目分别为11、8、10、8、6、8、10、10、8、9、10,GQLEISNVR是11 个多肽中结合关键氨基酸数目最多的,这可能就是它分值最高的部分原因。同时氢键个数的分布与-CDOCKER Energy的分数没有明显的线性关系,推测可能与其他的相互作用有一定的关系。

图7 多肽与ACE的相互作用Fig. 7 Interaction between peptides and ACE
由于ACE的C端结构域是疏水环境,所以抑制活性肽中疏水性氨基酸的含量,决定其是否具有较高的ACE抑制活性。疏水性氨基酸的数量及其在肽链上的位置则直接影响了多肽的空间结构的形成[31]。研究表明,N端为疏水性氨基酸或碱性氨基酸(除脯氨酸外),与ACE亲和力较强,抑制活性较高。WIAEEADK、ADFESQIK、LEEAEAQALK、IFDAIEK、VEFLDDSNR、LYDIDVAK、AAVDDLTR和ISMLEEDIMK这8 个多肽的N端氨基酸为疏水性氨基酸,WIAEEADK、IFDAIEK和LYDIDVAK含有4 个疏水性氨基酸;LEEAEAQALK和ISMLEEDIMK含有5 个疏水性氨基酸,含量较高,故推测其活性可能较高[32]。另一方面,氢键作用是分子间较强的作用力,对两分子间的相互作用有着极其重要的作用,已有研究[33-35]表明,多肽与ACE的相互作用模式以氢键作用为主,故本研究也对初筛的11 个多肽进行氢键数量及其位置的统计,结果分别为10、13、12、7、11、12、13、16、10、15、10,氢键位置为表1中加粗字体标识(图7绿线),有的氨基酸比如Ala354等可能具有2 个或者多个氢键,所以加粗氨基酸个数可能小于氢键个数,其中各多肽的关键氨基酸结合的氢键数目分别为5、2、7、4、3、9、6、9、5、6和5。同时由图7也可证明:绿色标识的氢键在多肽与ACE相互作用中占主导地位,其次还有碳氢键作用和亲疏水作用等,这些作用共同维持了多肽与ACE间的结合,保证多肽发挥活性作用。故综上所述,LYDIDVAK和WIAEEADK确定为ACE抑制活性较强的多肽。
3 结 论
贻贝盐溶性蛋白分子质量主要分布在40~250 kDa之间,蛋白平均粒径为572.3 nm,热变性温度为46.5 ℃。3 种蛋白酶酶解液中,胰蛋白酶酶解物IC50值最低,为215.96 μg/mL,ACE抑制活性较高。通过质谱鉴定得到胰蛋白酶酶解多肽序列,同时利用分子对接技术,推测多肽与ACE蛋白的结合情况。通过分析关键氨基酸、疏水性氨基酸和氢键结合等情况,最终推断出多肽LYDIDVAK和WIAEEADK活性较高,有望成为血管紧张素酶抑制肽。同时建立了一种快速,准确筛选贻贝盐溶性蛋白酶解物中活性多肽的方法,为贻贝产品的开发和利用提供理论基础。

