胃黏膜肥大细胞与功能性消化不良患者症状的关系研究
毋睿涵,蓝 宇△,何 凤,孟淑琴
(北京积水潭医院:1.消化内科;2.病理科,北京 100035)
消化不良通常是指上腹部出现的疼痛或不适,可同时伴有腹胀、早饱、餐后胀满感、恶心、食欲缺乏、胃灼热、呃逆和嗳气。消化不良可由很多食物、药物、系统性疾病和胃肠道疾病引起。功能性消化不良(functional dyspepsia,FD)指无器质性疾病可解释的消化不良症候群,目前认为其发病机制包括胃酸的不耐受、胃排空延迟、胃容受性受损、胃高敏感性、十二指肠功能紊乱、脑肠轴的异常、幽门螺旋杆菌(HP)感染等[1]。已有研究证实FD患者胃黏膜肥大细胞(mast cells,MC)增多[2],MC脱颗粒增多[3],MC增多活化释放多种介质如一氧化氮(NO)、血管活性肠肽(VIP)、5-羟色胺(5-HT)等影响胃及十二指肠感觉和动力,而这些因素均与FD发病有关[4],但以往研究中尚不明确FD患者不同消化不良症状产生的原因,本研究旨在探讨FD患者不同部位胃黏膜MC变化与消化不良症状的关系。
1 资料与方法
1.1一般资料 选择2013年11月至2014年11月本院收治的FD患者32例,按照症状不同分为早饱组(n=7)、餐后上腹胀组(n=17)、上腹胀组(n=12)、上腹痛组(n=16),上腹烧灼感组(n=11)。另有14例无消化不良症状者作为对照组,基线资料与FD患者一致,均由于发现肿瘤标记物升高或体检提示HP感染等原因就诊行胃镜检查,胃镜检查未发现明显异常,因其无临床症状而纳入对照组。入组标准:符合罗马Ⅲ诊断标准[5]诊断为FD患者。排除标准:患可引起消化不良症状的系统性疾病、胃肠道疾病、肝胆疾病者;长期服用可引起消化道不良反应的药物者;有其他特殊病史者:非腔镜的上腹部手术史。
1.2方法
1.2.1问卷调查 胃镜检查前进行问卷调查,调查内容包括基本信息、既往疾病及用药史、既往胃镜检查及HP感染情况、胃肠症状调查。
1.2.2胃镜检查 胃镜检查时,对胃黏膜体部及窦部进行活检,活检标本固定脱水石蜡包埋切片,进行常规苏木素-伊红(HE)染色,常规HE染色图片的观察由病理科同一位医生进行。
1.2.3免疫组织化学方法(IHC)检测MC 试剂:鼠抗人肥大细胞类胰蛋白酶单克隆抗体购自英国Abcam公司,二抗购自福州迈新公司。操作过程:胃镜下胃黏膜活检后甲醛固定,石蜡包埋切片,留存标本。IHC染色采用Envision方法,脱蜡后进行高压锅热抗原修复,抗原修复结束后一抗室温孵育1 h,磷酸盐缓冲液(PBS)冲洗,二抗室温孵育15 min,PBS冲洗,二氨基联苯胺(DAB)显色2 min,冲洗,苏木素复染。光镜下观察其形态并计数,高倍镜(×400)下每片连续视野计数200个,结果以个/mm2表示。脱颗粒大于50%者为完全脱颗粒,10%~50%者为部分脱颗粒[6]。以个/mm2表示MC的密度,脱颗粒细胞数/所有计数细胞×100%表示脱颗粒细胞的百分比,(完全脱颗粒MC数×0.75+部分脱颗粒细胞数×0.25)/所有计数细胞×100%表示MC的脱颗粒程度。

2 结 果
2.1显微镜下MC观察情况 MC位于胃黏膜固有层腺体之间,呈棕黑色椭圆形,细胞体积较大,部分MC呈梭形为侧切面的MC,活化的MC边缘不齐,细胞周围可见棕黑色细小或粗大的颗粒,见图1。
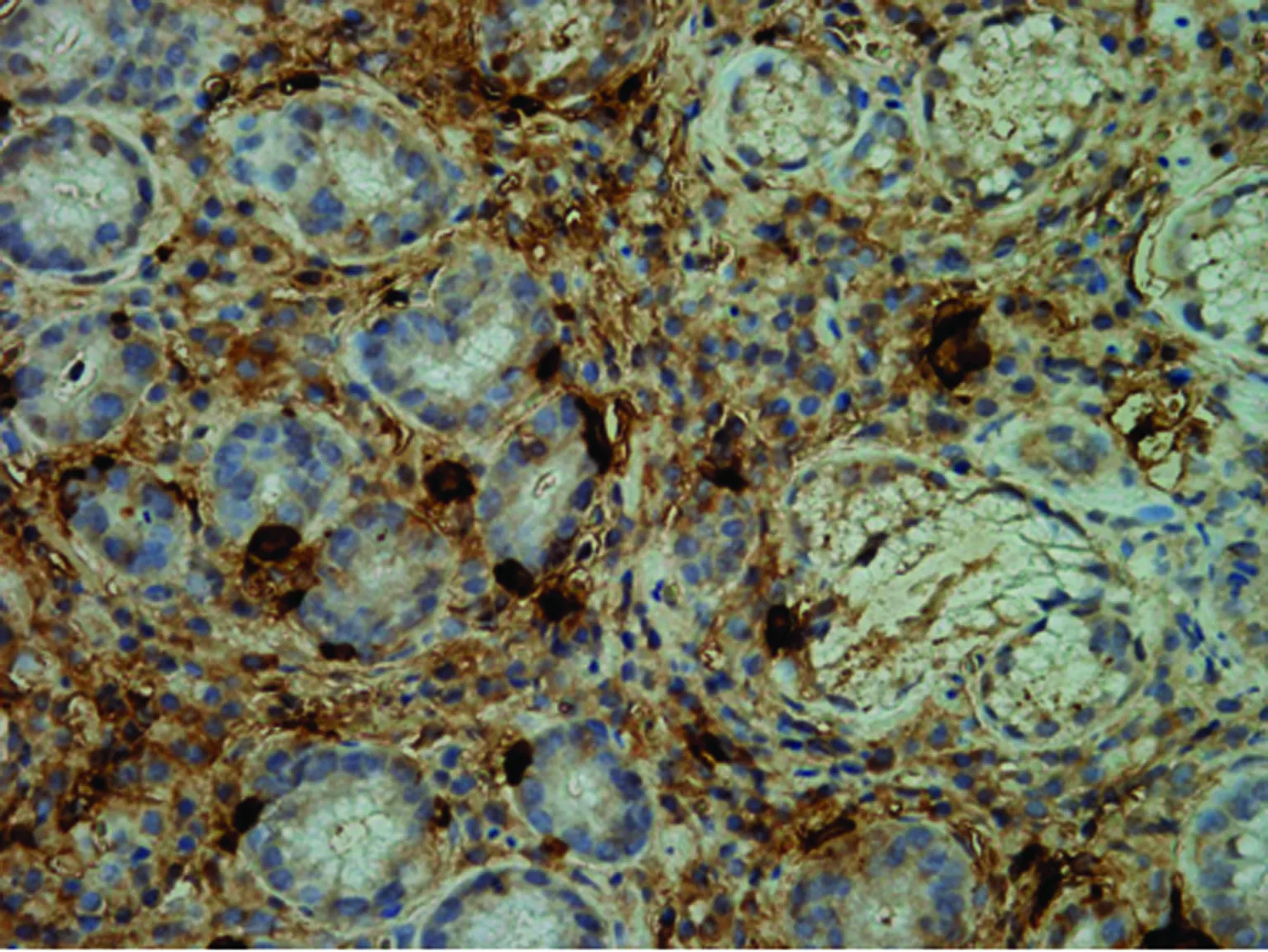
图1 显微镜下胃黏膜IHC染色MC(×400)
2.2胃体黏膜MC与症状的关系 比较FD患者各症状组与对照组患者胃体黏膜MC数目、脱颗粒情况,除早饱组外各组较对照组胃体黏膜MC密度均增加,各组胃体黏膜脱颗粒MC比例、MC脱颗粒程度较对照组均增加。其中胃体黏膜脱颗粒MC比例、MC脱颗粒程度餐后上腹胀组较对照组增加(t=-3.508、-3.168,P=0.002、0.004);胃体黏膜MC密度、脱颗粒MC比例、MC脱颗粒程度上腹痛组较对照组增加(t=-2.740、-4.607、-3.825,P=0.011、0.000、0.001),见表1、图2。

表1 各组对象胃体黏膜MC比较
a:P<0.01,b:P<0.05,与对照组比较
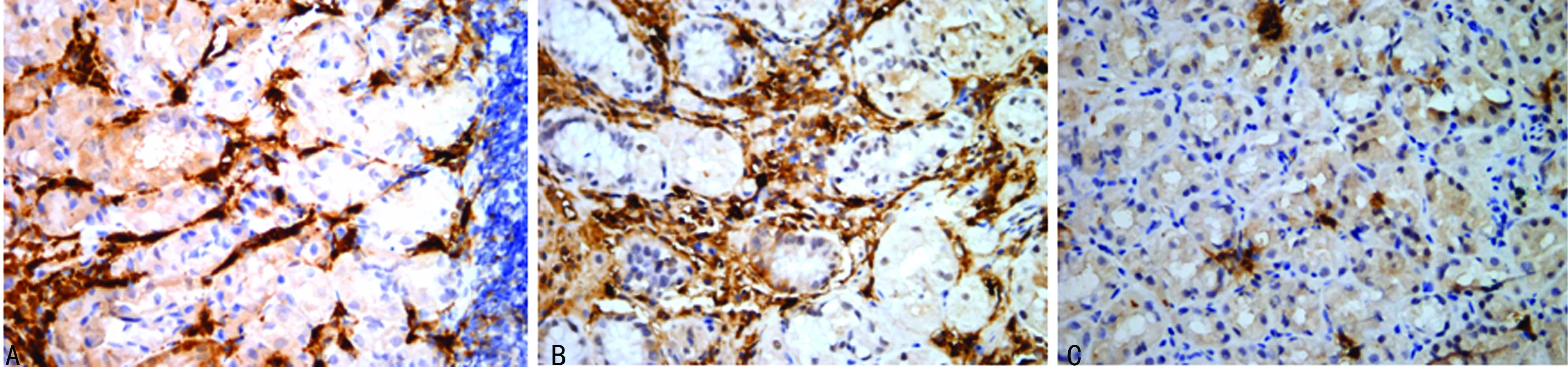
A:餐后上腹胀组;B:上腹痛组;C:对照组
A:早饱组;B:上腹痛组;C:对照组
2.3胃窦黏膜MC与症状的关系 比较FD患者各消化不良症状组与对照组患者胃窦黏膜MC数目、脱颗粒情况,胃窦黏膜脱颗粒MC比例早饱组较对照组减少(t=2.308,P=0.032)。胃窦黏膜MC密度餐后上腹胀组、上腹胀组、上腹痛组较对照组增加,差异均有统计学意义(t=-2.537、-2.297、-2.124,P=0.019、0.039、0.043),见表2、图3。

表2 各组对象胃窦黏膜MC比较
a:P<0.05,与对照组比较
3 讨 论
FD发病机制多元化,其症状表现多样。根据罗马Ⅲ的诊断标准,FD分为2个亚型,餐后不适综合征(prandial distress syndrome,PDS)和上腹痛综合征(epigastric pain syndrome,EPS)。PDS的主要表现为早饱及餐后饱胀感,而EPS主要为位于上腹部的疼痛或烧灼感[5]。多数学者认为FD不同亚型的病理、生理学机制不尽相同,但目前尚无统一定论。以往的研究显示,PDS(相当于罗马Ⅱ动力障碍样消化不良)多以胃窦运动障碍,胃排空延迟为主要表现,而EPS(相当于罗马Ⅱ溃疡样消化不良)则胃排空正常,以胃底容受性扩张功能异常及内脏高敏感为主要机制[7],不同类型FD的病理、生理学有差异。但亦有研究从宏观的角度通过FD症状量表、固体胃排空试验、多导联胃电图、自主神经功能检测、液体负荷试验同步胃内压测定、心理评定等多方面评估得出结论,3种分型(PDS、EPS、混合型)的FD相关病理、生理机制比较,差异无统计学意义(P>0.05)[8]。
MC脱颗粒导致躯体、内脏感觉阈下降。组织MC活化常见的临床表现是疼痛[9]。胃肠道内MC是免疫系统的哨兵,会对广泛的外界刺激作出反应,包括过敏原、细菌、寄生虫、神经肽及压力。MC通过释放多种神经递质作用于肠神经、感觉传入神经导致胃肠道感觉运动功能障碍[10-11]。有学者研究发现,胃黏膜MC增多活化释放多种介质导致躯体、内脏感觉阈下降,释放5-HT作用于初级传入神经末梢上的5-HT1A受体产生效应;5-HT作用于钙基因相关肽阳性神经纤维末梢5-HT3受体又引起钙基因相关肽释放,胃黏膜MC合成5-HT增加和受体表达增强与胃机械性扩张过敏有关[12]。另外MC释放介质NO、白三烯等可使胃肠道肾上腺素能受体数目改变,α受体增多,β受体减少,导致平滑肌松弛和胃排空延迟,这些因素均与FD发病有关。
有学者曾以罗马Ⅱ诊断标准对34例FD患者进行研究,发现溃疡型、动力障碍型、非特异型之间MC数目差异有统计学意义(P<0.05),MC数目以动力障碍型最高,非特异型最低[13]。陈海山等[14]根据罗马Ⅲ标准分型对FD患者进行研究,发现FD患者胃黏膜MC数目增加,而在PDS、EPS组间差异无统计学意义(P>0.05),但该研究并未对胃体或胃窦黏膜组织MC情况进行分别的研究。且罗马Ⅲ标准不同FD分型为一组症状组合,不同症状可能形成的机制不同,研究MC与不同消化不良症状间相关性可能更清晰地明确FD的发病机制。已有研究证实部分感觉过敏FD患者近端胃黏膜MC增多[15],FD症状可来源于对胃扩张刺激或化学物质刺激的高敏感性,该研究中并未对FD进行分型,未研究MC与某一消化不良症状的关系,不能明确不同症状产生机制的差别。本研究将胃体与胃窦分别进行分析,有上腹痛症状的患者胃体黏膜MC数目、脱颗粒情况均明显增加,胃窦黏膜MC数目明显增加,提示无论是胃体或是胃窦黏膜MC及其脱颗粒的增加均可能导致内脏痛阈下降,痛觉过敏。作者前期研究证实PDS型FD患者胃排空延迟[7],本研究发现餐后上腹胀组胃体黏膜MC脱颗粒明显增加,胃窦黏膜内MC数目增加,提示胃体、胃窦黏膜MC变化均可能导致胃动力的改变。目前认为胃电活动的起搏点在胃体大弯侧,机械性运动随胃电活动产生,推测胃体黏膜MC与胃部疼痛、动力等均有相关性,这可能是通过释放不同的细胞因子或不同的受体激活而介导。本研究结果显示早饱组胃窦黏膜脱颗粒MC的比例较对照组明显下降(P<0.05),其可能原因是脱颗粒MC均为人为判定,显微镜下MC因染色过程中各种原因造成变形等均可能造成脱颗粒情况判定的不准确,因此本研究认为MC数目提示的意义更为可靠。
综上所述,MC活化后脱颗粒,可能释放5-HT、白细胞介素、白三烯、P物质等多种介质,其中5-HT作用于不同受体可引起不同效应。本研究结果显示,胃黏膜MC数目及活化程度增加可能导致胃黏膜高敏感,餐后腹胀症状与胃黏膜MC改变有关,并无直接证据证实MC改变与胃排空延迟相关,而餐后不适症状的产生机制较为复杂,可能与胃排空延迟、近端胃容受性、胃黏膜敏感性均相关,提示MC及其脱颗粒可能通过不同细胞因子或作用于不同靶细胞受体而产生不同的效应,进一步研究可行FD患者胃黏膜内5-HT水平测定、胃黏膜细胞5-HT受体密度、不同5-HT受体类型测定等研究,或许能更好地诠释不同症状FD患者的发病机制,更好地指导临床治疗。

