高效铜绿微囊藻溶藻菌WJ6的分离鉴定及溶藻特性
洪桂云,马少雄,王 佳,张 瑾
高效铜绿微囊藻溶藻菌WJ6的分离鉴定及溶藻特性
洪桂云,马少雄,王 佳,张 瑾*
(安徽建筑大学环境与能源工程学院,安徽省水污染控制与废水资源化重点实验室,安徽 合肥 230601)
以铜绿微囊藻为研究对象,从富营养化水体分离了一株高效溶藻菌,通过分析形态学、生理生化特征及16S rDNA序列比对,鉴定了该溶藻菌株,分析了该菌株对铜绿微囊藻的溶藻方式、溶藻特性及其不同培养时期、不同浓度菌液及不同环境因子对溶藻效果的影响,并探讨了其可能的溶藻机制.研究表明:WJ6属于沙雷氏菌属(sp. GenBank登录号为KY462187);溶藻菌WJ6以胞外释放溶藻物质为主直接溶藻为辅的溶藻方式;溶藻菌WJ6处于对数期时的溶藻率最高达87.50%;菌液浓度达1.4×109CFU/mL以上,溶藻率最高为95.69%;在30℃、pH8条件下,溶藻率达90.00%;改良的基本培养基培养的溶藻菌溶藻率最高达98.50%;铵离子浓度大于2mol/L时,溶藻菌的溶藻率98.33%;当盐度为0.5%时,溶藻率较高为92.77%.溶藻菌株WJ6是1株高效溶铜绿微囊藻菌,在富营养化治理方面具有较好的应用前景.
溶藻菌;分离鉴定;铜绿微囊藻;溶藻特性
目前,由藻类引起的水华和赤潮在世界范围内频繁爆发[1].铜绿微囊藻是富营养化水体引起水华现象的优势藻种之一[2],因其有毒产物藻毒素毒性大、难降解、可被生物富集,已成为渔业生产及水环境中的公害[3-4].中国的三大富营养湖泊(太湖、滇池、巢湖)常常爆发铜绿微囊藻水华,带来了严重的社会、经济以及环境问题.鉴于铜绿微囊藻的各种危害,对其防治显得越来越重要.目前藻类控制技术可归结为: 提取的DNA为模板,以细菌的16S rDNA 通用物理方法、化学方法及生物防治,其中溶藻微生物防治技术因具有成本低、安全性好的潜能,引起了越来越多研究人员的关注[5].国内外学者尝试从自然水体或活性底泥中直接分离、纯化溶藻细菌,目前已报道的溶藻菌有假单胞菌属、交替单胞菌、芽孢杆菌属等[6-16],用此方法筛选的菌种是土著菌,符合当地细菌增殖环境营养条件、可较好地防止菌种退化、功能消失等.因此本文从巢湖处于水华爆发期的富营养化水体中分离和鉴定了一株具有高效溶铜绿微囊藻能力的细菌,并分析其对我国常见的水华蓝藻优势种铜绿微囊藻的溶藻特性,以期为巢湖富营养化水体蓝藻爆发的生物控制提供优势的土著菌种资源和技术支持.
1 材料与方法
1.1 供试藻种
铜绿微囊藻(FACHB-1326)购自中科院水生生物研究所藻种保藏中心,藻种活化后接种于BG11培养基,置于恒温光照培养箱中静置培养.温度(25± 1)℃,光照强度 2000~2500Lx,光暗比为12h:12h.
1.2 方法
1.2.1 溶藻菌的分离与鉴定 所分离的溶藻菌来自富营养化水体.水样经0.8μm滤膜粗过滤,滤液再经0.22μm纤维滤膜过滤,收集0.22μm滤膜,剪成小份,投入牛肉膏蛋白胨培养基中,150r/min,30℃,培养24h.按1:9体积加入预培养一周的供试藻液中进行共培养初步筛选溶藻菌,培养条件同铜绿微囊藻的培养条件.设空白对照,空白对照为不加菌液,加等体积的牛肉膏蛋白胨液体培养基.取明显黄化藻液,平板划线分离单菌落,取菌落形态不同菌落,编号为WJ1-20,保种备用.对纯化得到的溶藻菌株WJ1-20进行复筛,黄化最明显的菌株为高效溶藻菌,对高效溶藻菌株进行革兰氏染色,于光学显微镜下观察.
用TaKaRa试剂盒提取溶藻菌株总基因组DNA,琼脂搪凝胶电泳分析所提取的总DNA.以引物对细菌的基因组进行PCR扩增,其中上游引物(P1)为5’-AGAGTTTGATCCTGGCTCAG-3’,下游引物(P2)为5’-ACGGCTACCTTGTT ACGACTT-3’;扩增条件为:94℃预变性5min; 94℃ 30s, 55℃30s, 72℃ 2min, 30个循环;72℃延伸10min.PCR扩增得到的目的片段经琼脂糖凝胶电泳分离后,在紫外灯下切割收集长度为1500bp左右的凝胶,经Axygene胶回收试剂盒纯化后,送上海生物工程有限公司测序.将测得序列用DNAstar软件编辑后,提交到GenBank.在NCBI中利用Blast软件与GenBank中已知的16S rDNA序列进行同源性比较,确定溶藻菌株的种属.
1.2.2 溶藻菌株生长曲线的测定 将溶藻菌株接种于牛肉膏蛋白胨液体培养基,30℃、150r/min的培养,每2h测定其在600nm处的吸光值,将所测的600nm值与其对应的培养时间作图,绘制生长曲线.
1.2.3 溶藻菌株溶藻机理初步研究 (1) 溶藻菌株溶藻方式培养溶藻菌株株至对数生长期,分别取10mL溶藻菌培养液采取5种处理方式:原菌液(T1);溶藻菌培养液经8000r/min,4℃离心5min,用0.22μm玻璃纤维滤膜过滤上清液 2 次(T2);培养液经8000r/min,4℃离心5min,弃上清液,用牛肉膏蛋白胨液体培养基定容至10mL,使菌体重新悬浮(T3);高温高压(121℃,20min)处理的原菌液(T4) ;超声(100W,10min)破碎后的原菌液(T5);分别与铜绿微囊藻共培养.空白对照加等体积的牛肉膏蛋白胨液体培养基,各组分别设置3个平行样.培养条件:温度(25±1)℃,光暗比为12h:12h.采用丙酮提取分光光度法[17]测定第5d叶绿素a含量,按公式1计算溶藻率.

式中:对照组Chla为对照组的叶绿素a浓度,处理组Chla为处理组的叶绿素a浓度.
(2) 溶藻菌株溶藻效果的电镜观察为观察溶藻菌株溶藻过程中藻细胞结构变化,各取对照组和实验组藻液10mL,5000r/min离心5min,收集藻体并用2.5%戊二醛在4℃冰箱过夜.倒掉固定液,用0.1mol/L、pH值为7.0的磷酸缓冲液漂洗藻体.用梯度浓度的乙醇(50%、60%、70%、80%、90%、95%)对藻体进行脱水处理,再用100%的乙醇脱水,然后放到真空干燥机干燥,镀金,在扫描电镜下观察藻细胞形态变化.
1.2.4 溶藻菌株溶藻特性研究 (1)不同生长时期对溶藻菌株溶藻效果的影响分别取培养至延滞期(1h)、对数期(4h)、稳定期(12h)及衰亡期(28h)的菌液,按1:9体积加入预培养一周的供试藻液中共培养,空白对照(CK)加10mL的牛肉膏蛋白胨液体培养基.测定第5d叶绿素a含量并计算溶藻率.
(2)菌液浓度对溶藻效果的影响将溶藻菌株培养至对数生长期( 2×109cells/mL),将溶藻菌原液分别10-1倍稀释,10-2倍稀释,10-3倍稀释,10-4倍稀释,分别按1:9体积加入预培养一周的供试藻液中共培养,空白对照(CK)加10mL牛肉膏蛋白胨液体培养基.测定第5d叶绿素a含量并计算溶藻率.
(3) 不同环境因子对溶藻效应的影响将溶藻菌株置于30℃、150r/min振荡培养24h,用NaOH和HCl溶液调节藻液pH值至5.0、6.0、7.0、8.0和9.0,空白对照(CK)加10mL牛肉膏蛋白胨液体培养基.接种5d 后测叶绿素a含量研究pH值对微囊藻溶藻效果的影响.
温度对微囊藻溶藻效果的影响试验步骤同pH值影响试验,分别选择20、25、30℃ 3个温度条件进行.
配制牛肉膏蛋白胨液体培养基、LB培养基、改良的基本培养基、BG11培养基、查氏培养基五种不同培养基,分别培养溶藻菌制成菌液,各取培养至对数生长期的溶藻菌菌液10mL加入到90mL预培养一周的铜绿微囊藻藻液中,进行溶藻实验.空白对照(CK)加10mL牛肉膏蛋白胨液体培养基.接种5d后测叶绿素a含量研究不同培养基对微囊藻溶藻效果的影响.
在培养基中加入浓度分别为0、1、2、3、4、5、6、7mol/L的NH4Cl,质量分数分别为0%、0.1%、0.3%、0.5%、0.7%、1%NaCl,研究不同铵离子浓度和盐度条件下,溶藻菌的溶藻效果.各取培养至对数生长期的溶藻菌菌液10mL加入到90mL预培养一周的铜绿微囊藻藻液中,进行溶藻实验.空白对照(CK)加10mL牛肉膏蛋白胨液体培养基.接种5d后测叶绿素a含量研究NH4Cl和盐度对微囊藻溶藻效果的影响.
2 结果与分析
2.1 溶藻菌株的分离与鉴定
2.1.1 溶藻菌株的分离 将从富营养化水体中富集的细菌制成菌液与铜绿微囊藻共培养,经过初筛和复筛,有16株细菌对铜绿微囊藻有明显的溶藻效果,其中一株菌株溶藻效果较强且稳定,命名为WJ6,供以下研究分析.
2.1.2 溶藻菌株WJ6形态及生理生化特征 菌株WJ6在牛肉膏蛋白胨固体培养基上30℃培养48h,菌落呈红色,菌落较小,圆形,边缘规则,表面光滑,湿润,革兰氏染色呈阴性,菌体短杆菌.过氧化氢酶,明胶液化试验都为阳性,能够利用葡萄糖、蔗糖、甘露醇、乳糖并还原硝酸盐.
2.1.3 溶藻菌株WJ6的16S rDNA序列分析 用TaKaRa试剂盒提取总基因组DNA,以细菌的16S rDNA通用引物对细菌的基因组进行PCR扩增,扩增得到的目的片段长约为1500bp(图1).测序结果表明菌株WJ6的16S rDNA为1500bp.将WJ6的16S rDNA序列(GenBank中的登录号为KY462187)与GenBank中已知16S rDNA序列进行Blast比对, Blast比对结果表明,菌株WJ6与沙雷氏菌属的sp. TCR(EF070125.1)的同源性达到99%.结合菌株WJ6形态特征、生理生化实验和16S rDNA序列分析,将溶藻菌株WJ6鉴定为变性菌纲,肠杆菌目,肠杆菌科,沙雷氏菌属.
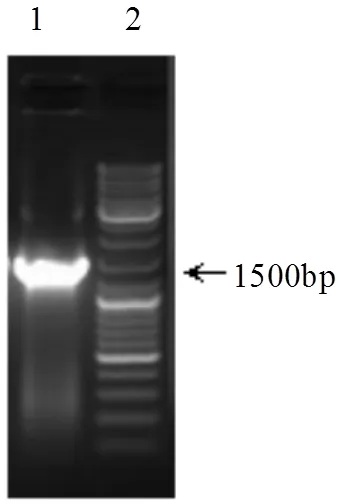
图1 16S rDNA基因PCR扩增产物
泳道1为菌株WJ6的16S rRNA基因扩增产物;泳道2为DNA Marker SM0337(生工公司)
2.2 溶藻菌株WJ6的生长曲线
用无菌移液管吸取1mL培养的原菌液于200mL灭菌的培养基中,再于30℃、150r/min摇床培养,每隔2h取样,用分光光度计在600nm处测菌液吸光度值,绘制生长曲线,如图2所示.从图2可知, WJ6菌株在0~2h处于停滞期,2~6h处于对数期,6~24h处于稳定期,24h后进入衰亡期.

图2 溶藻菌WJ6的生长曲线
2.3 溶藻菌株WJ6的溶藻方式
考察菌液经离心、高温灭菌及超声破碎等5种不同处理方式的溶藻效果,结果如图3.原菌液和无菌滤液的溶藻效果较好,溶藻率分别达到91.18%和88.24%,菌悬液的溶藻率为41.18%,溶藻菌株WJ6的菌悬液和无菌滤液均具有一定的溶藻效果.说明其既通过自身裂解藻细胞,也分泌溶藻物质来裂解藻细胞.溶藻菌WJ6的溶藻方式是直接溶藻与间接溶藻并存,主要为间接溶藻.而经高温高压处理后菌液对藻液作用后溶藻率仅为11.76%,说明胞外分泌物没有热稳定性,可能为蛋白质类物质.超声破碎后的菌液溶藻率为64.71%,说明菌体被破碎后其胞外分泌物起了较强的溶藻作用,更进一步说明溶藻菌WJ6的溶藻方式为间接溶藻为主.
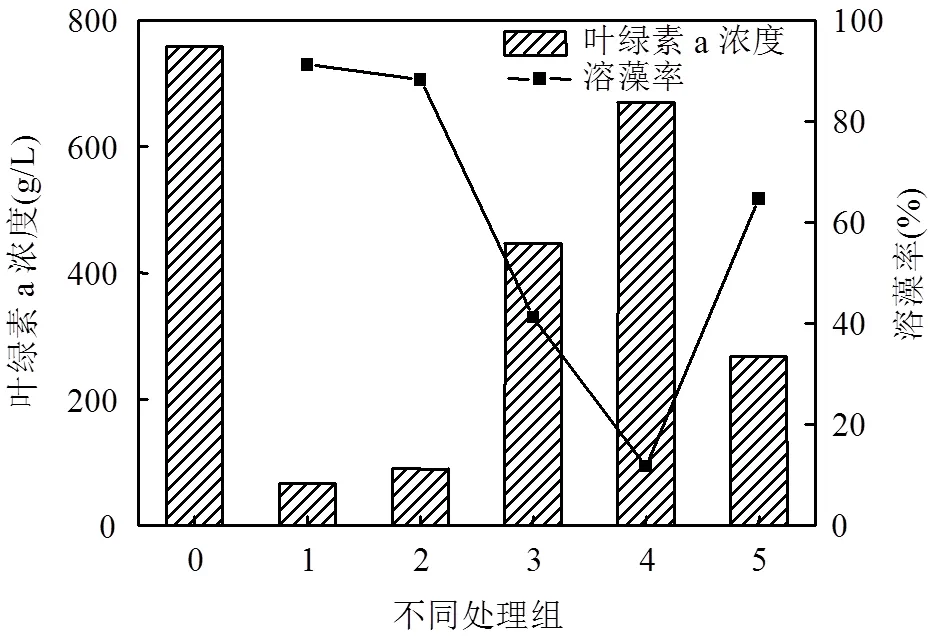
图3 溶藻菌WJ6的溶藻方式
0-对照组;1-原菌液;2-无菌滤液;3-菌悬液;4-经高温高压处理后菌液;5-超声破碎后菌液

图4 溶藻菌WJ6的溶藻效果电镜图
图(a)对照组藻细胞,图(b)为实验组藻细胞(标尺为1μm)
采用扫描电子显微镜对观察溶藻菌WJ6作用后的铜绿微囊藻藻细胞的形态,如图4所示,其中图(a)为对照组藻细胞形态,图(b)为实验组藻细胞形态.对照组中藻细胞结构完整,经实验组藻细胞结构被破坏,细胞形态发生变化,细胞内溶物释放出来,致使细胞死亡.
2.4 溶藻特性研究
2.4.1 不同生长期的溶藻菌WJ6对铜绿微囊藻的溶藻效果 不同时期的菌株WJ6的溶藻效果如图5所示,溶藻率最高的为对数期87.50%,稳定期的为83.33%,衰亡期的为79.17%,延滞期去除率最低为58.33%.对数期菌液的抑藻效果最好,可能是溶藻菌从延滞期后开始分泌具有抑藻效果的胞外物质而致.

图5 不同生长期的溶藻菌WJ6的溶藻效果
2.4.2 不同浓度WJ6菌液对铜绿微囊藻的溶藻效果 不同菌液浓度对溶藻菌的溶藻效果如图6所示.菌液浓度越大,溶藻效果越明显,溶藻效果与菌液浓度在一定范围内呈正相关关系.原菌液溶藻率最高为95.69%,10-6倍稀释菌液溶藻率最低为52.59%.

图6 不同浓度WJ6菌液的溶藻效果
2.4.3 环境因子对溶藻菌WJ6溶藻效果的影响 (1)不同培养基对溶藻菌WJ6溶藻效果的影响由图7可知,改良的基本培养基培养的溶藻菌的溶藻率最高为98.50%,由BG11培养基培养的溶藻菌的溶藻率只有19.50%.牛肉膏蛋白胨液体培养基、查氏培养基和LB培养基培养的溶藻菌的溶藻率分别为96.00%、86.00%和80.00%.

图7 不同培养基培养溶藻菌WJ6的溶藻率
1-牛肉膏蛋白胨液体培养基;2-BG11培养基;3-LB培养基;4-改良的基本培养基;5-查氏培养基
(2) 温度对溶藻菌WJ6溶藻效果的影响 不同温度对溶藻菌WJ6溶藻效果的影响如图8所示,在30℃培养条件下,溶藻效果较好,溶藻菌的溶藻率为99.48%.25℃和20℃培养条件下,溶藻菌的溶藻率分别为94.55%、76.53%.

图8 不同环境温度下溶藻菌WJ6的溶藻率
(3) pH值对溶藻菌WJ6溶藻效果的影响 不同pH值对溶藻菌WJ6溶藻效果的影响如图9所示,pH值分别调至5~9时,都具有溶藻作用,一定范围内的pH值对溶藻效果的影响较稳定,溶藻菌WJ6对铜绿微囊藻的溶藻效果由强到弱顺序为:pH8>pH7> pH9>pH6>pH5.当pH8时,溶藻菌的溶藻率为92.47%,当pH5时,溶藻菌的溶藻率为81.72%.
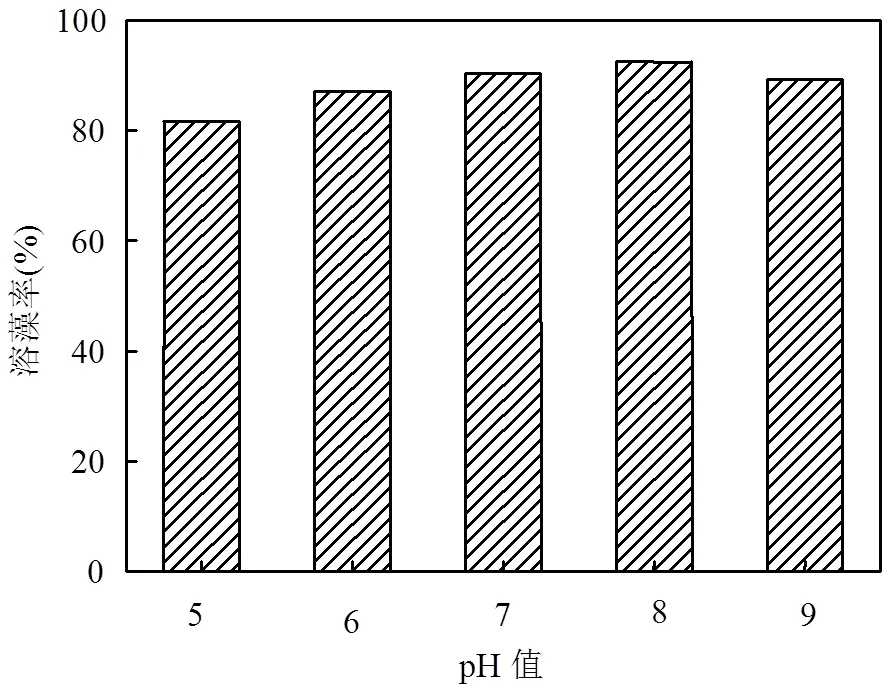
图9 不同pH值时溶藻菌WJ6的溶藻率
(4) 铵离子和盐度对溶藻菌WJ6溶藻效果的影响在培养基中加入不同浓度的NH4Cl,铵离子浓度对溶藻菌溶藻效果的影响如图10所示.加入不同浓度的NH4Cl后,都有促进溶藻菌的溶藻作用.当铵离子浓度为1mol/L,溶藻菌的溶藻率达到71.67%.当铵离子浓度为3、4、5、6、7mol/L,溶藻菌的溶藻率最高为98.33%.
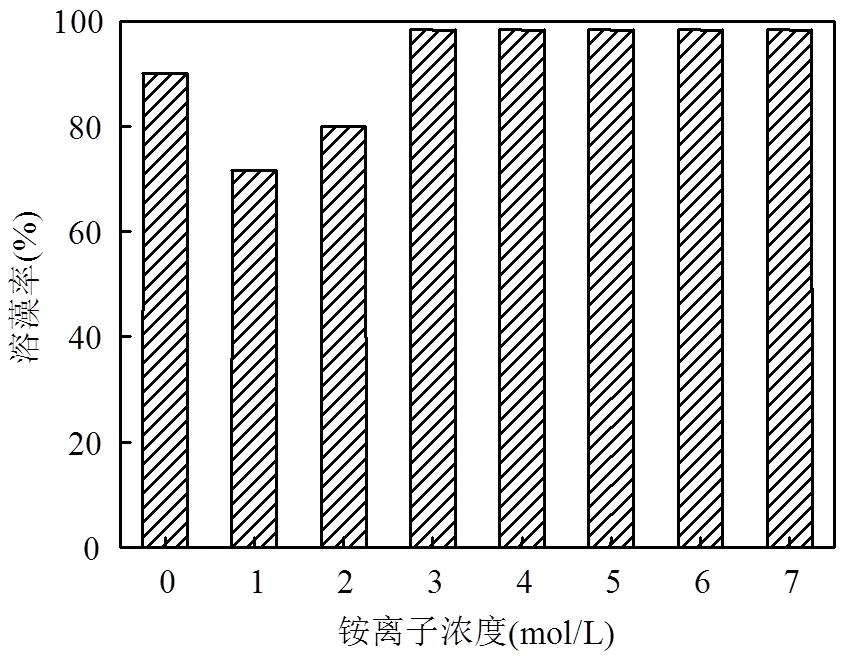
图10 不同铵离子条件下溶藻菌WJ6的溶藻率
不同盐度对溶藻菌溶藻效果的影响如图11所示.一定浓度范围的NaCl对溶藻菌溶藻有促进作用.溶藻菌溶藻效果的最适盐度为0.5%,即原培养基,溶藻菌的溶藻率最高,为92.77%.当盐度为0%,即培养基中不加NaCl时,溶藻率为24.10%.
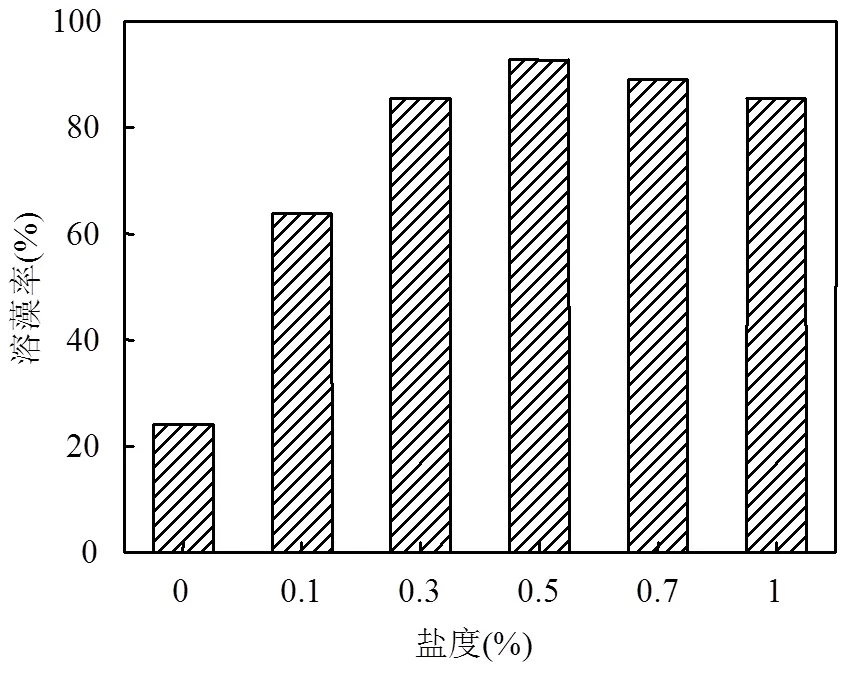
图11 不同盐度条件下溶藻菌WJ6的溶藻率
3 讨论
本研究从富营养湖泊水体中经富集、分离纯化得到一株溶藻细菌WJ6.在菌株形态观察和生理生化特征分析的基础上,结合16S rDNA序列法对分离纯化得到的溶藻细菌WJ6进行鉴定,初步鉴定该菌株属于沙雷氏菌属.目前已报道的溶藻细菌以革兰氏阴性居多,本实验筛选菌株WJ6为革兰氏阴性菌,为溶藻方面报道较少的沙雷氏菌属[18],并显示出了良好的溶铜绿微囊藻的溶藻效果.溶藻率达到90%以上,为高效的溶藻细菌.廖春丽[19],黄现恩[20]等对分离到的溶藻细菌的溶藻专一性进行研究,其溶藻菌对富营养化水体中优势藻如铜绿微囊藻,小球藻,栅藻及蛋白核小球藻等均有溶藻作用.张晖等[21]筛选到的高效抑藻菌C1138对3种不同蓝藻均也有明显的溶藻效果.
细菌溶藻方式一般有2种:直接溶藻与间接溶藻,直接溶藻即细菌直接进攻宿主,与藻细胞直接接触,甚至侵入藻细胞内.间接溶藻指溶藻细菌同藻类竞争营养物质或分泌特异性或非特异性的胞外溶藻物质杀死藻类,如氨基酸、多肽、抗生素和蛋白质等等,其中分泌胞外溶藻物质是溶藻的主要方式.本实验筛选的溶藻菌WJ6的菌悬液和无菌滤液均具有一定的溶藻效果,且无菌滤液的溶藻效果好于菌悬液溶藻效果,可以初步判断该菌是直接溶藻与间接溶藻并存,主要为间接溶藻,即主要通过胞外释放某种物质进行溶藻,且经高温高压处理后菌液得溶藻率较低,该菌溶藻物质可能为蛋白质类物质.程新等[22]筛选出的枯草芽孢杆菌也是通过分泌胞外物质实现的.张晖等[21]筛选的高效抑藻菌C1138主要是通过菌体与蓝藻接触而产生溶藻作用,也能通过分泌胞外物质产生溶藻作用,且部分溶藻物质热稳定较差.张睿等[23]研究了枯草芽孢杆菌对铜绿微囊藻的抑制效果是通过分泌胞外物质实现的,且分泌物具有很强的热稳定性.
溶藻菌的溶藻效果不仅与自身有关,与菌的浓度也有密切关系.Su等[24]研究溶藻菌的溶藻率与菌液浓度的关系,结果与本研究一致.黄晶晶等[25]从富营养化水体中分离出一株苏云金芽孢杆菌MS7,研究了不同菌液浓度对溶藻效果的影响,结果表明在一定范围内,溶藻菌菌液浓度越大,其溶藻率就越高.
4 结论
4.1 从富营养化水体中分离一株具有溶藻作用的菌株WJ6,为沙雷氏菌属.
4.2 溶藻菌株WJ6以间接溶藻方式为主,且胞外分泌物热稳定性差.
4.3 对数生长期溶藻菌株WJ6溶藻效果好,且原菌液的溶藻率最高,温度为30℃、pH值为8时,溶藻效果较好.溶藻菌WJ6在改良的培养基中生长更促进其溶藻作用,当铵离子浓度较高、盐度为0.5%时,溶藻菌WJ6溶藻高.
[1] Oh M Y, Lee B S, Jin D H, et al. Isolation of algicidal compounds from the red algaagainst red tide microalgae [J]. Journal of Applied Phycology, 2010,22(4):453-458.
[2] 李大命,周 军,唐晟凯,等.河蟹养殖池塘微囊藻水华毒性及其光合作用活性特征 [J]. 湖泊科学, 2015,27(1):113-118.
[3] Alexova R, Fujii M, Birch D. Iron uptake and toxin synthesis in the bloom formingunder iron limitation [J]. Environmental Microbiology, 2011,13(4):1064-1077.
[4] 张世羊,成水平,贺 锋,等.两种不同株铜绿微囊藻培养液对大型溞的毒性效应研究 [J]. 水生生物学报, 2008,32(5):637-642.
[5] Imai I, Kimura S. Resistance of the fish-killing dinoflagllate Cochlodinium polykrikoides against algicidal bacteria isolated from the coastal sea of Japan [J]. Harmful Algae, 2008,7:360-367.
[6] Sherman L A, Jr R M B. Cyanophages and Viruses of Eukaryotic Algae [M]. Newly Characterized Protist and Invertebrate Viruses. Springer US, 1978:145-234.
[7] Baker K H, Herson D S. Interactions between the diatomand an associated pseudomonad in a mariculture system [J]. Applied & Environmental Microbiology, 1978,35(4):791-796.
[8] 汪 辉,刘 玲,牛丹丹,等.一株海洋细菌对中肋骨条藻的溶解效应及其溶藻特性 [J]. 中国环境科学, 2011,31(6):971-977.
[9] Proctor L M, Fuhrman J A. Viral mortality of marine bacteria and cyanobacteria [J]. Nature, 1990,343(6253):60-62.
[10] Imai I, Ishida Y, Hata Y. Killing of marine phytoplankton by a gliding bacteriumsp. isolated from the coastal sea of Japan [J]. Marine Biology, 1993,116(4):527-532.
[11] Banin E, Khare S K, Naider F. Proline-rich peptide from the coral pathogen Vibrio shiloi that inhibits photosynthesis of Zooxanthellae [J]. Applied & Environmental Microbiology, 2001,67(4):1536-1541.
[12] Furusawa G, Yoshikawa T, Yasuda A. Algicidal activity and gliding motility ofsp. SS98-5 [J]. Canadian Journal of Microbiology, 2003,49(2):92-100.
[13] Luo J, Wang Y, Tang S. Isolation and Identification of Algicidal Compound from Streptomyces and Algicidal Mechanism to[J]. Plos One, 2013,8(10):e76444.
[14] 马宏瑞,章 欣,王晓蓉,等.芽孢杆菌Z5溶铜绿微囊藻特性研究[J]. 中国环境科学, 2011,31(5):828-833.
[15] 李三华,张奇亚.1株溶藻菌的部分生物学特性及溶鱼腥藻作用 [J]. 环境科学, 2013,34(2):583-588.
[16] Li Y, Liu L, Xu Y T, et al. Stress of algicidal substances from a bacteriumsp. h10on[J]. Letters in Applied Microbiology, 2017,64(1):57-65.
[17] 国家环保总局.水和废水监测分析方法 [M]. 第4版.北京:中国环境科学出版社, 2002:670-672.
[18] 周 瑞,喻 融,王梓入,等.溶藻细菌混合培养对铜绿微囊藻溶藻效果的初步研究 [J]. 华中师范大学研究生学报, 2005,12(4):138-141.
[19] 廖春丽,杨闪闪,许 晨,等.一株溶藻细菌NP23的初步分离鉴别及其溶藻作用研究 [J]. 生物技术通报, 2012,8:163-167.
[20] 黄现恩,谷 青,史全良.一株具有藻毒素降解和溶藻功能细菌的分离鉴定 [J]. 环境工程学报, 2016,10(7):3919-3924.
[21] 张 晖,何 颖,曹驰骋,等.1株巢湖高效溶藻菌的分离鉴定及其溶藻特性研究 [J]. 环境科学与技术, 2018,41(7):1-5.
[22] 程 新,李昆太,黄 林.一株枯草芽孢杆菌的生长特性及抑藻效果研究[J]. 生物技术通报, 2017,33(7):120-125.
[23] 张 睿,王广军,李志斐,等.枯草芽孢杆菌对铜绿微囊藻抑制效果的研究[J]. 中国环境科学, 2015,35(6):1814-1821.
[24] Su J Q, Yang X R, Zheng T L. Isolation and characterization of a marine algicidal bacterium against the toxic dinoflagellate[J]. Harmful Algae, 2007,6(6):799-810.
[25] 黄晶晶,汪雪婷,夏赛周,等.溶藻细菌MS7的分类鉴定及其溶藻活性的初步研究 [J]. 海洋与湖沼, 2013,44(3):632-637.
Isolation and identification of an efficient algicidal bacteria strain and algicidal characteristics on.
HONG Gui-yun, MA Shao-xiong, WANG Jia, ZHANG Jin*
(Key Laboratory of Water Pollution Control and Waste Water Resource of Anhui Province, College of Environment and Energy Engineering, Anhui Jianzhu University, Hefei 230601, China)., 2018,38(11):4269~4275
An algicidal bacteria strain with a strong algicidal effect towas isolated from the eutrophic water. Then, the algicidal bacteria was identified as WJ6 by analyzing it’s morphological features, physiological and biochemical characteristics, as well as phylogenetic analysis of 16S rDNA sequences. The algae-lysing means of WJ6 and the effects of different culture periods, concentrations of bacterium and environmental factors on the algae-lysing action were investigated to analyze the algicidal characteristics and possible algae-lysing mechanism of the strain WJ6. And the results showed that WJ6 was identified assp.(Accession No.KY462187). The algicidal mechanism of WJ6 is indirectively, which disolves the algae mainly by an extracellular products. At logarithmic growth phase, the strain WJ6 can dissolvewith a removal rate of 87.50%. The bacteria WJ6with on centration more than 1.4×109CFU/mL can give the highest removal rate of 95.69%. Under the condition of 30℃ and pH8, the removal rate is 90.00%. The effect of modified basic mediumon the algae-lysing effect of WJ6 is the most obvious with the higests removal rate of 98.50%. Furthermore, the removal rate of the algicidal bacterium is 98.33% when the ammonium ion concentration in the mediumis above 2mol/L. The removal rate is 92.77% when the salinity is 0.5%. All the results stated above indicate that the algicidal bacteria strain WJ6 have a strong algicidal effect toand prospective application in the control ofin eutrophic water.
algicidal bacteria;isolation and identification;;algicidal characteristics
X172,X524
A
1000-6923(2018)11-4269-07
洪桂云(1976-),女,安徽太湖人,副教授,博士,主要从事环境生物技术相关研究工作.发表论文20余篇.
2018-04-03
国家自然科学基金(21677001);安徽省自然科学基金(1708085MB50);省级大学生科技创新项目;校级教研项目(2017jy16, 2017kf02)
* 责任作者,副教授, ginnzy@163.com

