阳荷乙醇提取物及其硬胶囊制备工艺研究
蔡 依,徐津林,郭百臻,阮金兰
(1.武昌理工学院生命科学学院,湖北武汉 430223;2.武汉工程大学化工与制药学院,湖北武汉 430073)
阳荷[1](Zingiber striolatum Diels) 系姜科姜属多年生草本植物,其新鲜根茎的嫩芽是主要药用部位,广泛分布于贵州、四川、广西、江西、湖北、湖南、广东等地;生于海拔300~1 900 m的林荫下、溪边。阳荷是野生蔬菜,一年种植多年生长,能经受环境的恶劣磨炼,生命力极顽强,基本上无病虫害,无需使用农药,且多地均有栽培。阳荷[1]是食药同源植物,嫩芽、茎、果味道香甜,可直接烹饪食用,富含有丰富的膳食纤维、必需氨基酸、蛋白质,具有活血、化瘀、降血糖[2]、治疗痛经[3]等作用,药用价值非常高。黄酮类[4]化合物广泛存在于高等植物中的茎、花、果实、叶、根中,大量研究表明黄酮类化合物具有降脂、抑菌、抗氧化、抗突变、抗癌[6]等活性,为其在食品、医药领域的开发应用提供了理论基础,加快了黄酮类化合物的开发利用[7]。试验以提取物浸膏得率和总黄酮含量为指标,综合评价阳荷乙醇提取物的最佳制备工艺,并通过辅料筛选、休止角测定与质量检测研究,将阳荷乙醇提取物制成硬胶囊,以期为阳荷的深入研究与开发,充分发掘阳荷的药用价值和资源利用提供参考。
1 材料与方法
1.1 材料与仪器
阳荷,湖北省利川市现代农业公司提供,经课题组鉴定为姜科姜属植物阳荷(Zingiber striolatum Diels) 的幼嫩芽苞。
仪器:紫外分光光度计、电子天平、恒温鼓风干燥箱、旋转蒸发仪、pH计、真空干燥器、高速粉碎机。
材料:乙醇、硝酸铝、稀盐酸、亚硝酸钠氢氧化钠、芦丁对照品、氢氧化钠、淀粉、糊精、胰蛋白酶、3号胶囊壳。
1.2 试验方法
1.2.1 阳荷粉末的制备
将阳荷洗净,于60℃烘箱中烘干,用高速粉碎机打成粉末,过40目筛,于4℃条件下保存。
1.2.2 芦丁标准曲线的绘制[8]
称取10 mg芦丁标准品,用60%乙醇溶解并定容至100 mL,配制成质量浓度为0.1 mg/mL的芦丁标准溶液。精密量取上述标准溶液0,2.5,5.0,7.5,10.0,12.5 mL分别置于25 mL容量瓶中,加入60%乙醇使成12.5 mL,精密量取5%亚硝酸钠溶液0.75 mL,摇匀,静置5 min,再加入10%硝酸铝溶液0.75 mL,摇匀,静置6 min,加4%氢氧化钠溶液11 mL,于波长506 nm处测定吸光度,60%乙醇溶液作为空白对照。
以样品质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得回归方程:
Y=9.197 1X+0.001 9,R2=0.999 3.
芦丁标准曲线见图1。

图1 芦丁标准曲线
1.2.3 单因素试验
(1)乙醇体积分数对阳荷提取物总黄酮含量的考查。称取阳荷粉末各5份,每份50 g,分别用50%,60%,70%,80%,90%乙醇,料液比1∶12,回流提取2 h,减压回收部分溶剂至1/3体积,加适量水沉淀,纯化后的溶液于506 nm处测量吸光度,测定阳荷乙醇提取物的总黄酮含量。
(2)料液比对阳荷乙醇提取物总黄酮含量的考查[9]。称取阳荷粉末各5份,每份50 g,用1.2.3(1)中的最佳乙醇体积分数提取,分别以1∶6,1∶8,1∶10,1∶12,1∶14的料液比回流提取2 h,减压回收部分溶剂至1/3体积,加适量水沉淀,纯化后的溶液于波长506 nm处测定吸光度,测定阳荷乙醇提取物总黄酮的含量。
(3)提取时间对阳荷乙醇提取物总黄酮含量的考查。称取阳荷粉末各5份,每份50 g,用1.2.3(2) 项中的最佳料液比为提取料液比,1.2.3(1) 中的最佳乙醇体积分数为提取溶剂,分别以1,2,3,4,5 h回流提取,减压回收部分溶剂至1/3体积,加适量水沉淀,用纯化后的溶液于波长506 nm处测定吸光度,测定阳荷乙醇提取物的总黄酮的含量。
1.2.4 阳乙醇提取物总黄酮含量的计算
精密吸取上述各单因素试验中的样品溶液1.0 mL,按1.2.2中的试验步骤测定样品溶液吸光度,按下列公式计算得各样品溶液的总黄酮含量。

式中:Y——阳荷乙醇提取物总黄酮含量,mg/g;
x——由标准曲线算出的质量浓度,mg/mL;
A——稀释倍数;
W——阳荷粉末质量,g。
1.2.5 阳荷总浸膏得率的计算
将醇提水沉后的水溶液置干燥箱中105℃干燥至恒质量,称质量,按下列公式计算阳荷总浸膏得率。

式中:ω——阳荷总浸膏得率,%;
w——干燥至恒质量的浸膏质量,g;
W——阳荷粉末质量,g。
1.2.6 正交试验
正交因素水平表的设计[10]:根据单因素试验结果,设计L9(33)表,以阳荷乙醇提取物的总黄酮含量和阳荷总浸膏得率为综合评价指标。
因素与水平设计见表1。

表1 因素与水平设计
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇体积分数对提取物总黄酮含量的影响
乙醇体积分数对阳荷乙醇提取物总黄酮含量的影响见图2。
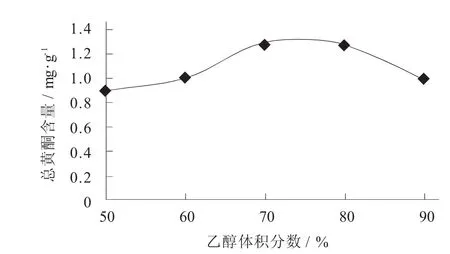
图2 乙醇体积分数对阳荷乙醇提取物总黄酮含量的影响
由图2可知,随着乙醇体积分数的提高,阳荷乙醇提取物的总黄酮含量逐渐升高,当乙醇体积分数达到70%时,总黄酮含量最高,达到1.288 5 mg/g,进一步提高乙醇体积分数时,总黄酮含量下降,50%~70%乙醇适用于提取生物碱、蒽醌类类物质,高于70%的乙醇适用于提取有机酸、挥发油等物质,70%乙醇能较多提取出黄酮苷、苷元类物质。分析可见乙醇体积分数过低时,部分游离黄酮提取不完全,过高部分黄酮苷类成分提取不完全,而70%乙醇则兼顾了阳荷中存在的2种形式的黄酮类化合物。因此,确定乙醇最佳体积分数为70%。
2.1.2 料液比对阳荷乙醇提取物总黄酮含量的影响
料液比对阳荷乙醇提取物总黄酮含量的影响见图3。

图3 料液比对阳荷乙醇提取物总黄酮含量的影响
由图3可知,随着料液比的增加,阳荷乙醇提取物总黄酮的含量逐渐升高,当料液比为1∶12时,总黄酮含量最高,达到1.455 8 mg/g,料液比达到1∶14时,总黄酮的含量开始下降,增大乙醇溶液体积,传质速率增大,更多黄酮类物质溶出,总黄酮含量增大,料液比过大时,多余的乙醇溶液稀释了提取液,传质速率减小,总黄酮含量降低。分析可见料液比1∶12时阳荷中主要化学成分黄酮类化合物提取较完全,而提取溶剂体积过小,主要成分溶出不完全,过大将带来成本增加。因此,确定最佳料液比为1∶12。
2.1.3 提取时间对阳荷提取物总黄酮含量的影响
提取时间对阳荷乙醇提取物总黄酮含量的影响见图4。

图4 提取时间对阳荷乙醇提取物总黄酮含量的影响
由图4可知,随着提取时间的增加,阳荷乙醇提取物的总黄酮含量逐渐升高,2 h时,总黄酮含量达到峰值为1.775 9 mg/g,提取时间超过2 h时,总黄酮含量开始下降,分析可见提取时间过短,主要化学成分提取不完全,过长则无疑会带来成本的增加。因此,确定最佳提取时间为2 h。
2.2 正交试验结果与分析
2.2.1 总黄酮含量测定结果分析
L9(33)直观分析见表2,方差分析见表3。

表2 L9(33)直观分析

表3 方差分析
由表2和表3可知,影响阳荷乙醇提取物总黄酮含量的主次因素为C>B>A,即提取时间>乙醇体积分数>料液比,确定最佳提取工艺为A2B3C2,即乙醇体积分数70%,料液比1∶12,回流提取2 h。
2.2.2 浸膏得率的结果分析
如表2直观分析表和表3方差分析所示,影响阳荷乙醇提取物浸膏得率的主次因素为C>B>A,即提取时间>乙醇体积分数>料液比,确定最佳提取工艺为A1B3C2,即乙醇体积分数60%,料液比1∶12,提取时间2 h。
综合单因素考查结果和正交试验结果,本着主要成分含量优先原则,最终确定阳荷乙醇提取物的最佳制备方案为乙醇体积分数70%,料液比1∶12,回流提取2 h。
2.3 验证试验
按上述正交试验结果,用最佳提取工艺条件对阳荷进行3次提取。
阳荷乙醇提取物总黄酮含量分析见表4,阳荷乙醇提取物浸膏得率分析见表5。

表4 阳荷乙醇提取物总黄酮含量分析

表5 阳荷乙醇提取物浸膏得率分析
3 胶囊制备
根据前期研究获得的阳荷乙醇提取物的最佳制备工艺制得阳荷乙醇提取物,按照胶囊剂制剂学要求,制备阳荷乙醇提取物硬胶囊[11]。
3.1 辅料的筛选
3.1.1 胶囊填充量的设计
根据前期研究确定的提取物最佳制备工艺结果显示,阳荷乙醇提取物总黄酮含量为3.484 mg/g,浸膏得率19%左右,按3号胶囊每粒填充0.2 g计算,填充药粉0.18 g,辅料0.02 g。
3.1.2 辅料的配置[12]
选用淀粉和糊精2种常用辅料,设计4个处方,按表5中的参数称取提取物浸膏粉和辅料,均匀混合,过40目筛,置于真空干燥箱内恒质量48 h。
不同处方组成见表5。
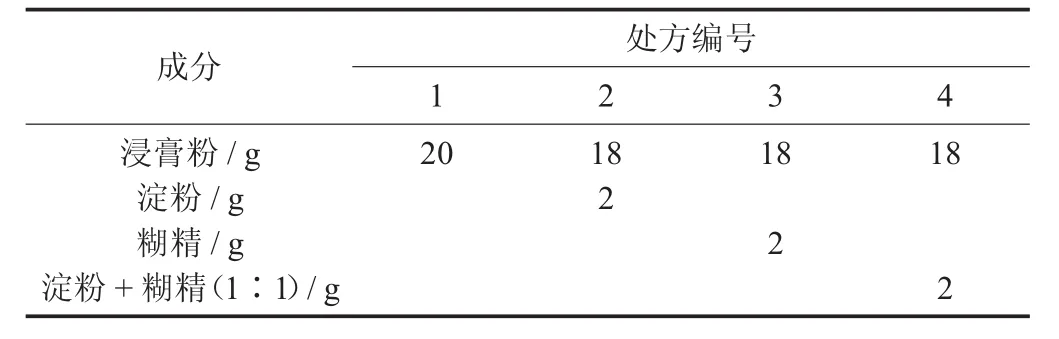
表5 不同处方组成
3.1.3 不同处方内容物的吸湿百分率
配置NaCl过饱和溶液,于玻璃干燥器中,置于25℃恒温培养箱内,将干燥器内的相对湿度控制在75%,精密称取内容物,放置于上述玻璃干燥器内,分别间隔12,24,48,72 h称质量,计算吸湿百分率。
不同处方吸湿率见表6,不同处方吸湿率见图5。
由图5与表6可知,处方4即淀粉+糊精(1∶1)在各个时间点的吸湿百分率相对较小,拟选用淀粉和糊精1∶1混合作为辅料,可以有效降低浸膏粉的吸湿性。
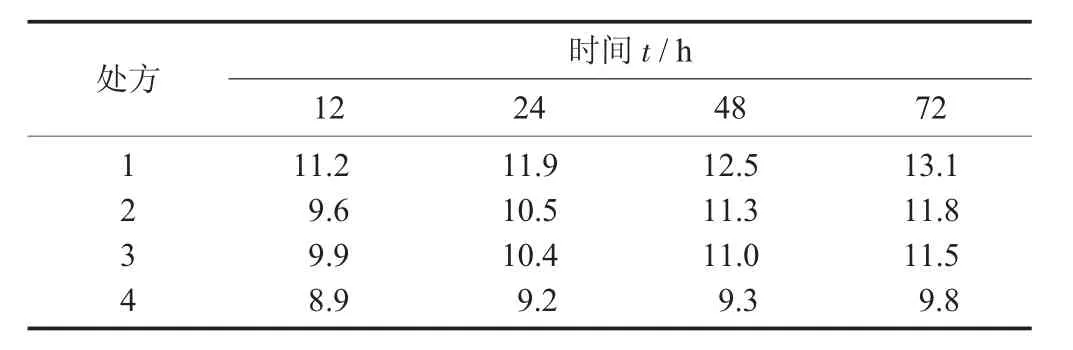
表6 不同处方吸湿率/%

图5 不同处方吸湿率
3.2 制粒及干燥
试验采用湿法制粒,以颗粒成型性为考查指标,选用乙醇作为湿润剂,对湿润剂乙醇体积分数进行考查,可见湿润剂用90%乙醇最好,将制得的湿粒于60℃下真空干燥,整粒,过40目筛。
乙醇体积分数的考查结果见表7。

表7 乙醇体积分数的考查结果
3.3 休止角的测定
采用固定漏斗法进行测定,将漏斗固定在水平放置的绘图纸上方一定距离,漏斗下口距离绘图纸的高度为H,将颗粒倒入漏斗中,直到漏斗下形成的圆锥体间断接触到漏斗的下口为止,圆锥体的直径为2R,由tanα=H/R求得α。
休止角的测定见表8。

表8 休止角的测定
由表8可知,胶囊填充物的休止角为38.0°,表明该产品流动性较好,易于分装。
3.4 阳荷乙醇提取物胶囊的质量检测
胶囊剂的质量应符合药典“制剂通则”项下对胶囊剂的要求,分别从外观、水分、装量差异、崩解时限4个方面评价胶囊质量[13]。
3.4.1 外观
胶囊外观整洁,没有黏结、变形或破裂现象,并无异臭。硬胶囊剂的内容物干燥、松紧适度、混合均匀。
3.4.2 水分
采用真空干燥法测定硬胶囊内容物水分,准确称取2.00~5.00 g样品,烘干至恒质量的称量皿,置真空烘箱,70℃、真空度93.3~98.6 kPa(700~740 mmHg),烘干5 h,待干燥皿冷却,称至恒质量,平行测试3组,含水量均低于9.0%,符合2015年版中国药典的胶囊剂水分标准。
3.4.3 装量差异
取供试胶囊20粒,分别精密称定质量,脱帽,倾出内容物,用小刷搽拭干净,分别精密称量胶囊壳的质量,从而计算得出内容物的质量与平均质量,装量差异限度为9%,符合2015年版中国药典的胶囊剂装量差异标准。
3.4.4 崩解时限
按2015年版中国药典配置人工胃液,按2015年版中国药典中的胶囊剂项下方法进行崩解时限检查,硬胶囊在30 min内全部崩解,符合要求。
4 结论
试验以阳荷浸膏得率和总黄酮含量为评价指标,通过单因素考查、正交试验与方差分析,本着主要化学成分含量优先原则,优选得出阳荷乙醇提取物制备的最佳工艺为料液比1∶12,乙醇体积分数70%,回流提取2 h,得到阳荷乙醇提取物总黄酮的含量为3.484 mg/g。为进一步开展阳荷的深入研究与开发利用,将阳荷乙醇提取物制成硬胶囊,选用3号硬胶囊,由辅料吸湿率测定确定选用淀粉∶糊精=1∶1作为辅料,每粒胶囊填充0.2 g内容物,其中阳荷乙醇提取物0.18 g,0.02 g辅料,90%乙醇作为润湿剂,湿法制粒,于60℃条件下真空干燥,整粒。经测定其颗粒休止角38.0°,流动性好,易于分装。制备的胶囊质量检测其外观、水分、装量差异、崩解时限均符合2015年版中国药典对硬胶囊剂的要求。课题组前期研究发现阳荷乙醇提取物能明显降低糖尿病试验动物血糖,极具深入研究价值,试验研究结果将为阳荷的深入研究与开发、充分发掘阳荷的药用价值和资源利用提供参考依据。

