礁膜室内规模化人工育苗的研究
粟 文,谢恩义,孙立伟,王艳平,王 惠,徐日升
( 广东海洋大学 水产学院,广东 湛江 524088 )
礁膜(Monostromanitidium)又名绿紫菜,属绿藻门、石莼目、礁膜科、礁膜属,是冬、春季大型海藻,为一层细胞组成的膜状体,黏滑,基部细胞向下延伸出假根丝组成固着器,成熟时产生雌、雄配子,配子结合为合子,并生长发育成孢子体。孢子体小型,囊球状,孢子囊成熟后可产生有4条鞭毛的游孢子[1]。研究发现,礁膜营养丰富,含有较高的蛋白质、碳水化合物及多种维生素和矿质元素,口感好,食用价值高,并具有药用价值,有清热化痰、利水解毒、软坚散结的作用,常用于治疗喉炎、咳嗽痰结、水肿等[2-4];从中提取的硫酸多糖有抗凝血、抗氧化、降血脂和抗炎活性[5-6],因此,礁膜是一种极具开发潜力的海洋食品、药物和化妆品等资源。虽然国内对绿藻的开发利用呈现上升的趋势,浙江等地已形成了一定规模的绿藻加工产业,但产量还远远不能满足国内外的需求[7-8]。因此开展绿藻栽培种——礁膜的人工育苗技术的研究具有重要意义。
20世纪90年代,日本Kida[9]较早完成了礁膜的人工育苗与栽培技术,日本礁膜的产业化已经比较完善,栽培技术处于领先水平。随后,国内陈昌生等[10-12]研究了生态因子对礁膜配子和合子的影响;Hua等[13]研究了宽礁膜(M.latissimum)的生活史;谢恩义等[14]对宽礁膜的基础生物学及室内育苗与栽培进行了较全面的研究;李晓丽等[15]对北极礁膜(M.arcticum)进行了合子采苗、孢子囊培养和孢子采苗等人工育苗试验。这些研究多侧重于基础研究,虽然有过人工育苗的尝试,但均未达到规模化育苗的要求。要发展我国礁膜栽培业,首先需要建立室内人工育苗技术,笔者对广东地区礁膜进行了配子放散、合子附着与培养等相关试验,旨在建立一套我国礁膜室内人工大规模育苗技术。
1 材料与方法
1.1 种藻来源
礁膜种藻于2016年3月至4月下旬采自广东湛江硇洲岛附近海域的中高潮带,藻体加冰低温运输带回实验室,用消毒海水(经砂滤及暗沉淀处理的自然海水煮沸消毒20 min,冷却至常温)清洗去除藻体表面的泥沙和杂藻。
1.2 成熟礁膜配子日放散规律
挑选藻体颜色为黄褐色,镜检边缘有一圈成熟配子囊的种藻,吸干藻体表面水分,取1 g种藻放入培养皿中加入20 mL消毒海水(盐度27),置于有自然光的恒温室内(24±0.5) ℃,连续观察24 h,每隔2 h用移液枪取25 μL配子液移至载玻片上,根据盖玻片与视野面积之比,求出盖玻片下的视野数(即25 μL配子液的配子数量),从而计算出 20 mL中配子放散量。每次观察后同时清洗藻体并更换消毒海水。
1.3 合子附着
黑暗时间对合子附着的影响:设置8个直径为6 cm培养皿,每个培养皿放入3块2 cm×2 cm×1 mm PVC苗板,倒入相同量配子液,置于黑暗处连续培养16 h[12-13],每隔2 h取出1个培养皿,显微镜下(10×10)观察合子附着数,根据苗板面积与视野面积之比,计算出每块苗板的合子附着总数,取均值。
不同附着基对合子附着的影响:将PVC塑料板、PET塑料板、纤维板、普通玻璃板和有机玻璃板5种不同材料2 cm×2 cm×1 mm的苗板分别放入5个直径为6 cm培养皿,每个培养皿3块相同材料苗板,置于黑暗处12 h后同上计算苗板合子附着总数。
1.4 合子培养中杂藻硅藻的清除
用内径0.48 cm的钻孔器取硅藻附着基本一致的苗板圆片,放入200 mL消毒海水中,二氧化锗质量浓度梯度设置为0、0.1、0.3、0.5、1、3、5、10、20、30、40 mg/L。显微镜下(10×10)观察各圆片附着的硅藻数,计算出二氧化锗对附着硅藻处理后的脱落率或增长率。
1.5 礁膜室内人工育苗试验
配子放散:将清洗干净的种藻均匀铺于干净通风处阴干10~16 h(种藻含水量50%~60%),称量0.9 kg放入40 L消毒海水中(盐度27、温度24 ℃),充气搅拌,用光照度为5×104~9×104lx的强光照射,约5 min后加入适量45 ℃蒸馏水[13],约30 min后用筛绢过滤出种藻即得配子液。同上计算配子放散总量。
合子附着与培养:将200张PVC苗板浸入40 L配子液中,黑暗处理12 h,合子附于PVC苗板后(同上计算合子附着总数)分置于4个塑料水槽中培养,水容积180 L,每个月更换消毒海水1~2次。培养期间,每隔5 d测1次水温、盐度、光照和合子直径,每次测量20个合子,取其平均值。
采集游孢子及培育:游孢子采苗使用的附着基为维尼纶绳(海区栽培多采用苗绳,直径1 cm)。采游孢子时,将生长成熟孢子囊的PVC苗板移入消毒海水中,强光照射(5×104~9×104lx),经搅拌待大量游孢子放出,水色变为浅绿色时,取出PVC苗板,放入维尼龙绳,浸泡、翻动,待游孢子附着后移至塑料水槽内培养,水容积180 L。
1.6 数据统计及分析
数据采用Excel 2007和SPSS 16.0软件进行统计分析,结果以平均值±标准差表示,取P<0.05为显著差异,P<0.01为极显著差异。
2 结 果
2.1 成熟礁膜配子日放散规律
3月初即将成熟的礁膜,在室内适宜条件下暂养约4 d,藻体边缘颜色由绿色变成黄褐色,配子囊迅速成熟。镜检可见在成熟的配子囊放散配子前,囊壁变成透明状,极易吸水破裂,配子即从裂口喷射而出。8:00—12:00配子放散量较少,14:00配子放散量较多,18:00—2:00配子放散量基本不变,4:00和6:00出现一个放散小高峰期,且在4:00时候配子放散量最高(图1)。礁膜24 h昼夜均能进行配子放散,因此室内规模化人工育苗时可在较为方便的任何时间段进行采苗。

图1 礁膜配子的日放散规律
2.2 合子附着
黑暗时间对合子附着的影响见图2。由图2可知,黑暗2~16 h均有合子附着,但黑暗时间短(2~6 h),合子附着密度低;随着黑暗时间的延长合子附着密度迅速增加,黑暗第8 h,合子的附着数达到最高,为8.7×105个。黑暗时间继续延长,合子附着数逐渐下降,到第14 h时苗板合子附着数仅约为第8 h的65%。t检验表明,黑暗8~12 h间合子附着数无显著差异(P>0.05)。

图2 黑暗时间对合子附着的影响
不同材料的苗板对合子附着的影响见图3。由图3可知,黑暗处理12 h,合子均能很好地附着于5种材料苗板上,合子附着数为3.4×105~3.8×105个。t检验表明,5种材料苗板之间的合子附着数不存在显著差异(P>0.05)。
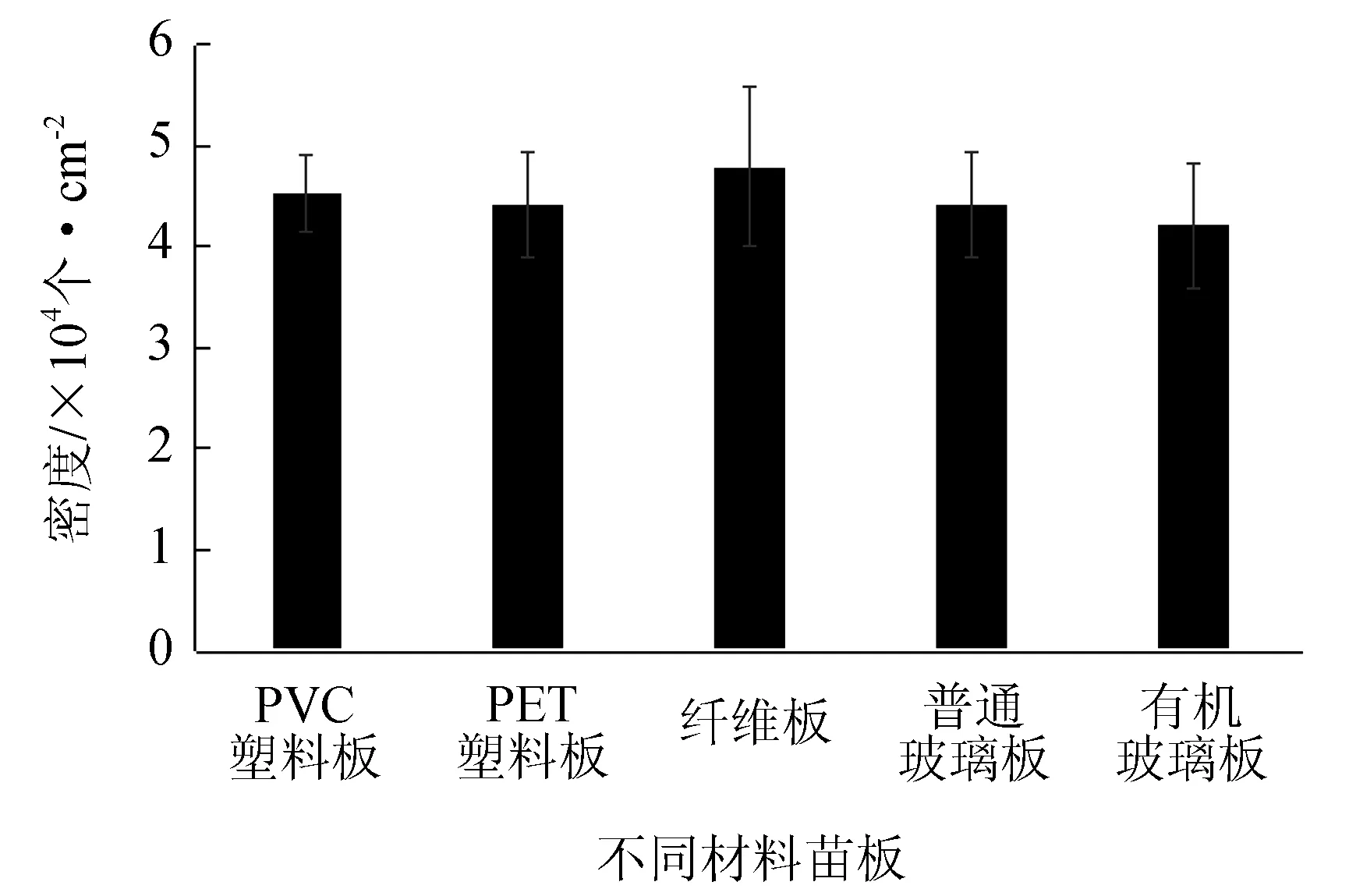
图3 不同材料的苗板对合子附着的影响
2.3 合子培养中硅藻的清除
二氧化锗清除硅藻的效果见表1。随着二氧化锗质量浓度的增加和处理时间的延长,硅藻脱落呈现递增趋势。当二氧化锗质量浓度大于0.5 mg/L时,对附生硅藻的脱落作用显著;当二氧化锗质量浓度达3 mg/L时,苗板圆片上附生的硅藻在第11 d全部脱落。处理后的苗板圆片移至消毒海水继续培养20 d,镜检合子正常生长。
2.4 礁膜室内人工育苗
配子放散时可观察到大量配子聚集在一起成云雾状,海水变为浅绿色,配子放散总数达4×1010个,平均每克藻体放散配子量高达4.4×108个。合子的培养条件及生长见表2。礁膜合子培养时间自4月中旬至9月中旬,历时约5个月。合子培养前期(4—6月),水温较低,生长较快,合子由5.2 μm增至39 μm,6月下旬,镜检合子内形成颗粒状的游孢子,转为孢子囊。7—8月水温较高,孢子囊生长缓慢,9月上旬进行遮光处理,以促使孢子囊同步成熟。附着于维尼纶绳上的游孢子,培育15 d后可生长至长度为1 cm的礁膜幼苗。
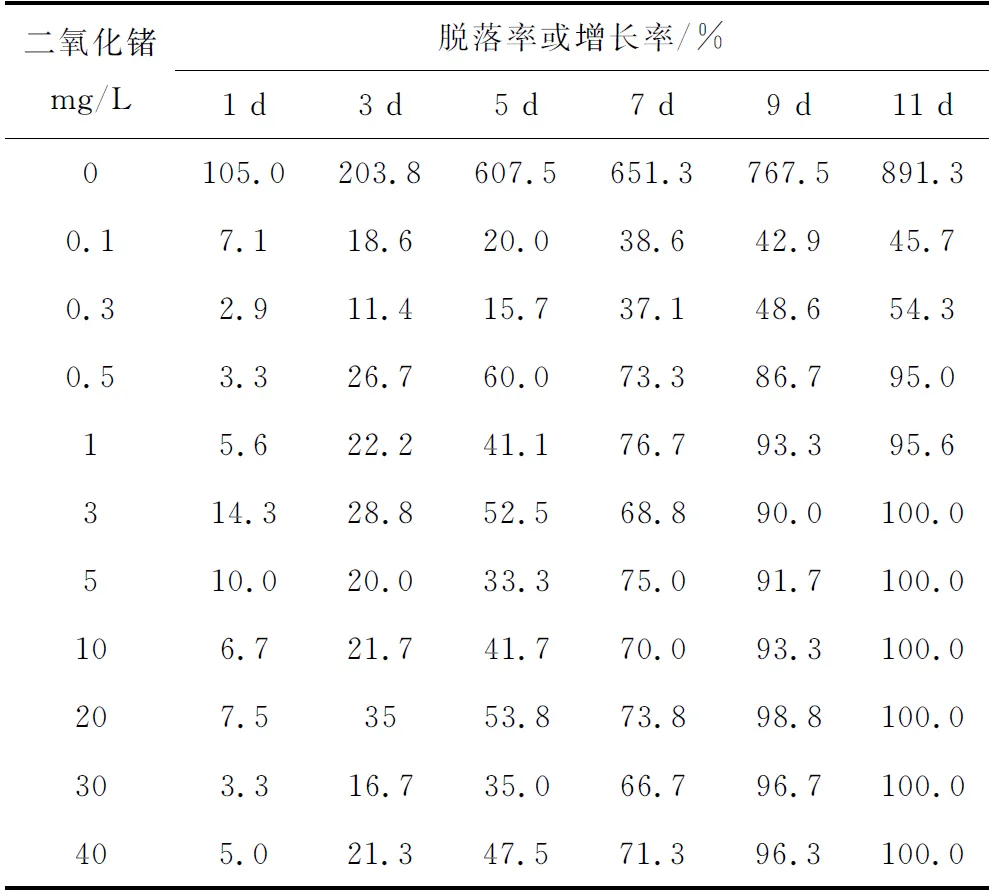
表1 二氧化锗去除硅藻的效果

表2 合子的培养条件及生长
3 讨 论
礁膜室内人工育苗技术能有效解决大面积推广所需礁膜种藻的问题,缓解种质退化,为礁膜的规模化人工育苗及栽培提供技术支撑。根据多次采集种藻进行配子放散试验发现,在礁膜繁殖盛期3月下旬至4月下旬期间的大潮前后可采集到成熟度较好的种藻,用于生产性育苗。根据礁膜属已有的人工育苗研究[13-15]以及试验可知,对种藻进行室内阴干刺激处理10~16 h,在采配子过程中充气搅拌、强光照射、改变海水温度(±2~3 ℃为宜)和盐度(±3~5为宜)能一定程度促使配子集中大量放散。
Kida[9]将附着板打孔穿绳后,采用悬挂式方法进行合子附着和培养。本试验采用插槽式方法进行合子附着和培养,能极大提高育苗效率,且便于操作管理。规模化人工育苗建议选用经砂轮打磨过的PVC塑料板作为苗板,便于在5个月的合子、孢子囊培养期里在显微镜下随时观察记录其生长情况,苗板不宜过大,建议规格为20 cm×10 cm×1 mm。礁膜配子具趋光性,进行合子附着黑暗处理能使合子较均匀附着于苗板上,且能增加配子结合成合子的几率[16],但初生合子抗逆性弱,长久得不到光照,生长会受抑制,甚至死亡。本研究采用PVC苗板作为附着基,黑暗8~12 h时合子附着效率最高,这与陈昌生[11]直接采用培养皿为附着基黑暗10 h合子附着率达到最大的试验结果相接近。合子在转为孢子囊前光照度不能长期低于900 lx,超过2~3 d合子会迅速死亡。培养过程中苗板上极易滋长蓝藻、绿藻和硅藻等杂藻,杂藻大量生长,抢占、替代合子生态位点,或释放孢子萌发成小苗而覆盖合子[13],进而导致合子死亡。用0.5~3 mg/L二氧化锗处理11 d能有效去除合子培养过程中滋生的硅藻,蓝藻和绿藻可采用干燥的方法抑制其着生,但无法彻底根除,且繁殖速度极快。合子、孢子囊的培养期有5个月,培育效果直接影响到礁膜人工育苗的成败,因此亟待进一步从根本上解决杂藻生长引起的合子死亡的问题。

图4 礁膜室内人工育苗a.种藻室内阴干10~16 h;b.种藻放入消毒过滤海水中,采用充气搅拌、强光照射等方法促进配子放散;c.将种藻滤出后的配子液;d.将PVC苗板浸入配子液中;e.黑暗处理8~12 h,使雌、雄配子结合成合子附着于PVC苗板上;f.附有合子的PVC苗板;g.附于PVC苗板上的合子(10×10);h.室内合子培养;i.孢子囊释放游孢子(10×10);j.培育15 d长度为1 cm的礁膜幼苗(4×10).

