抑制有氧糖酵解增加硼替佐米诱导的非小细胞肺腺癌细胞凋亡
石少敏,赵建军*,杨 蕾
(吉林大学中日联谊医院 1.呼吸内科;2.镜检科,吉林 长春130033)
无论从发病率和死亡率调查显示,肺癌都是世界上最常见的恶性肿瘤,肺癌是导致癌症相关死亡的最主要原因[1,2]。在肺癌的分类中,非小细胞肺癌(NSCLC)在所有肺癌病例中大约占80%[3]。早期诊断的NSCLC手术切除后的生存率较高[4]。然而,当病人处于中期或者晚期再进行治疗,特别是有明显转移的患者,其平均生存率一般不超过18个月[5]。因此,如何寻找有效的分子治疗的靶点成为提高患者生存率的关键。
研究显示,肿瘤细胞与正常细胞的代谢方式不同,其往往通过有氧糖酵解的方式获得能量,即使在氧气充足的情况下[6]。研究显示,肿瘤这种特殊的代谢方式在肿瘤的发生发展中发挥着重要的作用,成为研究的热点[7-9]。本课题拟通过体外实验明确,肿瘤细胞有氧糖酵解在蛋白酶体诱导的非小细胞肺癌中的作用,为临床靶向肿瘤有氧糖酵解和蛋白酶体途径联合用药提供一定的策略。
1 材料与方法
1.1 材料与试剂
人非小细胞肺腺癌H157细胞购买于中国科学院细胞库,胎牛血清,1640培养液,胰酶购买自美国Hyclone 公司。糖酵解抑制剂2-DG,bortezomib、MTT(四甲基偶氮唑蓝)购买自美国Sigma公司,cleaved caspase-3,cleaved PARP,cytochrome C抗体购买自美国CST公司。
1.2 细胞培养,传代
体外培养H157细胞,给予含有10%血清的1640培养液,放入CO2浓度调整为5%,温度为37℃培养箱内孵育,观察细胞贴壁情况,待细胞完全贴壁后生长至培养皿的80%进行细胞传代,利用胰酶消化细胞后按照1∶2的比例进行传代,按照实验分组进行相应的给药,作用时间结束后进行相应的检测。
1.3 细胞存活率检测
为评价药物对细胞存活率的影响,利用MTT试剂对存活率进行检测。当细胞处于对数生长期时进行胰酶消化,进行96孔板铺板,每孔约5000个细胞,每组设置6个重复孔,铺板待细胞完全贴壁后,给予相应的药物刺激,药物作用完成后,96孔每孔内加入12 μl MTT试剂(5 mg/mL),摇匀后放入孵育箱内继续培养,3-5 h结束,MTT作用完成后,弃除孔内的液体,加入130 μl的DMSO,震荡混匀,利用酶标仪检测OD值(吸光度值,490 nm)。
1.4 Western Blotting(免疫印迹)检测细胞内凋亡相关蛋白水平各组细胞蛋白质表达
当细胞发生凋亡时,细胞内的凋亡相关蛋白的表达水平会发生明显的改变,我们利用Western Blotting检测不同作用条件下H157细胞凋亡相关蛋白的表达水平,具体步骤如下:药物作用完成后,提取细胞总蛋白,首先弃除细胞培养液,利用PBS培养液清洗细胞3次后,加入200 μl RIPA裂解液,作用5 min后利用细胞刮将H157细胞完全刮除,转移至1.5 ml EP管中,低度混匀作用45 min,离心,4 000 rpm/min离心20 min,弃除沉淀,取上清后对蛋白浓度进行定量(BCA方法)。定量后,加入loading buffer,95℃变性10 min,按照总蛋白浓度一致的方案进行蛋白上样,丙烯酰胺凝胶电泳后,将蛋白转移至煮PVDF膜上,完成后利用5%脱脂奶粉中封闭1 h后加入相应的一抗,低温孵育过夜,第2天利用PBST清洗3遍后加入相应的二抗,室温孵育1 h后利用PBST清洗3次,ECL发光显示,对结果进行拍照分析。
1.5 流式细胞仪检测H157细胞凋亡率
细胞凋亡率的改变是细胞发生凋亡准确的检测指标,我们利用流式细胞术进行凋亡率的检测,具体步骤如下:药物作用完成后,收集细胞,利用PBS(预冷)清洗细胞中残留的培养液后,利用凋亡检测试剂盒分别加入取Annexin V-FITC和PI溶液,避光作用半个小时,利用流式细胞术进行荧光强度的检测。
1.6 统计学方法
流式细胞术和western blotting结果利用SPSS 15.0统计学软件进行分析,两组比较采用t检验的方法,3组及3组以上采用方差分析的方法,P<0.05表示具有统计学意义。
2 结果
2.1 Bortezomib对人非小细胞肺腺癌H157细胞存活率的影响
为首先明确bortezomib 对H157细胞存活率的影响,我们利用MTT方法检测了细胞存活率的改变。待细胞生长至对数期后传代分组,共分为4组:对照组,bortezomib 25 nm组,bortezomib 50 nm组,bortezomib 100 nm组,观察不同浓度bortezomib 对H157细胞存活率的影响。结果显示,与对照组相比较,不同浓度的bortezomib均可以引起细胞存活率的下降,差异具有统计学意义,通过比较不同浓度之间的吸光度值发现,bortezomib 对H157细胞增殖率的抑制具有明显的剂量依赖性,见表1。

表1 Bortezomib对人非小细胞肺腺癌H157细胞生存率的影响
*与Control相比较有统计学差异,P<0.05
2.2 Bortezomib引起凋亡相关蛋白表达水平的改变
上述结果呈现出,Bortezomib可以引起细胞存活率的下降,我们下一步需要明确凋亡是否参与了这个过程,我们利用western blotting的方法检测了3种凋亡相关蛋白的表达水平cleaved caspase-3、cleaved PARP、cytochrome C。结果显示出,不同浓度的Bortezomib可以明显的增加3种凋亡相关蛋白分子的表达,见图1。
2.3 Bortezomib引起H157细胞凋亡率的增加
为进一步明确凋亡的发生,我们利用流式细胞术进一步检测了H157细胞内凋亡率的改变,结果发现不同浓度的Bortezomib可以明显的增加H157细胞的凋亡率,差异具有统计学意义,见表2。
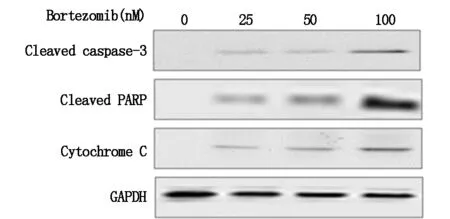
图1 Bortezomib对凋亡相关蛋白表达水平的影响

实验分组凋亡率(%)对照组3.80±1.124硼替佐米25 nM7.86±0.156*硼替佐米50 nM12.53±0.071*硼替佐米100 nM21.58±2.352*
*与Control相比较有统计学差异,P<0.05
2.4 糖酵解抑制剂2-DG对Bortezomib引起的细胞存活率下降的影响
研究显示,肿瘤细胞特殊的代谢方式有氧糖酵解在抗肿瘤药物中发挥了重要的作用,因此我们下一步利用糖酵解抑制剂检测其在Bortezomib诱导的细胞存活率下降中的作用。分为4组:对照组,2-DG组(5 mM),Bortezomib组(50 nM),Bortezomib+2-DG组。利用MTT方法检测细胞存活率的改变,结果发现与单独Bortezomib相比较,联合应用2-DG可以进一步增加Bortezomib引起的细胞存活率的下降,差异具有统计学意义,见表3。
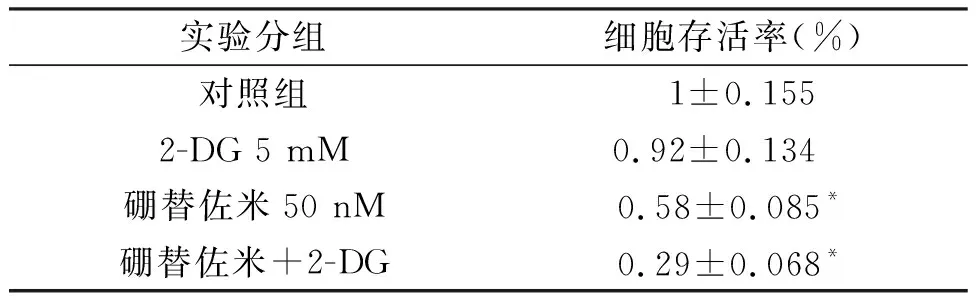
表3 2-DG对Bortezomib引起H157细胞生存率下降的影响
*与Control组比较,P<0.05;#与Bortezomib组,P<0.05
2.5 糖酵解抑制剂2-DG对Bortezomib引起的细胞凋亡率上升的影响
前面结果显示,联合2-DG可以进一步增加Bortezomib引起的细胞存活率的下降,我们利用流式细胞术进一步明确联合应用对细胞凋亡率的影响,结果发现,联合2-DG可以进一步增加Bortezomib引起的细胞凋亡率的增加,差异具有统计学意义,见表4。
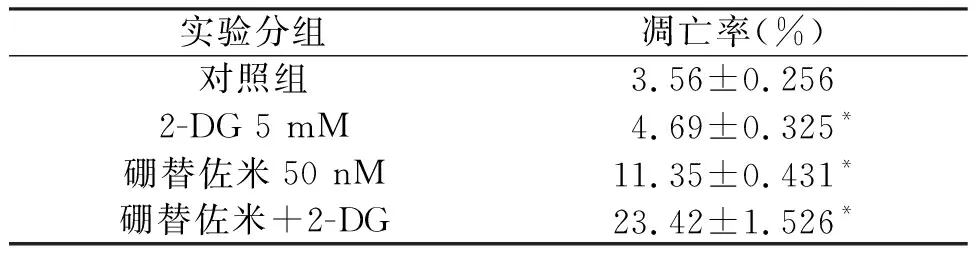
表4 2-DG对Bortezomib引起H157细胞凋亡率上升的影响
*与Control组比较,P<0.05;#与Bortezomib组,P<0.05
2.6 糖酵解抑制剂2-DG对Bortezomib引起的细胞相关蛋白表达水平的影响
在检测凋亡率的基础上,我们利用western blotting进一步检测了凋亡相关蛋白cleaved caspase-3和cleaved PARP表达水平的影响,结果发现,联合应用可以进一步增加Bortezomib引起的凋亡相关蛋白的表达,见图2。

图2 2-DG对Bortezomib引起的细胞相关蛋白表达水平的影响
3 讨论
泛素蛋白酶体介导了细胞内绝大多数的蛋白质降解过程,其通过介导蛋白质的降解参与细胞内很多生物学功能的调节,包括细胞周期,分化,死亡[10]。近来的研究表明,泛素蛋白酶体在肿瘤的发生发展中发挥了及其重要的作用,其通过调节肿瘤细胞增殖相关蛋白,凋亡相关蛋白,血管生成相关蛋白以及转移相关蛋白的降解,参与癌症的调控[11]。因此,围绕泛素蛋白酶体途径研发了相关的抑制剂,其中Bortezomib研发的最早,也是研究最为广泛的蛋白酶体抑制剂,能抑制26S蛋白酶体亚基的活性[12]。
为明确泛素蛋白酶体系统在非小细胞肺腺癌中的作用,我们利用Bortezomib和体外培养H157细胞检测了细胞存活率和凋亡的改变,研究结果发现,不同弄得的Bortezomib均可以引起细胞存活率的下降和凋亡率的上升,提示Bortezomib可以用来治疗非小细胞肺腺癌。大量的临床研究结果显示,长期使用一种化疗药物会引起肿瘤的耐药性的产生,如何克服这种耐药性,寻找新的联合治疗策略成为研究的热点和关键。
长期处于低氧和低营养的调节下,使得肿瘤细胞的代谢方式发生了改变,肿瘤细胞往往通过糖酵解的方式获得能量,即使在氧气充足的调节下,肿瘤细胞这种特殊的代谢为肿瘤细胞高的增殖速率提供支持。研究显示,靶向有氧糖酵解可以有效的增加抗肿瘤药物引起的细胞死亡[13]。有氧糖酵解是否参与了Bortezomib诱导的非小细胞肺腺癌细胞死亡还不是很清楚,因此我们利用糖酵解抑制剂2-DG对这个问题进行了探讨。研究结果发现,与单独使用Bortezomib相比较,联合糖酵解抑制可以进一步增加细胞存活率的下降和凋亡率的上升。
综上所述,蛋白酶体抑制剂Bortezomib可以诱导非小细胞肺腺癌细胞死亡,联合糖酵解抑制剂可以增加细胞死亡和凋亡的发生,研究结果为临床寻找新的治疗非小细胞肺腺癌的策略提供依据。

