紫娟茶原花青素的组分及活性评价
,, , ,,*,,*
(1.湖北工业大学,湖北武汉 430068; 2.江苏省茶叶研究所,江苏无锡 214000)
茶起源于中国西南地区,是世界范围内最流行,消费最广泛的饮料之一[1]。据报道,茶叶内含物质可以预防多种疾病,如心血管疾病疾病[1],癌症[2],抑郁症[3],并有助于减轻体重[4]。多酚作为茶叶中主要生物活性物质,被广泛报道在降低疾病风险方面发挥重要作用[5-6]。近年,来自植物中的多酚类化合物尤其是原花青素,因其独特的生物活性受到广泛关注[7-9]。原花青素是以黄烷-3-醇为基础单元,通过C4-C8或C4-C6键连接的一类多酚类化合物,分为单体,低聚,高聚原花青素[10]。复杂的结构和不同的组成赋予了原花青素多种生物和生化特性。其存在于植物的许多器官和组织,以增加抗病能力,强化植物组织和限制微生物生长[11-13]。这些特性不仅体现在对植物的保护,同样体现在对入体健康潜在的生物活性[14-16]。早在上世纪,研究入员就对茶叶中部分原花青素进行了初步研究[17],由于条件限制,目前研究者对不同茶叶尤其是特殊品种中茶叶内低聚及高聚原花青素组分及生物活性知之甚少。
紫娟是一种高花青素茶树品种,是中国西南大叶乔木古茶树的变种。茶树有紫色的芽,茎和叶子;淡紫色的果皮和花萼。据报道,紫娟提取物具有潜在的功效,如降血压、降血糖、减肥[18-19],抑菌[20],预防炎症[21]及治疗阿尔兹海默病[22]等。迄今为止,紫娟中关于原花青素的含量,组分结构和其在紫娟功效中所扮演的角色罕见报道。大量报道称,植物中的原花青素对α-淀粉酶具有较强的抑制活性,可以有效降低入体摄入葡萄糖的吸收率[23-25],具有成为糖尿病及减肥药物的潜力。因此,本研究提取纯化了紫娟花原花青素,测定了提取物中原花青素含量,采用UPLC-MS对紫娟原花青素组分进行鉴定,并评价其对α-淀粉酶的抑制活性。
1 材料与方法
1.1 材料与仪器
紫娟 采自江苏宜兴茶叶研究所玉山基地,经过蒸青处理后烘干粉碎,过60目筛,于-5 ℃保存备用;甲醇、香草醛、浓硫酸、乙醇、磷酸钠、氯化钠、甲腈、二硝基水杨酸;AB-8大孔树脂 上海一基实业有限公司;Sephadex LH-20 上海摩速科学器材有限公司;原花青素标准品 南京狄尔格医药科技有限公司;α-淀粉酶 ≥4000 U/g,上海阿拉丁生化科技股份有限公司;EGCG 湖南三为生物科技有限公司。
GZX-9023台式电热鼓风干燥箱 上海博讯实业有限公司;TD4C台式低速自动平衡离心机 盐城市凯特实验仪器有限公司;ME-T 分析天平 瑞士Mette公司;DK-320恒温水槽 上海精宏实验设备有限公司;FD-1A-80真空冷冻干燥机 上海豫明仪器有限公司;UV-2350紫外光分光光度计 尤尼科仪器有限公司;DL-720E超声波清洗机 上海之信仪器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;超高效液相色谱:Waters UPLC,检测器:WATERS ACQUITY PDA,色谱柱:BEH C-18 2.1 mm×50 mm 1.7 μm,飞行时间质谱器:WATERS SYNAPT MS,Masslynx4.1,质谱色谱管理软件。
1.2 实验方法
1.2.1 紫娟原花青素粗提取 称取紫娟样品10.00 g放入500 mL锥形瓶中[4],加入300 mL的70%丙酮溶液,超声20 min(功率300 W,频率40 kHz),重复2次,将提取液放入离心机中,以3000 r/min的速度离心20 min,合并提取液,旋转蒸发去除有机溶剂后,冷冻干燥,获得原花青素粗提物。
1.2.2 紫娟中原花青素粗提物纯化 用50 mL纯水将紫娟原花青素粗提物1.86 g溶解[4],将预处理好的树脂湿法装柱,以1.5 BV/h的速度让原花青素提取液通过大孔树脂柱至吸附饱和后,水洗至洗脱液为无色,用10%乙醇洗至洗脱液为无色,以去除部分杂质;再用70%丙酮洗脱,洗脱液经真空旋转蒸发浓缩、用水稀释、冷冻真空干燥后,制得原花青素精制品粉末,冷藏备用。
1.2.3 原花青素定量分析 利用香草醛-硫酸比色法对原花青素进行定量分析[4,8-11]。分别配制1 g/100 mL的香草醛-甲醇溶液及50%硫酸溶液,将二者按体积比1∶1充分混匀,得工作液(现配现用)。称取原花青素标准品,以甲醇溶解,分别配置成0.2,0.3,0.4,0.6,0.8,1.0,1.2 mg/mL的标准溶液,分别准确移取0.5 mL不同浓度的标准溶液于10 mL试管中,加入5 mL工作液,放入30 ℃的水浴锅中避光反应15 min后,取出静置至室温。以甲醇为空白对照,于497 nm波长处测定吸光度,绘制标准曲线。取10 mg原花青素精制品粉末,用甲醇溶解定容至50 mL,移取0.5 mL不同浓度的标准溶液于10 mL试管中,加入5 mL工作液,放入30 ℃的水浴锅中避光反应15 min后取出静置至室温,于497 nm波长处测定吸光度。
1.2.4 超高效液相色谱-质谱(UPLC-MS) 将1 g原花青素精制品粉末溶于30%甲醇,以1 BV/h的速度让原花青素溶解液通过Sephadex LH-20柱至吸附饱和后,然后在预处理的Sephadex LH-20柱上用30%甲醇处理4 h,用30%甲醇洗涤直至洗脱液变成无色,洗脱酚酸,糖苷等物质,吸附的多酚部分随后被70%丙酮水溶液(500 mL)洗脱,并旋转蒸发在真空下除去有机溶剂,冻干干燥。后准确称取10 mg样品,用甲醇溶解定容至10 mL(现配现用),采用UPLC-MS法对紫娟原花青素进行定性分析[4]。
色谱条件:色谱柱:ZORBAX SB-C18(4.6 mm×150 mm,5 μm);柱温:30 ℃;进样量:10 μL;流动相:水(A)和乙腈(B);流速:0.2 mL/min。梯度洗脱程序见表1。
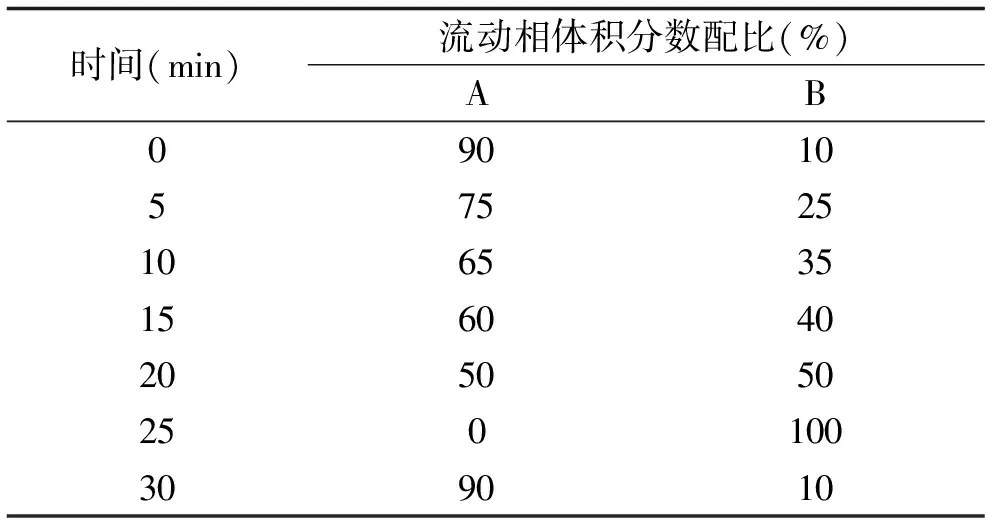
表1 洗脱梯度程序Table 1 Elution gradient procedure
质谱条件:电喷雾离子源,负离子模式;离子扫描范围m/z 200~1200;雾化气温度350 ℃;电喷雾电压-4000 V;源内碎裂电压135 V。
1.2.5α-淀粉酶抑制活性的测定 分别配制0.25 mL的0.02 mol/L磷酸钠缓冲液,0.5 mg/mLα-淀粉酶溶液和0.5 mL不同浓度的紫娟原花青素精制品溶液及EGCG溶液(0.4、0.8、1.2、1.6、2.0 mg/mL),在37 ℃下反应10 min[4]。反应后,在每个试管中加入0.5 mL的1%淀粉溶液,混合物在37 ℃下反应10 min,反应用1.0 mL二硝基水杨酸试剂停止,然后将试管放入沸水浴中5 min并冷却至室温。反应混合物加入10 mL蒸馏水,采用紫外-可见分光光度计在540 nm测量。将阿卡波糖磨成粉末采用超声法制成溶液作为对照。应用下列公式计算对α-淀粉酶的抑制活性。
I(%)=(V空白-V样品)/V样品×100
式中:I为抑制剂对α-淀粉酶的抑制率(%),V空白为未添加抑制剂的空白实验组反应速度(mg/min);V样品为添加了待测抑 制剂样品的反应速度(mg/min)。
1.3 数据统计分析
每个样品设3个平行,采用Origin 8.0和SPSS 20.0软件进行数据分析。测定结果以平均值±标准差表示。实验数据采用ANOVA进行邓肯氏(Duncan’s)差异分析,以p<0.05为差异显著。
2 结果与分析
2.1 紫娟原花青素定量分析
从紫娟中提取出原花青素粗制品如1.2.1所述,提取率为18.6%(干重)。使用AB-8大孔吸附树脂柱进一步纯化紫娟原花青素,得到1.18 g精制品。以A497值(Y)和原花青素标准品浓度(X)作回归方程为:y=8.7363x+0.4248,R2=0.9993。紫娟原花青素精制品以此标准曲线测定(图1),纯度达93%,表明紫娟茶中含有大量原花青素。
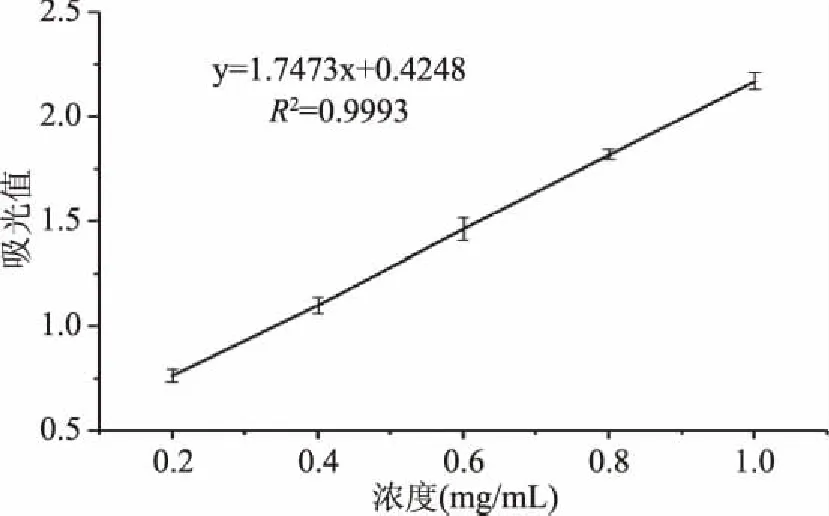
图1 原花青素分光光度标准曲线Fig.1 Curve of spectrophotometric spectrophotometry
2.2 紫娟原花青素的UPLC-ESI-MS分析
紫娟原花青素UPLC色谱图如图2所示,通过UPLC-ESI-MS在负离子模式下分析,结果总结在表2中。在紫娟原花青素中,至少有3种单体和7种原花青素低聚物被检测并鉴定。相较于聚合的原花青素,单体原花青素(也被称为儿茶素,如:C,EC,GC,EGC,ECG,EGCG)更加丰富。原花青素单体主要由表没食子儿茶素没食子酸酯(EGCG),表儿茶素没食子酸酯(EGC)和表没食子儿茶素(ECG)组成,其相对分子质量为458和442。原花青素单体还包括(+)-儿茶素(C),(-)-表儿茶素(EC)和没食子儿茶素(CG),其相对分子质量为290和 306,这些单体相应的准分子离子[M-H]-m/z分别为:457,441,289,305。各单体通过C4-C6或C4-C8键相连,形成二聚体、三聚体、四聚体等多聚体。

图2 紫娟原花青素精制品的超高效液相色谱图Fig.2 Zijuan proanthocyanidins products by ultra-high performance liquid chromatography
对单体来说,二聚体的分离比较困难,其对应的质谱数据也较复杂,除推断出准分子离子外,还必须提供了一系列碎片离子信息。从表2中m/z 761,m/z 745,m/z 729,m/z 865,m/z 881,m/z 609和m/z 593的质谱数据可以得出,二聚体至少有7种,保留时间分别为 4.46、6.39、7.28、7.50、8.53、8.62、9.40,根据准分子离子数据,推断这些二聚体均为B型原花青素二聚体,并且有6种属于酯、棓型二聚体原花青素,与许多传统原花青素提取植物如葡萄籽相比,如此多种类的酯、棓型二聚体原花青素是罕见的。以下是原花青素在质谱中裂解的主要模式。
原花青素聚合体的碎裂方式主要包括黄烷醇间连接键的断裂(QM)、逆狄尔斯-阿德(RAD)反应和杂环裂解(HRF)反应。HRF反应为聚合体失去1个相对分子质量126的中性分子。RAD反应是黄烷醇C-环上发生断裂,失去1个相对分子质量为152的中性的结构(C8H8O3)。黄烷醇间断裂(QM)有2种可能,一种是失去仅以C4键与其他单元相连顶部单元T-unit(TOP)中性碎片,形成m/z为288的离子;另一种可能是失去以C6或C8键与其他单元相连的底部单元B-unit(BASE),形成m/z为290的碎片片段。
2.2.1 二聚体m/z 761结构解析 由表2可知,m/z 761二级质谱碎片离子为125,305,423,591。碎片离子m/z 591为m/z 761通过RAD反应裂解产生m/z 609,m/z 609进一步脱水生成m/z 591;碎片离子m/z 423为m/z 761通过RAD 反应裂解产生m/z 609,m/z 609通过RAD 反应裂解产生m/z 441,进一步脱水生成m/z 423;碎片离子m/z 305为m/z 761通过RAD 反应裂解产生m/z 609,m/z 609发生QM裂解类黄酮连接键产生的;碎片离子m/z 125为HRF反应为聚合体失去的中性分子。可推测其结构为(E)GC-(E)GCG二聚体,其同分异构体共4种,结构式如图3所示。
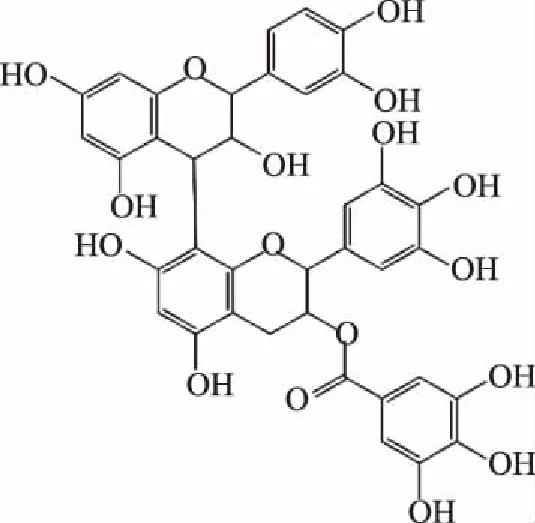
图3 二聚体m/z 761可能结构式Fig.3 Dimer m/z 761 possible structural formula
2.2.2 二聚体m/z 745结构解析 由表2可知,m/z 745二级质谱碎片离子为169,407,423,593。碎片离子m/z 593为m/z 745通过RAD反应裂解产生m/z 593;碎片离子m/z 423产生方式同上;m/z 407为m/z 745通过RAD反应裂解产生m/z 593,m/z 593的T单元发生RDA裂解产生m/z 425,由m/z 425中B环相邻酚羟基脱水产生。可推测其结构为(E)CG-(E)GC二聚体,其同分异构体共4种,结构式如图4所示。
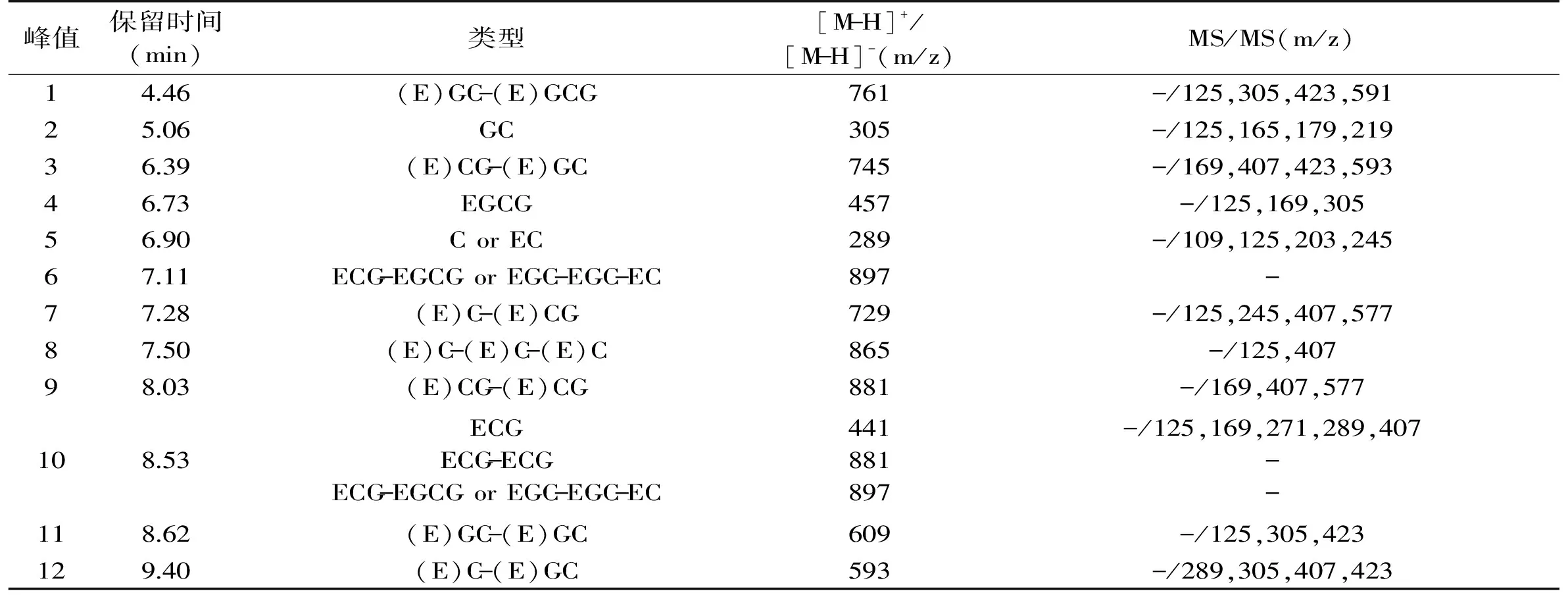
表2 紫娟原花青素的分析Table 2 Analysis of proanthocyanidin from Zijuan
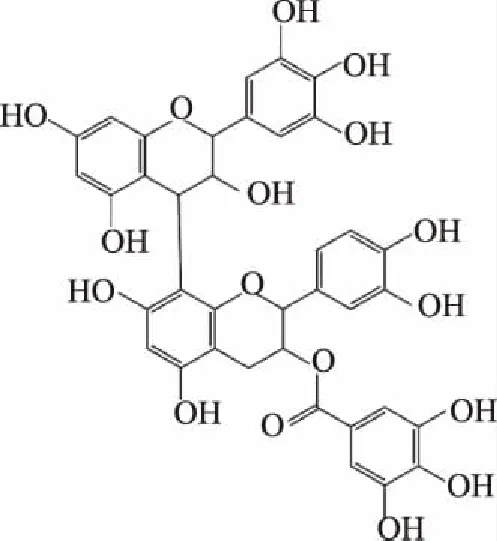
图4 二聚体m/z 745可能结构式Fig.4 Dimer m/z 745 possible structural formula
2.2.3 二聚体m/z 729结构解析 由表2可知,m/z 729二级质谱碎片离子为125,245,407,577。碎片离子m/z 577为m/z 729通过RAD反应裂解产生m/z 577;m/z 407为m/z 729通过RAD 反应裂解产生m/z 577,m/z 577的T单元发生RDA裂解产生m/z 425,由m/z 425中B环相邻酚羟基脱水产生。m/z 245由m/z 729发生QM裂解产生碎片离子m/z 289,后脱二氧化碳产生;可推测其结构为(E)C-(E)CG二聚体,其同分异构体共4种,结构式如图5所示。

图5 二聚体m/z 729可能结构式Fig.5 Dimer m/z 729 possible structural formula
2.2.4 三聚体m/z 865结构解析 由表2可知,m/z 865二级质谱碎片离子为125,407。m/z 407是由原花青素三聚体分子离子m/z 865发生QM裂解产生碎片离子m/z 577,m/z 577发生RDA裂解生成m/z 425再脱水生成m/z 407;碎片离子m/z 125为HRF反应为聚合体失去的中性分子。可推测其结构为三单元儿茶素或表儿茶素三聚体,其同分异构体共8种,如图6所示。
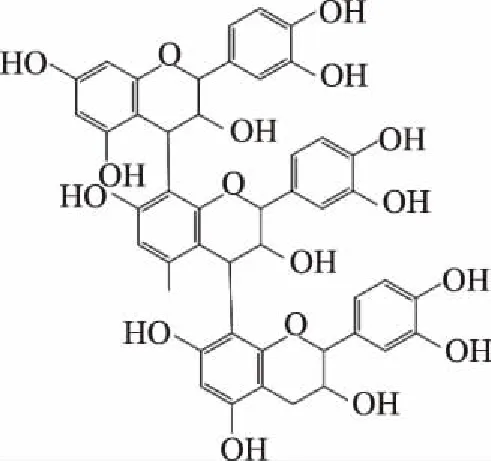
图6 三聚体m/z 865可能结构式Fig.6 Dimer m/z 865 possible structural formula
2.2.5 二聚体m/z 881结构解析 由表2可知,m/z 881二级质谱碎片离子为169,407,577。m/z 577是由原花青素二聚体分子离子m/z 881发生QM裂解产生碎片离子m/z 577,m/z 407是由m/z 577发生RDA裂解生成m/z 425再脱水生成。可推测其结构为ECG-ECG,如图7所示。
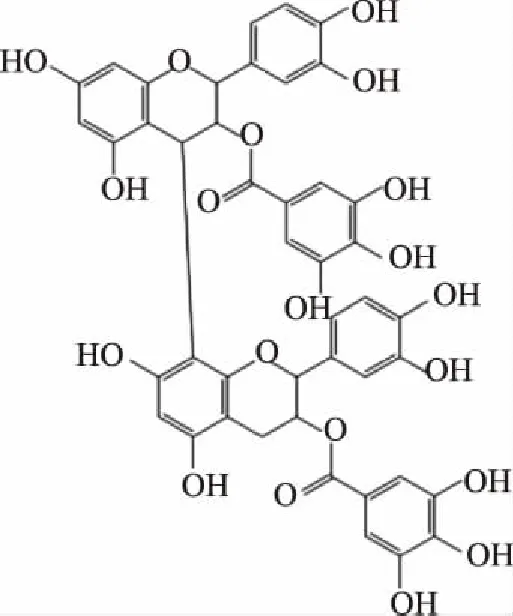
图7 二聚体m/z 881可能结构式Fig.7 Trimer m/z 881 possible structural formula
2.2.6 二聚体m/z 609结构解析 由表2可知,m/z 609二级质谱碎片离子为125,305,423。碎片离子m/z 423为m/z 609通过RAD 反应裂解产m/z 441,进一步脱水生成m/z 423;m/z 305是由m/z 609发生QM裂解类黄酮连接键产生的;碎片离子m/z 125为HRF反应为聚合体失去的中性分子。可推测其结构为(E)GC-(E)GC,如图8所示。
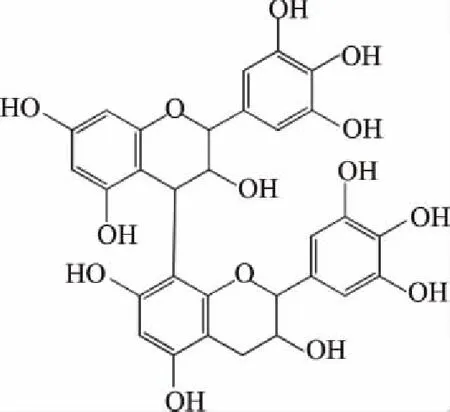
图8 二聚体m/z 609可能结构式Fig.8 Trimer m/z 609 possible structural formula
2.2.7 二聚体m/z 593结构解析 由表2可知,m/z 593二级质谱碎片离子为289,305,407,423。碎片离子m/z 423为m/z 593通过RAD 反应裂解产m/z 441,进一步脱水生成;;m/z 441是由 m/z 593的B单元发生RDA裂解产生,m/z 425由 m/z 593的T单元发生RDA裂解产生;m/z 423由m/z 441中B环相邻酚羟基脱水产生;m/z 289与305是由m/z 593发生QM类黄酮连接键产生的。可推测其结构为(E)C-(E)GC,如图9所示。
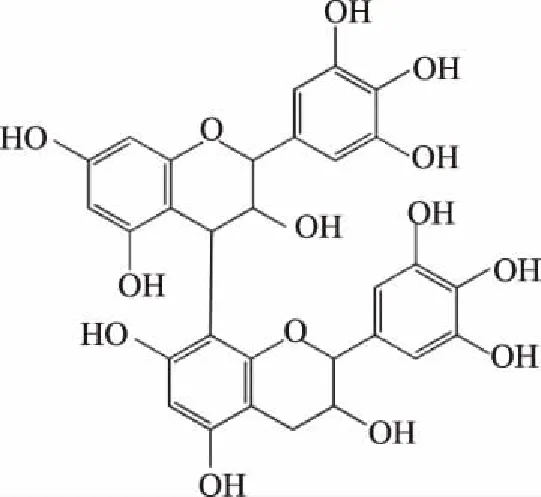
图9 二聚体m/z 593可能结构式Fig.9 Trimer m/z 593 possible structural formula
对于分子量大于1000的原花青素,很难进行准确的定性分析,质谱图中各个聚合物的分子离子峰的强度并不一定真实的反映聚合物分子在原花色素混合物中的组成情况,这是因为不同结构的原花色素离子化效率不同,分子量较小的聚合物离子化后的产物更快到达检测器,从而使得混合物中相同比例的小分子和高分子没有相等的离子峰强度,高分子甚至不出峰[26]。
2.3 紫娟原花青素精制品对α-淀粉酶活性的抑制效果
原花青素,EGCG和阿卡波糖对α-淀粉酶抑制效果如图10所示,原花青素,阿卡波糖和EGCG对α-淀粉酶的IC50值分别为(0.7±0.02)、(0.9±0.01)、(2.0±0.01) mg/mL。所有样品的抑制率都随着浓度的增加而增加。在测试样品中原花青素体现了与阿卡波糖类似的抑制活性。EGCG较原花青素精制品和阿卡波糖相比效果较差,根据UPLC液相图谱及文献[5,9],我们可以推断EGCG是原花青素中最主要的成分,据文献[4,8-11]报道原花青素单体对α-淀粉酶抑制效果较弱,多聚原花青素抑制活性要高于原花青素单体,由此我们可以推测多聚原花青素α-淀粉酶活性抑制效果要高于原花青素单体,并有潜力可以取代阿卡波糖成为新型治疗糖尿病的药物,但是本次为体外实验,考虑到入体吸收,体内环境及多种因素,后续可以进行更为详尽的实验。
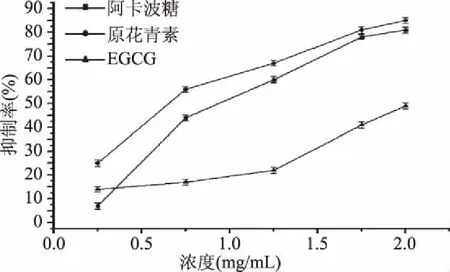
图10 阿卡波糖、EGCG和原花青素精制品抑制活性比较图Fig.10 Comparison of inhibitory activity of acarbose,EGCG and procyanidins
3 结论
紫娟茶中含有大量的原花青素,有3种单体和7种原花青素低聚物被检测并鉴定,绝大多数是酯、棓型原花青素二聚体。相较于聚合的原花青素,单体原花青素更为丰富。原花青素对α-淀粉酶抑制作用随浓度而增大。本研究结果表明,从紫娟中分离出的原花青素具有有效的α-淀粉酶抑制活性,较传统药物阿卡波糖有更好的抑制效果,有成为抗糖尿病及减肥药物的潜力。

