丝胶抗冻肽在大肠杆菌中的重组表达及其抗冻活性初探
, ,吴鸿,*,, ,
(1.上海交通大学农业与生物学院,上海 200240; 2.福州大学生物科学与工程学院,福建福州 350108)
丝胶是一种蚕丝产生的水溶性蛋白质[1]。研究表明,来源于丝胶的多肽具有抗氧化[2]、抗肿瘤、抗衰老[3]和抗菌等作用。在最近的研究中,丝胶及其多肽已被证明具有结合冰的能力,这种特性使丝胶具有特殊的抗冻活性[4],在冷冻食品加工与储藏[5-6]、细胞保藏、抗冻农作物栽培、渔业养殖、器官移植和冷冻手术等领域开发中具有广阔的商业应用前景。
食品在冷冻、储存、运输和冻融过程中产生的冰晶生长和重结晶问题,是制约冷冻产品品质的关键[7],因此如何控制冰晶的生长和重结晶是保持或提高冷冻食品品质迫切需要解决的技术难题。天然分离纯化所得到的产物数量微少而且成本高昂,严重制约了天然抗冻蛋白在食品领域的研究和应用[8]。目前已经有相关研究在抗冻肽的结构和功能研究基础上,探索通过应用现代生物技术,采用化学合成和基因工程生物表达的方法进行抗冻肽的制备[9-12]。Tsujimoto等[13]发现一种外源基因表达的丝胶肽对细胞和蛋白质有冷冻保护作用。张党权等[14]以pET-11a为载体构建了胡萝卜抗冻蛋白非融合表达的重组质粒,并在大肠杆菌菌株BL21(DE3,pLysS)中成功地进行了高效表达。生物学活性研究[15-16]表明,重组表达的抗冻蛋白具有很强的热滞活性和提高细菌耐寒性的作用。
本文通过基因工程方法,成功构建了一种丝胶抗冻肽在大肠杆菌中的重组表达系统,并对其抗冻活性进行研究,为今后实现新型抗冻肽在冷冻食品加工中的应用提供新的理论参考与技术指导。
1 材料与方法
1.1 材料与仪器
Pet32a载体 上海少辛生物科技有限公司;DH5α菌株,大肠杆菌BL21(DE3) 生工生物工程(上海)股份有限公司;LB肉汤培养基 青岛高科技工业园海博生物技术有限公司;限制性内切酶KpnI/XhoI 生工生物工程(上海)股份有限公司;质粒提取试剂盒 杭州宝赛生物科技有限公司;DNA Marker 上海少辛生物科技有限公司;氨苄青霉素 南京凯基生物科技发展有限公司;IPTG 美国AMRESCO公司;Ni Sepharose High Performance填料 GE Healthcare公司;预染蛋白Marker Page Ruler Prestained Protein Ladder 美国Thermo公司;Anti-6×His多克隆兔抗体 HRP-conjugated Goat Anti-Rabbit IgG 生工生物工程(上海)股份有限公司;BCA蛋白浓度测定试剂盒 上海碧云天生物技术公司。其他试剂均为国产分析纯。
恒温培养摇床 上海一恒科技有限公司;手提式压力蒸汽灭菌器 上海申安医疗器械厂;EPS300电泳仪,VE186转移电泳槽 上海天能科技有限公司;微生物生长曲线自动分析仪 芬兰Bioscreen公司;低温生物冷冻冻干台 英国林克曼科学仪器公司;CCD摄像机 美国Roper Scientific公司。
1.2 实验方法
1.2.1SerD丝胶肽表达质粒的构建SerD是一种含有76个氨基酸的两个重复序列的丝胶肽。SerD的氨基酸和相应的DNA序列列于表1。
含有KpnI和XhoI酶切位点序列的SerD全长DNA由生工生物工程(上海)股份有限公司合成。将SerD基因插入经KpnI和XhoI酶切过的Pet32a载体中,获得的质粒被命名为Pet32a-SerD。将该质粒转化到DH5α菌株中进行增殖。然后从DH5α阳性菌株中提取Pet32a-SerD质粒,并经KpnI/XhoI酶切和DNA测序进行鉴定。
1.2.2 大肠杆菌表达载体的电击转化 通过热冲击将Pet32a-SerD质粒转化入大肠杆菌表达宿主BL21(DE3)中。取1.0 μL重组的Pet32a-SerD质粒转化BL21(DE3)菌株,42 ℃热击90 s,冰上静置5 min。取适量菌液涂布于含有100 μg/mL氨苄青霉素的LB琼脂平板上,37 ℃培养1~2 d,进行转化平板的筛选和阳性质粒转化菌株的确定。筛选获得的阳性质粒转化菌株命名为BL21-SerD。挑取转化后平板上的单菌落于试管中,37 ℃、220 r/min培养12 h。提取阳性转化质粒,采用KpnI/XhoI双酶切鉴定目的基因的表达,并将重组质粒送上海美吉生物医药科技有限公司测序鉴定。
使用同样条件转化空载体Pet32a质粒并于LB琼脂平板上进行培养,作为空载体阴性对照,筛选的阴性菌株命名为PBL空载菌。
1.2.3 His-SerD融合蛋白的表达、纯化和免疫印迹分析 从含有100 μg/mL氨苄青霉素的琼脂平板上挑选阳性单克隆菌落,接种到含有100 μg/mL氨苄青霉素的4 mL LB培养基中,在37 ℃下震荡孵育过夜12 h。按1∶100的比例将上述培养基接种到含有100 μg/mL氨苄青霉素的4 mL LB培养基中,继续在37 ℃孵育,当在600 nm下的光密度达到0.6时,加入终浓度为0.5 mmol/L的IPTG。将上述培养基在20 ℃下220 r/min震荡孵育16 h,然后6000 r/min,4 ℃离心10 min收集菌体细胞,并重悬于裂解缓冲液中(2 mol/L尿素,50 mmol/L Tris,300 mmol/L NaCl,1 mmol/L DTT,0.01%溶菌酶,0.2% TritonX-100,pH8.0)。在冰浴中超声裂解细胞,功率为400 W,共20 min(工作3 s,间隔5 s)。然后在12000 r/min,4 ℃离心10 min,上清液做进一步纯化。
将上述细胞上清液直接加载到HisSep Ni-NTA琼脂糖柱。经洗涤缓冲液(2 mol/L尿素,50 mmol/L Tris,300 mmol/L NaCl,10 mmol/L咪唑,pH8.0)洗柱后,用洗脱缓冲液梯度洗脱His-SerD融合蛋白(2 mol/L尿素,50 mmol/L Tris,300 mmol/L NaCl,咪唑浓度梯度分别为20 mmol/L、40 mmol/L、60 mmol/L,pH8.0),流速均为2 mL/min,收集洗脱液。经BCA蛋白浓度测定试剂盒测定其蛋白浓度后,利用SDS-PAGE鉴定His-SerD融合蛋白的纯化洗脱浓度。
取40 μL纯化后的蛋白样品,加入10 μL 5×电泳上样缓冲液,在100 ℃沸水浴5 min,12000 mmol/L离心2 min,然后进行SDS-PAGE(12%聚丙烯酰胺凝胶)。随后在4 ℃下90 min转移到聚偏氟乙烯膜。转膜完成后用含5%脱脂牛奶的PBS+吐温-20(PBST)封闭膜,然后用Anti-6×His多克隆兔抗体在37 ℃下孵育60 min。经PBST洗膜三次后,用HRP-conjugated Goat Anti-Rabbit IgG二抗孵育60 min。利用增强型化学发光观察目标印记片段。
1.2.4 His-SerD融合蛋白的抗冻活性分析
1.2.4.1 表达His-SerD融合蛋白的大肠杆菌冷冻后生长曲线的测定 选择BL21-SerD诱导重组菌和PBL空载菌为研究对象,进行抗冷冻胁迫活性功能的研究。在上述表达条件下培养待测菌株,至稳定生长初期,6000 r/min,4 ℃,10 min,离心收集菌体细胞。与培养基等量的超纯水重悬菌体细胞,制备菌悬液。分别取10 mL样品菌悬液置于-20 ℃冷冻9 d后取出,37 ℃解冻10 min,然后进行冷冻胁迫后的活性测定。首先利用超纯水调整PBL空载菌与BL21-SerD诱导重组菌的OD值接近,然后分别取1 mL菌悬液与灭过菌的含100 μg/mL氨苄青霉素的LB液体培养基按1∶2的浓度制备最终样品,充分震荡后取200 μL样品于微生物100孔板中,每个样品平行对照三组。采用微生物生长曲线自动分析仪测定样品的生长曲线。检测温度37 ℃,波长600 nm,静置检测,周期为48 h,平均每2 h检测一次。
1.2.4.2 重结晶抑制活性的测定 在两盖玻片之间加入5 μL PBS缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,pH8.0)作为对照,或含0.53 mg/mL His-SerD融合蛋白的PBS缓冲液样品。采用低温台以液氮供冷的方式对盖玻片上的样品进行冻结,并连接一个配备CCD摄相机的Olympus BX41显微镜。样品以30 ℃/min的速度快速冷却到-50 ℃,在此温度下维持1 min,再以30 ℃/min的速度升温到-6 ℃,在此温度下维持30 min。在此期间,以1280×1024像素进行显微拍摄,具体的拍摄时间间隔为10 min。通过记录在不同冷冻时间下冰晶的大小和数量的变化测定His-SerD融合蛋白对冰重结晶的影响。
1.3 数据处理
以上实验均重复3次,结果以平均值±标准差表示。利用Origin作图软件,并采用SPSS分析数据显著性。
2 结果与分析
2.1 Pet32a-SerD重组质粒的构建及鉴定
SerD的基因长度为258 bp,包括ORF基因228 bp,限制性内切酶位点12 bp,肠激酶位点15 bp和终止子3bp。合成的SerD基因的目标DNA长度约为250 bp(图1)。用KpnI和XhoI酶切PCR产物及载体Pet32a,然后经连接获得重组质粒Pet32a-SerD。为了鉴定SerD基因是否插入到Pet32a中,利用特定的限制性内切酶KpnI和XhoI双酶切Pet32a-SerD,并进行DNA测序。KpnI和XhoI的双酶切结果表明SerD基因含有目标DNA条带(图2)。利用NCBI BLAST工具进行DNA测序,Pet32a-SerD的DNA序列为BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)。DNA测序结果表明,阳性菌落质粒与目的基因密码子核苷酸序列吻合度达到100%,即Pet32a-SerD的DNA序列与SerD基因完全匹配(图3)。上述鉴定结果均一致表明,根据之前的设计目的基因已成功重组到Pet32a中。
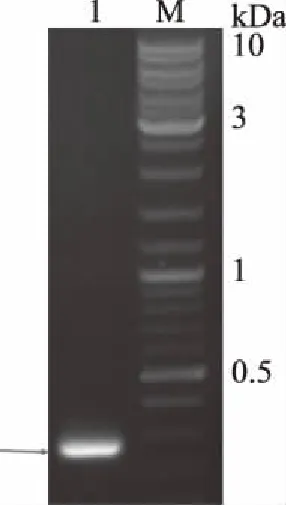
图1 SerD基因片段Fig.1 Target fragments of SerD gene注:1表示SerD基因片段;M表示#SM331 GeneRuler DNA Ladder Mix。
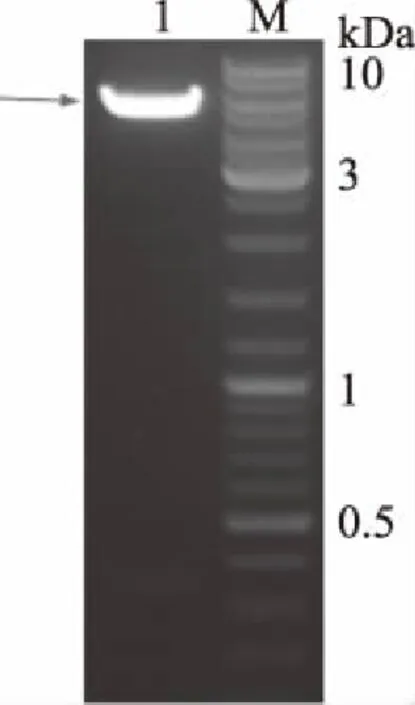
图2 Pet32a-SerD重组质粒的双酶切鉴定Fig.2 Identification of recombinant plasmid Pet32a-SerD by double-enzyme digestion注:1表示Pet32a;M表示GeneRuler DNA Ladder Mix。

图3 Pet32a-SerD重组质粒的DNA测序Fig.3 DNA sequencing of recombinant plasmid Pet32a-SerD
2.2 His-SerD融合蛋白的诱导、表达和纯化
将Pet32a-SerD质粒转化到表达宿主BL21(DE3)中,获得重组菌BL21-SerD。采用两种不同的诱导条件(20 ℃,6 h和37 ℃,4 h)优化His-SerD融合蛋白的表达。经IPTG诱导后,将细胞裂解并溶于PBS缓冲液中,利用SDS-PAGE检测重组蛋白。在SDS-PAGE结果中(图4),可观察到经诱导表达的重组菌电泳通道处有明显条带出现,而在相同位置处,未诱导菌全液处未见明显条带,该结果证明 His-SerD融合蛋白在重组菌中表达成功。此外,还可以进一步判断得到在20 ℃下诱导16 h比37 ℃诱导4 h更有效(图4)。对最优诱导表达条件下的重组菌再次进行SDS-PAGE检测,结果表明,表达的重组蛋白的分子量在25~35 kDa(图5a),这是因为在His-SerD融合蛋白中,除了SerD肽(~10 kDa)之外,还有Trx标记(~12 kDa),His标记(~1 kDa),S标记(~2 kDa),肠激酶酶切位点(~1 kDa)和凝血酶酶切位点(~1 kDa)。Western blot证明了His-SerD融合蛋白的表达(图5b)。
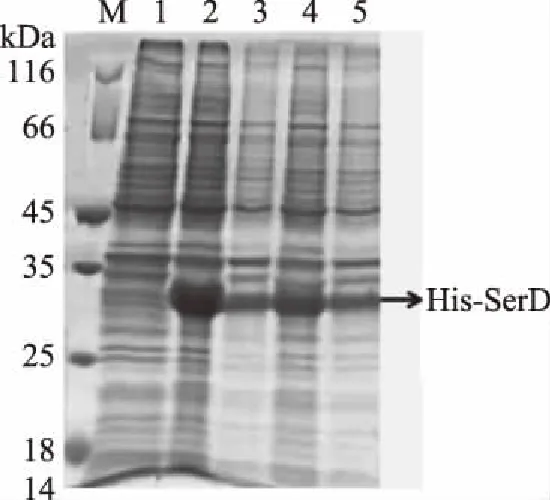
图4 SDS-PAGE优化His-SerD融合蛋白的表达条件Fig.4 SDS-PAGE optimized expression conditions of His-SerD fusion protein注:M表示Protein Marker;1表示未诱导菌全液; 2表示20 ℃诱导菌上清液;3表示20 ℃诱导菌沉淀; 4表示37 ℃诱导菌上清液;5表示37 ℃诱导菌沉淀。

图5 SDS-PAGE(a)和Western blot(b)鉴定His-SerD融合蛋白的表达Fig.5 SDS-PAGE(a)and Western blot(b) identified the expression of His-SerD fusion protein
采用镍琼脂糖亲和层析纯化大肠杆菌表达的His-SerD融合蛋白,确定咪唑的洗脱浓度。SDS-PAGE鉴定洗脱液中的His-SerD融合蛋白,比较20、40和60 mmol/L咪唑洗脱,His-SerD融合蛋白的条带清晰度及显著度依次增加,故目标蛋白的最佳洗脱浓度为60 mmol/L咪唑的洗脱缓冲液(图6)。
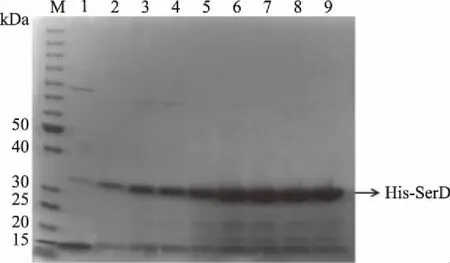
图6 SDS-PAGE鉴定His-SerD融合蛋白的纯化洗脱液浓度Fig.6 SDS-PAGE identified the concentration of purified elution buffer for His-SerD fusion protein注:M表示Protein Marker;1表示20 mmol/L咪唑的洗脱缓冲液;2~4表示40 mmol/L咪唑的洗脱缓冲液;5~9表示60 mmol/L咪唑的洗脱缓冲液。
2.3 表达His-SerD融合蛋白的大肠杆菌冷冻后的生长曲线
经过冷冻胁迫处理后菌体细胞的生长速率是评价细胞冷冻胁迫抗性的一个指标[17-18]。选取BL21-SerD诱导重组菌和PBL空载菌作为研究对象,对待测菌株重培养过程中细胞的生长情况进行了测定。冷冻胁迫处理后,两个研究对象表现出了一定的生长速率差异。具体结果如图7所示,在-20 ℃经过9 d的低温冷冻胁迫处理后,胞内表达His-SerD融合蛋白的大肠杆菌菌株(BL21-SerD)复苏后的生长活性明显高于未表达His-SerD融合蛋白的大肠杆菌菌株(PBL)。在对数生长后期,未表达His-SerD融合蛋白的大肠杆菌菌株(PBL)的生长速率也明显减缓。上述结果表明,His-SerD融合蛋白的表达可以提高菌株细胞抗冷冻胁迫性的作用。这对提高冷冻胁迫后菌体细胞的活力特别是改善工业生产中因起始菌株的低温保藏造成的生产效率的下降具有重要意义。
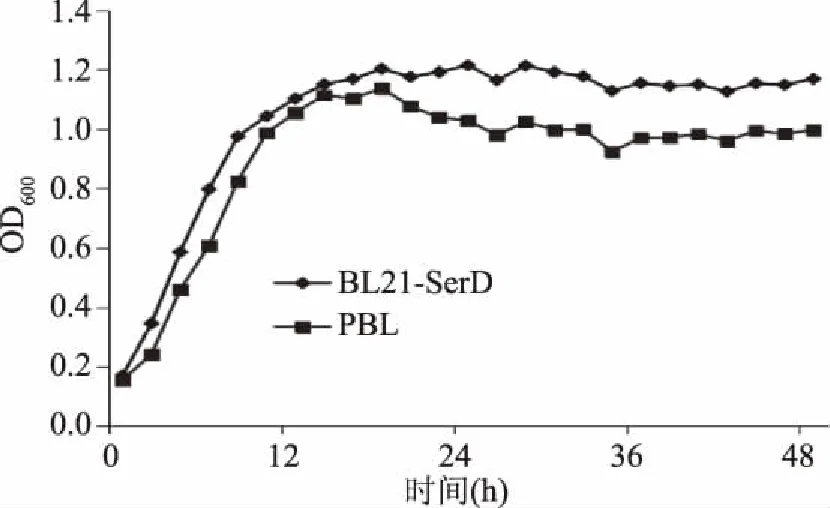
图7 冷冻胁迫后大肠杆菌的生长曲线Fig.7 Growth curve of E.coli after freezing stress
2.4 His-SerD融合蛋白的重结晶抑制活性
在冻结的生物组织和冷冻食品中发现的冰重结晶,是一个较小冰晶长成较大冰晶的过程,进而导致细胞内冰晶的形成和生长,这通常会对组织具有不利的影响[19-20]。在冷冻溶液中添加可以抑制冰重结晶、维持小冰晶形态的抗冻肽,具有巨大的医疗、商业和工业应用价值[21-22]。通过观察添加或不添加His-SerD融合蛋白的冷冻PBS缓冲液中冰晶的大小和形状来证明His-SerD融合蛋白具有抑制冰重结晶的能力。研究结果表明,在30 min孵育期间,与对照PBS溶液中形成的大且圆形的冰晶相比,在含0.53 mg/mL His-SerD融合蛋白的溶液中形成的冰晶具有更小的和更不规则的形状(图8)。因此,研究结果证明His-SerD融合蛋白的添加明显降低了冰晶颗粒的大小,表明其具有较好的重结晶抑制效果。

图8 His-SerD融合蛋白的重结晶抑制效果分析图Fig.8 Analysis of recrystallization inhibition effect of His-SerD fusion protein
3 结论
本文通过基因工程方法,成功构建了一种丝胶抗冻肽(SerD)在大肠杆菌中的重组表达系统。研究结果表明,His-SerD融合蛋白的表达适宜条件为20 ℃下诱导16 h;SDS-PAGE和Western-Blot鉴定His-SerD融合蛋白表达的分子量在25~35 kDa之间;His-SerD融合蛋白在镍琼脂糖亲和层析纯化分离过程中最佳的洗脱浓度为60 mmol/L咪唑浓度的洗脱缓冲液。经过9 d的-20 ℃低温冷冻胁迫处理后,胞内表达His-SerD融合蛋白的大肠杆菌菌株BL21-SerD复苏后的生长活性明显高于PBL空载大肠杆菌。此外,His-SerD融合蛋白的添加明显降低了溶液中冰晶颗粒的大小,表现出较好的重结晶抑制效果。以上研究结果表明,His-SerD融合蛋白具有抗冷冻胁迫保护作用,在冷冻食品加工中具有一定的应用前景。

