超声预处理时间对金枪鱼皮酶解过程ACE抑制肽释放的影响
,, ,,,,,,*
(1.西南大学食品科学学院,重庆 400715; 2.邯郸学院生命科学与工程学院,河北邯郸 056005; 3.渤海大学食品科学与工程学院,辽宁锦州 121013)
许多食源性多肽具有血管紧张素转化酶(ACE)抑制活性,可竞争性结合ACE活性部位的Zn2+,有降压作用[1],且ACE抑制肽食用安全性高,无毒副作用,对正常血压没有影响[2],具有较广阔的市场前景。目前已经从乳蛋白、玉米蛋白、明胶等食物蛋白中提取出很多种ACE抑制肽[3-6]。金枪鱼是一种重要的世界经济鱼类,营养丰富,通常只选取其鱼肉进行加工,而鱼皮作为副产品没有被充分利用,造成很大的资源浪费。金枪鱼皮富含胶原蛋白,可用作ACE抑制肽的良好来源。因为胶原蛋白的三螺旋区域富含羟脯氨酸(Hyp)或脯氨酸(Pro),因此来自于胶原三螺旋区的肽段C末端多含有Pro,当脯氨酸在C末端的任一位置时,均有很强的降压活性[7];此外,Hyp可催化ACE抑制肽与ACE结合。但胶原蛋白的三螺旋结构非常稳定,除了金属蛋白酶,普通蛋白酶很难进入其结构内部,很难接触活性位点,释放高ACE抑制活性肽段较难,因而需在酶解前进行预处理,使其三螺旋结构松散,酶切位点暴露。传统预处理如热处理、碱液处理等方式操作耗时长,效率低,如以鱿鱼皮[8]、鳕鱼皮[9]等制备胶原ACE抑制肽,酶解前热处理时间分别长达24、30 h,从而需要寻找更高效的预处理方式,使鱼皮ACE抑制肽的释放效率提高。
本研究利用前期优化的条件制备金枪鱼皮ACE抑制肽,对金枪鱼皮超声预处理后再进行酶解,研究不同超声预处理时间下金枪鱼皮ACE抑制肽的释放过程,并通过红外光谱、热稳定性分析超声处理的鱼皮胶原蛋白的结构,旨在明确超声预处理对金枪鱼皮酶解过程ACE抑制肽释放影响的机制。
1 材料与方法
1.1 材料与仪器
金枪鱼皮 山东中鲁远洋(烟台)食品有限公司;蛋白酶K:30 U/mg 美国Sigma公司;血管紧张素转化酶(ACE)、N-乙酰半胱氨酸(NAC)、邻苯二甲醛(OPA)、L-谷胱甘肽 美国Sigma公司;ACE底物(ABZ-Gly-Phe(NO2)-Pro) Bachem公司。
Multifuge X3R型冷冻离心机 美国Thermo公司;KQ-100B型超声波清洗器 昆山超声仪器有限公司;JY92-IIN型超声波细胞粉碎机 宁波新芝生物科技公司;LC-20A高效液相色谱 岛津公司;Spectrum 100红外光谱 美国PerkinElmer公司;Power PacTM基础电泳仪 美国Bio-Rad公司;Pyris4000差示量热扫描仪 美国PerkinElmer公司。
1.2 实验方法
1.2.1 金枪鱼皮超声预处理 根据文献[13]方法处理金枪鱼皮,解冻后称取2 g,加入0.1 mol/L的磷酸盐缓冲液(pH7.5)后进行超声预处理,超声条件:功率30%(总功率650 W),超声5 s后间歇10 s;超声预处理料液比(g∶mL)为1∶15;超声时间分别为0、1、5、20、40 min。U0用来表示未处理组,U1、U5、U20、U40分别表示超声预处理1、5、20、40 min。
1.2.2 酶解液的制备 根据文献[13]方法制备酶解液,将处理后的金枪鱼皮,加入蛋白酶K(酶底比1 mg/g),在37 ℃恒温摇床上酶解,当酶解时间分别达到5、30、60 min后,立即90 ℃水浴15 min灭酶,冷却后在6000 r/min离心15 min,再用0.45 μm的滤膜过滤其上清液,即为酶解液,将一部分冷冻干燥备用。
1.2.3 水解度的测定 参考Zhang等[14]的方法测定水解度。5 mmol/L OPA工作液的制备:由10 mL 50 mmol/L NAC溶液,10 mL 50 mmol/L OPA溶液,75 mL 0.1 mol/L 硼酸盐缓冲液(pH9.4)和5 mL 20%(w/v)十二烷基硫酸钠(SDS)溶液配制而成,现配现用。
将40 μL的酶解液和5 mmol/L的 OPA工作液4.8 mL混匀反应10 min后,在λ340 nm处测定吸光值,空白组为水代替酶解液。水解度的计算公式如下:
式(1)
式(2)
式中:N为胶原蛋白理论肽键数;n为水解液中断裂的肽键数;A340为340 nm处的吸光值;M为蛋白质的分子量(300 kDa,以胶原蛋白分子量概算),Da;d为稀释系数;ε为340 nm处的消光系数(6000 mol·cm);c为蛋白质浓度,g/L,以鱼皮中蛋白含量(21.08%)计[13]。
1.2.4 ACE抑制率的测定 参照Zhang等的方法,稍加改动[14-15]。取50 μL酶解液于黑色滴定板(96孔)中,加入6 mU/mL ACE溶液50μL 后,于荧光酶标仪振荡10 s,并在37 ℃下反应10 min,然后在每个反应孔中加入200 μL 0.45 mmol/L ACE底物反应液(ABZ-Gly-Phe(NO2)-Pro)后进行动力学测定,每隔1 min测量一次,其中激发波长为360 nm,吸收波长为415 nm。
式(3)
式中:α为荧光吸收值与测定时间回归曲线的斜率。用Tris缓冲液(pH8.3)代替酶解液用作阳性对照组,将ACE溶液代替Tris缓冲液用作空白对照组和阴性对照组[14]。
1.2.5 分子量的测定
1.2.5.1 SDS-PAGE电泳 将酶解液与上样缓冲液按4∶1 (v/v)的比例混合,沸水浴5 min后迅速冷却。电泳分离胶为10%,浓缩胶为5%,上样量为15 μL。
1.2.5.2 酶解液的分子量分布 将5 mg酶解液冻干粉溶于2 mL流动相中,采用高效液相色谱(HPLC)分析多肽分子量的分布情况。色谱柱:TSK gel G2000 SWXL凝胶色谱柱(7.8 mm×300 mm);流速:0.5 mL/min;柱温:30 ℃;进样量:10 μL;检测波长:220 nm;采用30%乙腈(含有0.1%的三氟乙酸)进行等度洗脱。根据文献[13]选用4种分子量标准多肽样品细胞色素C(Mw=12384 Da)、抑肽酶(Mw=6511.44 Da)、杆菌肽(Mw=1422.69 Da)、谷胱甘肽(Mw=612.63 Da)。
1.2.6 超声预处理对金枪鱼皮胶原蛋白结构的影响
1.2.6.1 热稳定性分析 称取5 mg超声预处理后的金枪鱼皮冻干粉,用铝坩锅密封后放入DSC仪,以 5 ℃/min速率从-5 ℃升温至180 ℃,记录其吸热曲线。
1.2.6.2 红外光谱分析 取2 mg超声处理后的金枪鱼皮冻干粉,与溴化钾研磨混匀,60 ℃烘干之后压片,扫描红外光谱图,扫描范围为400~4000 cm-1,扫描次数64次,分辨率4 cm-1。
1.3 数据分析
采用SPSS 18.0进行统计学分析,使用Spectrum进行红外光谱分析,并用Origin 8.0作图。
2 结果与分析
2.1 超声预处理对水解度的影响
由图1可知,各组酶解液的DH随酶解时间增加整体呈现升高趋势。酶解5 min时,超声预处理组都和未超声组差异显著(p<0.05),说明超声预处理改变了胶原蛋白构象,在酶解初期使其酶解模式发生改变。但随着酶解的进行,超声对其酶解模式影响并没有持续,酶解30 min时超声组的DH均未显著高于未处理组(p>0.05),说明超声预处理仅暴露了部分结合位点,并未完全破坏胶原蛋白结构。酶解60 min后,超声处理对胶原酶解的影响再次出现,超声20、40 min组的DH均显著高于未处理组(p<0.05),表明超声预处理可能会对整体酶解过程有促进作用。
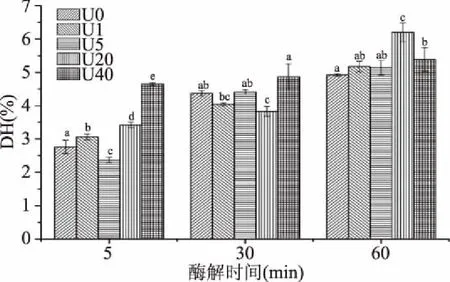
图1 超声预处理对金枪鱼皮胶原蛋白酶解液水解度的影响Fig.1 Effects of ultrosound pretreatment on the degree of hydrolysis of tuna skin collagen注:小写字母不同表示差异显著(p<0.05);图2同。
2.2 超声预处理对金枪鱼皮ACE抑制肽释放的影响
总体而言,超声预处理组酶解液ACE抑制率均比未处理组高,说明超声可促进酶解过程ACE抑制肽释放。超声产生的空化作用可使胶原蛋白结构展开,造成内部酶切位点暴露,促进其与蛋白酶K的结合[16]。经5 min酶解后,超声1 min和20 min后酶解液的ACE抑制率显著升高(p<0.05),与其水解度较高一致,但DH最高的超声40 min组没有出现较高的ACE抑制活性,即此酶解液中高活性ACE抑制肽段所占比例较低。随着水解进一步进行,超声处理40 min组的ACE抑制率明显升高,且接近或高于其他处理组,可能与其蛋白结构被破坏以及酶切位点暴露的程度有关。在超声处理组中,超声预处理后只要短时酶解(5 min)即可达到较高的ACE抑制率,说明超声预处理对金枪鱼皮胶原蛋白结构有一定破坏作用,使其酶切位点暴露,有助于ACE抑制肽快速释放。
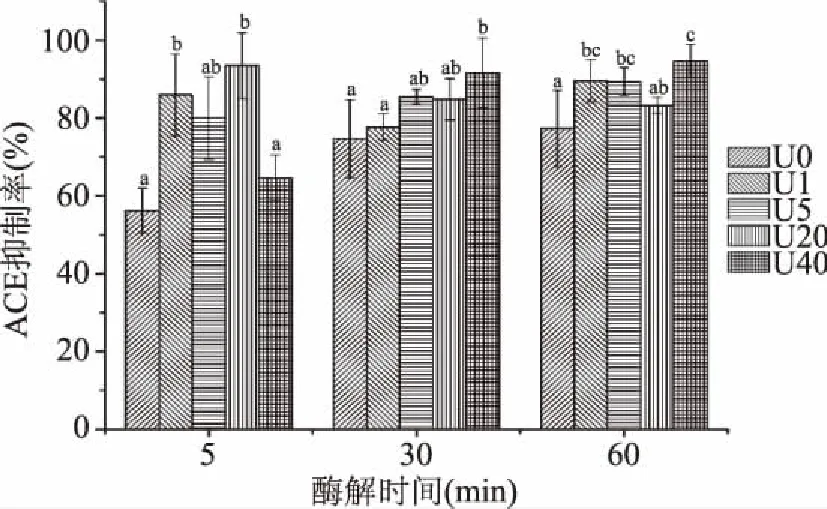
图2 超声预处理对金枪鱼皮酶解液ACE抑制率的影响Fig.2 Effects of ultrosound pretreatment on the ACE inhibitory activity of tuna skin collagen hydrolysate
2.3 分子量分布
利用SDS-PAGE电泳图分析20 kDa以上的大分子蛋白含量,同时利用HPLC分析10 kDa以下的小分子多肽含量变化。由图3和图4可知,不同超声处理组的组分含量随酶解时间增加呈现往复增减变化趋势。酶解5 min时,超声1~20 min后水解液组分明显增加,并且随着超声时间增加,条带颜色逐渐加深,结合ACE抑制活性变化趋势,表明超声1~20 min预处理能有效暴露胶原内部位点。超声40 min样品未出现任何条带,可能是因为长时间超声造成胶原大量位点暴露,短期酶解使大量多肽溶出,并作为底物被进一步降解为小分子短肽,分子量均低于20 kDa,因此在电泳图上没有条带。图4显示酶解5 min超声40 min水解液中小分子含量大于95%证明了这一假设,在此过程许多有高ACE抑制活性的多肽可能发生进一步降解,使ACE抑制活性偏低。
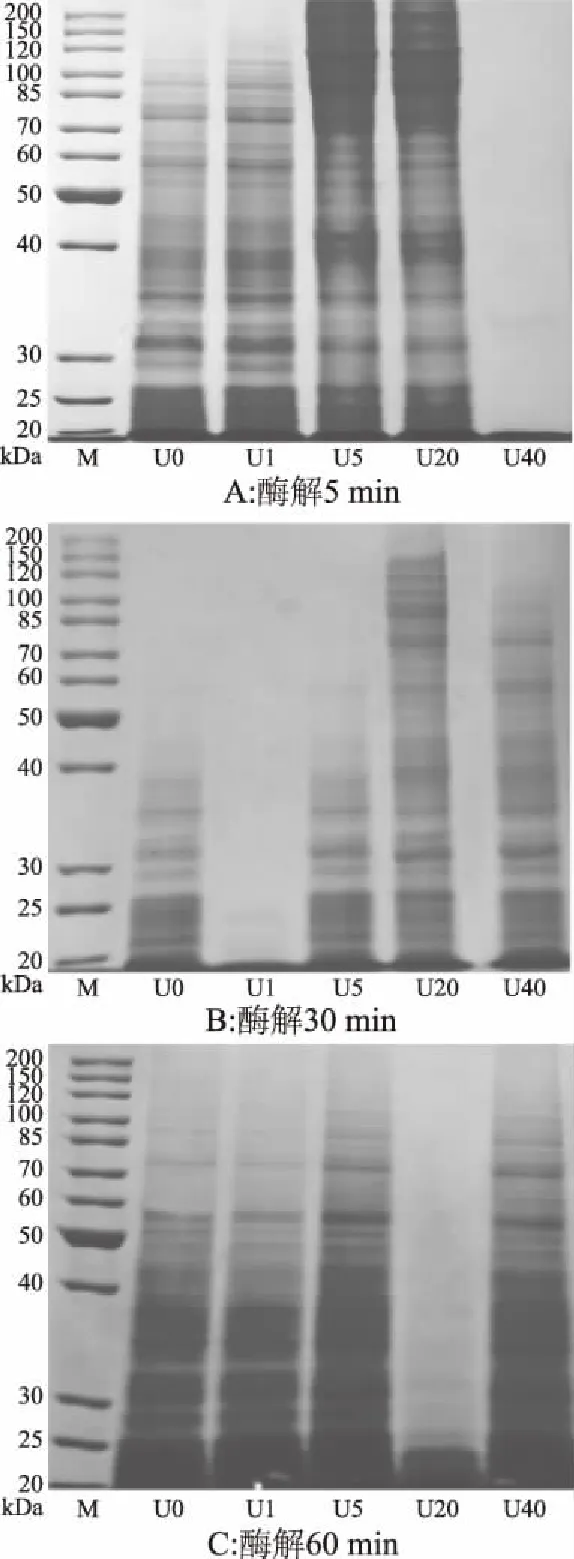
图3 不同超声预处理组酶解液的SDS-PAGE电泳图Fig.3 SDS-polyacrylamide gel electrophoresis of hydrolysate by different pretreatment注:M:标准蛋白。
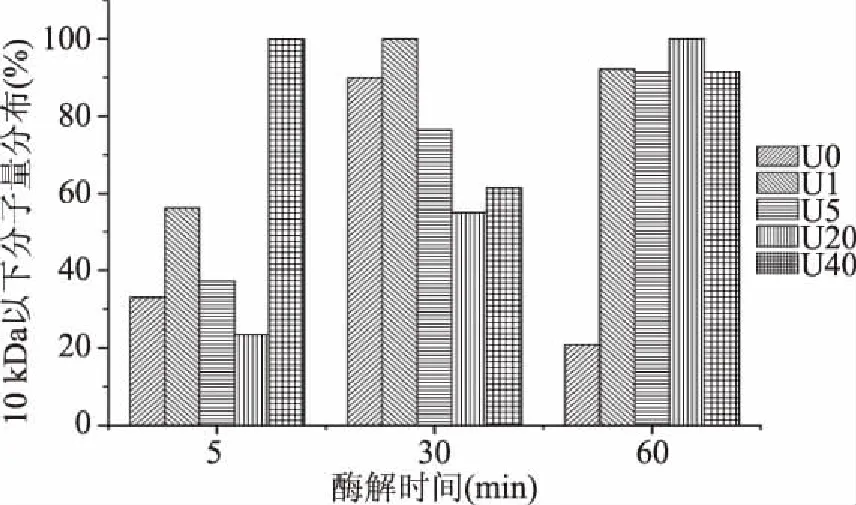
图4 不同超声预处理组酶解液10 kDa以下多肽的分子量分布Fig.4 Molecular weight(under 10 kDa)distribution of hydrolysate by different pretreatments
酶解30 min时,未处理组、超声1 min和5 min组电泳条带均减少,小于10 kDa的组分含量则大幅上升,这是因为蛋白酶与溶液中的位点接触几率远高于不溶性胶原主体,从而进一步降解此时溶液中的多肽。而超声40 min组样品则呈现相反情况,电泳条带增加,小于10 kDa的组分含量下降,说明溶液中的作用位点被耗尽后,蛋白酶进而将不溶性底物酶解,使溶液中大分子多肽比例增加。酶解60 min时,每组酶解液分子量继续呈现往复增减的变化规律。说明超声预处理后在酶解初期可以加速该规律进行,进而使ACE抑制活性肽段释放加速,然而当进一步酶解时,该规律可能继续呈现至胶原结构彻底崩溃,超声预处理对于酶解的影响也会随着酶解的进行逐渐减小。
2.4 超声预处理对金枪鱼皮胶原蛋白结构的影响
2.4.1 超声处理后鱼皮胶原热稳定性分析 通过热稳定性分析可以判断超声处理对原料的破坏程度,并可结合水解液ACE抑制率进一步分析位点暴露情况。由图5(表1)可以看出,未处理金枪鱼皮经DSC扫描图谱显示仅有一个大峰,但经超声处理1、5 min后,靠近主峰处增加了一个小峰,超声处理20、40 min后增加了两个小峰,即随着超声时间增加,DSC图谱在比主峰温度低的地方有规律地增加小峰。小峰可能是胶原蛋白的多肽片段或蛋白质的氧化造成的[17-18],但由于试验中未超声组和超声处理组操作时间相同,应该不是氧化所致,该小峰应为胶原蛋白多肽片段。这可能是金枪鱼皮经超声处理后,破坏了胶原蛋白共价交联键,促进了胶原片段的溶出,小峰表现为小分子片段。将超声后鱼皮样品弃去上清液,收集沉淀干燥后经DSC验证,DSC图谱中仅有一个峰(表2),且趋势与主峰热变性温度趋势一致说明确实是超声导致的胶原片段溶出而产生的小峰。
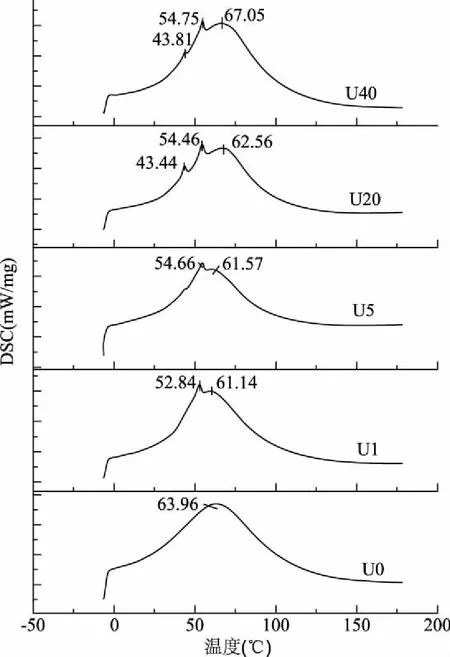
图5 不同超声预处理组的胶原蛋白DSC图谱Fig.5 DSC picture of collagen treated with different ultrosound pretreatments
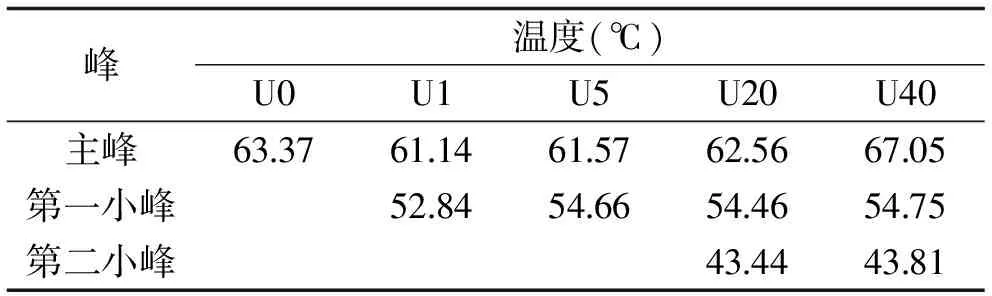
峰温度(℃)U0U1U5U20U40主峰63.3761.1461.5762.5667.05第一小峰52.8454.6654.4654.75第二小峰43.4443.81
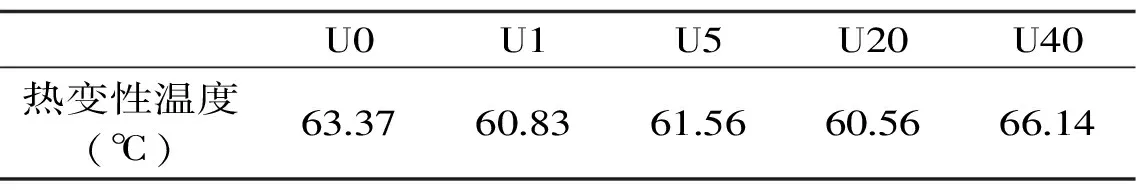
表2 超声处理后弃去上清液后鱼皮胶原的热变性温度Table 2 Tm of fish skin collage after ultrasound pretreatment and centrifugation to discard supernatant
DSC可用于反映胶原蛋白的变性程度[19]。从主峰温度来看,超声预处理改变了金枪鱼皮胶原蛋白结构,超声预处理1~20 min均比未处理组低,说明超声可使胶原构象发生改变,使热变性温度降低。但超声40 min 后,胶原蛋白主峰的热变性温度比未处理组高,可能是因为长时间的超声处理导致胶原中共价键被破坏[20-21],大量组分溶出,而未溶出的胶原主体稳定性得到加强,表现为主峰温度升高。溶出的组分可被短时酶解,使酶解5 min、超声40 min组酶解液的大分子组分减少。
酶解初期超声处理5、20 min 组主峰的热变性温度比未处理组低,而其ACE抑制率显著性升高(p<0.05),表明此时超声主要改变胶原蛋白的三螺旋构象,使更多三螺旋区域的结合位点暴露,快速释放ACE抑制肽。当超声预处理时间达到40 min后,蛋白酶迅速水解胶原非主体部分,并进一步降解可溶性大分子组分,造成酶解5 min后无SDS-PAGE电泳条带存在,酶解液小分子含量高,但部分ACE抑制活性高的肽段可能在该过程中被降解,造成水解液ACE抑制活性偏低。
2.4.2 红外光谱分析 超声预处理后金枪鱼皮胶原蛋白结构变化如图6所示。酰胺A带是N-H伸缩振动的吸收峰,当N-H基团参与氢键形成时,其向低波数移动;酰胺B带是-CH2的不对称伸缩振动,当-CH2基团参与氢键时发生蓝移;酰胺I带是C=O的伸缩振动峰,波数越低蛋白中氢键作用越高[22-23]。由表3可知,短时间超声造成与N-H相关的氢键含量增加,长时间超声则破坏了蛋白分子间的氢键,可能是因为长时间超声造成更多的组分溶出,剩余胶原主体结构中组分减少,造成N-H相关的氢键含量相对减少。酰胺B带向低波数移动,表明维持三螺旋构象的分子间和分子内缔结氢键减少,表明超声对胶原蛋白构象有所破坏。超声预处理后各组的酰胺I带向高波数移动,说明超声处理破坏了蛋白结构中C=O参与的氢键作用。
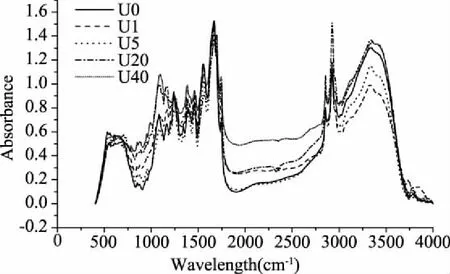
图6 不同超声预处理金枪鱼皮的胶原蛋白红外光谱图Fig.6 Infrared spectrogram of tuna skin collagen treated with different ultrosound pretreatments
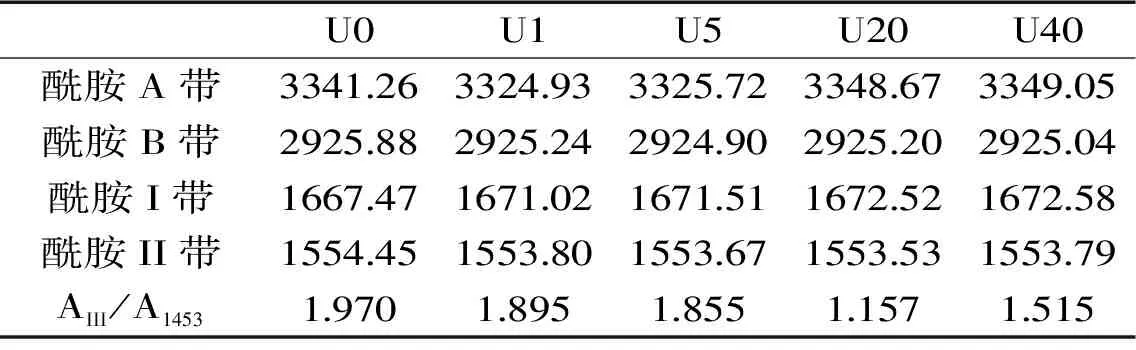
表3 不同超声预处理时间的金枪鱼皮胶原蛋白红外光谱特征峰吸收波Table 3 Infrared spectrogram of tuna skin collagen treated with different ultrasound pretreatments
酰胺III带和1453 cm-1波数的面积比值可反映蛋白三螺旋完整度[24]。由表3可知,金枪鱼皮经超声处理后,三螺旋结构均遭到不同程度的破坏,超声20 min组的面积比最小为1.157,说明在此条件下三螺旋结构破坏最严重,使更多三螺旋区酶结合位点发生暴露,有助ACE抑制肽释放。超声40 min后,AIII/A1453比值有所增加,可能是由于部分组分溶出后,剩余的胶原主体结构中类三螺旋结构反而相对更加稳定,这与DSC结果一致。
由表4可知,超声处理后α螺旋、β折叠比例降低,而无规则卷曲、β转角含量明显上升,与胡爱军等[25]研究结果一致。这是因为超声破坏蛋白结构,使氢键断裂,α螺旋展开,形成无规则卷曲结构,使更多位点暴露,加速酶解过程的进行,提高三螺旋区活性多肽的释放效率。但超声40 min后,其α螺旋、β折叠比例略有增加,β转角减少,胶原主体的有序性有所增加,与DSC结果一致,即该胶原主体热变性温度增加。
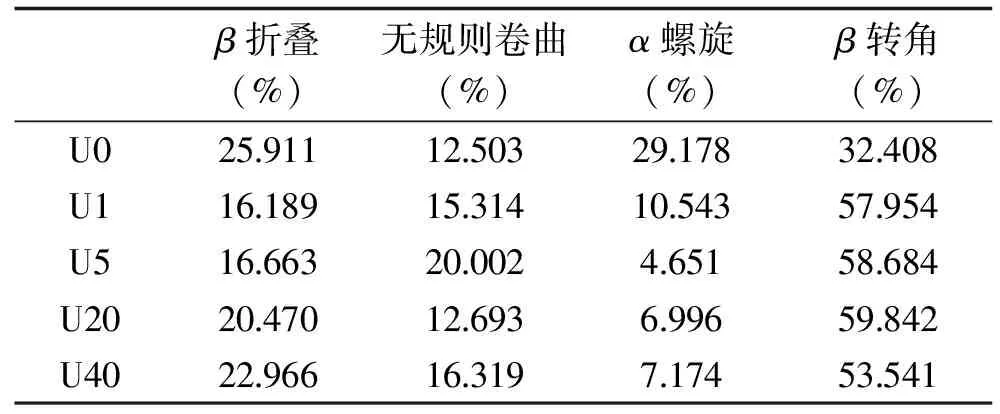
表4 不同超声预处理组金枪鱼皮胶原蛋白的二级结构含量Table 4 Secondary structured of collagen that treated with different ultrosound pretreatments
3 结论
超声预处理对金枪鱼皮胶原结构有一定破坏作用,改变了酶解模式,且超声可促进短时酶解过程胶原三螺旋区域ACE抑制肽快速释放;同时酶解过程酶解液组分分子量呈现往复增减变化,超声预处理会加速该规律的进行,以促进胶原整体酶解过程的进行。
DSC结果表明,1~20 min的超声预处理可导致鱼皮胶原热变性温度降低,说明短时超声预处理会在一定程度上破坏胶原蛋白构象,使ACE抑制肽的释放效率提高;但40 min的超声预处理导致鱼皮热变性温度升高,原因在于长时间的超声处理促使大量组分溶出并快速被降解,使未溶出的胶原主体的热稳定性略有增加。
FTIR结果表明,超声预处理破坏了胶原蛋白内部与N-H以及C=O相关的氢键平衡,并减少了维持三螺旋构象的分子间以及分子内缔结的氢键,从而改变蛋白构象。金枪鱼皮经超声预处理后,其α螺旋、β折叠比例降低,无规则卷曲、β转角比例明显增加,表明三螺旋结构遭到不同程度的破坏,整体向无序结构转变,有助于三螺旋区的活性肽释放;与其他处理组相比,超声处理40 min后,AIII/A1453比值增大,α螺旋、β折叠含量略有增加,β-转角含量减少,表明胶原主体有序性有所增加,剩余的胶原主体结构更加稳定,与DSC结果一致。

