植物乳杆菌CICC 20270微胶囊的制备及其特性
,, ,,
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
在功能性食品或医药领域,益生菌作为一种新型功能性添加成分,发挥着越来越重要的作用[1]。它们可以通过保持健康的肠道菌群、抑制病原菌的生长、刺激免疫系统、合成维生素和抗菌物质,以及促进钙吸收来保证机体健康[2-3]。但益生菌菌体难以抵抗人体胃酸、胆盐的毒害,使得益生菌产品被服用后,很难有足够数量的活菌到达肠道而被利用[4]。因此,如何保持益生菌在加工储存及机体摄入后的活性问题亟待解决。近几十年来,在许多发酵食品中鉴定了植物乳杆菌菌株,并报道了其应用于各种功能性食品的益生菌潜力[5]。植物乳杆菌对肠道微生物有着重要影响,在食品发酵、工业乳酸发酵以及医疗保健等领域都有着广泛的应用[6]。在人体回肠中植物乳杆菌存活率在7%左右,其定植效果比唾液乳杆菌、罗伊氏乳杆菌、格氏乳杆菌、嗜酸乳杆菌、干酪乳杆菌效果好,因此植物乳杆菌是良好的潜在益生菌菌株[7]。并且,维持生殖道菌群平衡研究中还发现,植物乳杆菌的存在有利于维持生殖道微生态平衡[8]。
微胶囊技术作为 21世纪的高新技术之一,已广泛应用于医学、食品、农药、化妆品、涂料、油墨等诸多领域[9]。喷雾干燥法是食品工业中最常用的制备微胶囊的方法。它是将进料溶液雾化到热空气干燥室中,液滴中的水分经去除从而形成干燥粉末[10]。这一技术具有干燥颗粒粒度可控,易扩大连续生产的优点[11]。此外,经干燥的益生菌微胶囊还能减少运输成本[12]。已经有广泛的报道证明,经包埋的细菌细胞比游离细胞更加稳定[13]。而制备微胶囊的关键问题之一就是选择合适的壁材,这也是目前及未来几年益生菌微胶囊化主要面临的问题[14-15]。微胶囊常用壁材主要包括3类:碳水化合物,如海藻酸钠、淀粉;植物胶类,如阿拉伯胶、卡拉胶;蛋白类,如乳清蛋白、明胶[16-17]。研究表明,多糖虽无乳化作用,但具有良好的成膜性,可形成质密的玻璃体,对芯材起到良好的包埋作用,有助于提高包埋率[18]。
因此本试验主要采用不同DE值糖浆作为壁材,以主要含有中/长链脂肪酸的椰子油/玉米油及植物乳杆菌CICC 20270(Lactobacillusplantarum)为芯材制备乳状液后通过喷雾干燥制备微胶囊,探究微胶囊水分含量、菌存活率、微观结构、耐热性、储藏稳定性以及体外消化性质。将L.plantarumCICC 20270与油脂共同作为芯材进行微胶囊化,使其包埋在内部不仅可以避免外部不利因素对其造成伤害,利用肠溶性壁材又可使L.plantarumCICC 20270能够在肠道内被释放出来,提高L.plantarumCICC 20270到达肠道后的活菌数量,使其能够充分发挥益生功效。
1 材料与方法
1.1 材料与仪器
植物乳杆菌CICC 20270(Lactobacillusplantarum) 中国工业微生物菌种保藏管理中心;糖浆(DE25、DE18)江西恒顶食品有限公司;玉米油 东莞鲁花食用油有限公司;椰子油 杭州旺源科技有限公司;MRS肉汤培养基 广东环凯微生物科技有限公司;PBS缓冲液 上海双螺旋生物科技有限公司;其他化学试剂 均为国产分析纯。
BXM-30R高压灭菌锅 上海博迅实业有限公司;SW-CJ-1FD无菌工作台 苏净集团安泰公司;MDR.P-5喷雾干燥塔 无锡市现代喷雾干燥设备有限公司;GYB 30-6S高压均质机 上海东华均质机有限公司;UItra Turrax T25高速剪切分散机 德国IKA公司;FEI Quanta200F环境扫描电子显微镜 美国FEI公司。
1.2 实验方法
1.2.1 菌种的活化与培养 将保存在甘油中的菌种接入到已灭菌的MRS液体培养基中,于37 ℃厌氧培养24 h,再以2.5% V/V转接于新鲜已灭菌的MRS液体培养基中37 ℃厌氧培养24 h,获得处于稳定期的L.plantarumCICC 20270;再将菌液以4000 r/min,4 ℃离心20 min,弃上清液,收集菌体,用 0.85%的无菌生理盐水洗涤,以4000 r/min,4 ℃再次离心5 min,弃上清液,收集菌泥。最后用平板计数法对该浓缩菌泥进行精确计数。
1.2.2 微胶囊的制备 称取一定量单甘酯(0.4%,w/w)、硬脂酰乳酸钠(0.12%,w/w)加入到玉米油或椰子油(4.5%,w/w)中,加热搅拌使之熔化溶解;再称取酪蛋白酸钠(0.6%,w/w)、磷酸氢二钾(0.2%,w/w)加入到320 mL蒸馏水中,待完全溶解后加入DE25或DE18糖浆(13.6%,w/w),搅拌均匀。将上述油相物料与水相物料混合,磁力搅拌器搅拌30 min,加入1.2.1收集的菌泥,使得菌细胞浓度约为109CFU/mL,再通过高速剪切分散机10000 r/min分散1 min,最后经40 MPa高压均质机处理制得菌悬液。使用实验室规模喷雾干燥塔进行喷雾干燥实验,设置进风温度为135 ℃[19-20],出风温度75 ℃,将喷雾干燥后收集的干粉样品存放在密封的无菌瓶中,并置于4 ℃冰箱保存。
1.2.3 水分含量测定 将托盘放置在105 ℃烘箱中干燥至恒重,然后将其置于干燥器中冷却至室温,称重记录托盘质量为m0。称取5 g微胶囊样品于托盘中,再次称重记录为m1。将装有样品的托盘置于105 ℃烘箱中,24 h后取出放于干燥器中冷却至室温,称重记录为m2。样品水分含量为:
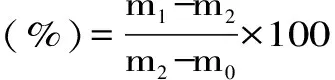
1.2.4L.plantarumCICC 20270的活菌计数 为了测定L.plantarumCICC 20270包埋前后的存活率,要对喷雾干燥前后的活菌细胞进行平板计数[7]。取1 g益生菌微胶囊溶解在9 mL PBS中,摇床振荡30 min,使菌细胞得到完全释放。喷雾干燥前取1 mL菌液溶解在9 mL PBS中并混合均匀。之后取一定量液体进行梯度稀释后选择合适的浓度,再取100 μL涂布到MRS琼脂平板上,在37 ℃下培养48 h。对菌落为20~200的平板进行计数,记录为CFU/g,每个浓度取2个平板。
1.2.5 微胶囊扫描电镜(scanning electron microscope,SEM)观察 采用扫描电子显微镜对益生菌微胶囊形态进行观察。将微胶囊粉末粘附在双面碳带上,随后立即喷金在5 kV加速电压下,观察益生菌微胶囊表面结构。
1.2.6 微胶囊热处理性质 微胶囊热处理参照Shah[21]等的实验方法。称取0.5 g益生菌微胶囊置于含4.5 mL无菌蒸馏水的试管中,并将试管置于55、65、75 ℃的水浴锅中进行热处理,在处理0、1、10 min时取1 mL样品进行梯度稀释,选取合适的稀释度平板计数。未经包埋的游离益生菌作为阴性对照。
1.2.7 微胶囊储藏稳定性分析 称取5 g益生菌微胶囊置于称量瓶中,将称量瓶放置于4、25、37 ℃环境下。储藏周期均为5周,每周称取0.5 g样品至4.5 mL PBS溶液中,选择合适的稀释梯度后进行平板计数。另称取5 g益生菌微胶囊于敞口称量瓶中,置于底部分别盛有适量饱和氯化镁、饱和硝酸镁和饱和氯化钠的干燥器内,干燥器内湿度控制为33%、52%、75%,并将干燥器置于25 ℃环境下。
1.2.8 体外消化性质分析 模拟胃液的配制:取一定量的胃蛋白酶(0.32%,w/w)和NaCl(0.2%,w/w),加入50 mL无菌蒸馏水后用1 mol/L盐酸调节pH至2.0,过0.22 μm滤膜除菌备用。模拟肠液的配制:取胰酶(0.1%,w/w)和胆盐(0.08%,w/w)至0.2 mol/L的PBS(pH7.4)中,过0.22 μm滤膜除菌备用。
将模拟胃液与模拟肠液在37 ℃下预热,取0.1 g益生菌微胶囊或0.1 mL益生菌悬浮液于9.9 mL模拟胃液中,37 ℃不断振荡,于0、1、2 h取1 mL样品至9 mL PBS中,37 ℃搅拌振荡30 min,使益生菌微胶囊完全崩解,选择合适的稀释梯度接种到MRS培养基上培养48 h后进行平板计数。经过2 h模拟胃液后,用1 mol/L NaOH调节pH至7.4,然后加入10 mL模拟肠液,37 ℃不断搅拌,在连续模拟胃肠液消化培养3、4、5、6 h时,取1 mL样品梯度稀释后进行平板计数。
1.3 数据分析
所有实验均为三组重复,运用Origin 9.1作图,使用SPSS 16.0对数据进行差异性显著分析。
2 结果与分析
2.1 微胶囊水分含量及L. plantarum CICC 20270的活菌计数
低水分含量对于益生菌微胶囊的稳定性非常重要。较少的游离水不利于微生物生化反应的进行,因此可以提高益生菌微胶囊的保质期[22]。与Ortega等[23]研究结果低水分含量利于微胶囊中微生物的存活并且可以降低粉末粘性、减少结块现象相一致。水分含量的不同取决于喷雾干燥过程中进出口温度、液滴形成机理以及进料溶液的组成和浓度[24-25]。相关报道还指出喷雾干燥出口空气温度的降低使其相对湿度增加,从而会导致粉末含水量的增加[26]。表1所示的各微胶囊样品的水分含量在3.61%~3.71%,4种微胶囊样品的含水量没有显著性差异(p>0.5),且本文微胶囊水分含量均低于参考文献中水分含量4%~7%[27],说明具有较低的吸湿性利于其储藏稳定性。
喷雾干燥前后L.plantarumCICC 20270菌活数的变化情况如表1所示。微胶囊中活菌细胞数量下降都小于1 lg CFU/g,存活率均在90%以上。消费产品中益生菌浓度要达到106CFU/mL或推荐每天摄入108~109益生菌,才能为机体提供健康益处[28]。本文研究的喷雾干燥后微胶囊中的菌活细胞浓度均达到建议摄入量。因此采用喷雾干燥制备L.plantarumCICC 20270 微胶囊时,DE25、DE18糖浆都能作为良好壁材,分别包埋玉米油或椰子油后对L.plantarumCICC 20270能起到一定的保护效果。
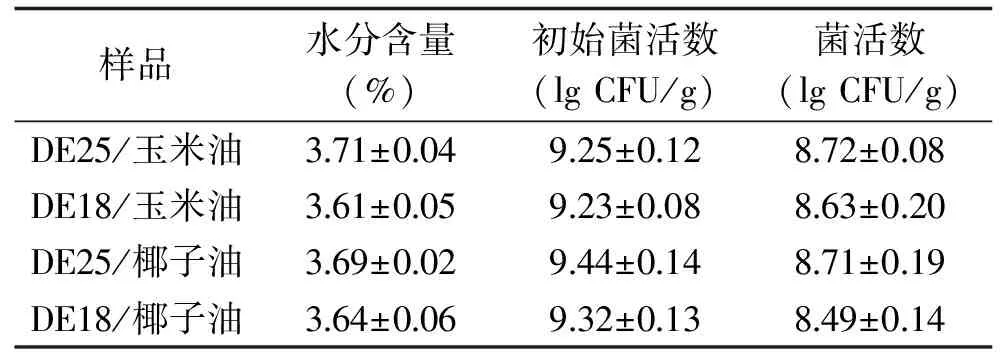
表1 喷雾干燥前后L. plantarum CICC 20270活菌数及微胶囊水分含量Table 1 Cell number of L. plantarum 20270 and moisture content of spray dried microcapsules before and after drying
2.2 微胶囊扫描电镜观察
图1为微胶囊样品表面形态的扫描电镜图。由于微胶囊水分含量均较低,因此样品没有出现明显粘连状态。在500倍电镜下(图1A~D)可以观察到,DE18微胶囊颗粒皱缩程度明显大于DE25微胶囊,且后者形态结构基本呈完整球状。在1000倍电镜下(图1a~d)可以看出,以DE25糖浆为壁材的微胶囊颗粒表面较DE18的更平滑、完整性更好,并且颗粒表面由于失水出现的微孔也较少。出现这一现象是由于DE值越低的糖浆随着外界温度的升高,粘性更容易降低,进而导致微胶囊表面结构不稳固。同样的,以DE18糖浆为壁材的微胶囊颗粒表面褶皱程度更大也是由于其表面结构不稳固,在喷雾干燥中因温度过高迅速失水而造成。有研究报道指出,微胶囊颗粒表面的光滑度会影响其性质(例如溶解度,水分活度),同时影响活菌细胞的数量[29]。因此以DE25糖浆为壁材的微胶囊利于活菌数的提高,并且由于其紧密结构也将有助于缓慢释放包埋的益生菌,提供较高的抗胃酸消化的功能。
2.3 微胶囊热处理性质
未经包埋的L.plantarumCICC 20270及喷雾干燥后的微胶囊样品经热处理后其菌活情况如图2所示。未经包埋的益生菌随着热处理温度升高以及时间的延长,菌活数均显著(p<0.05)下降。经55 ℃热处理1 min后各微胶囊样品之间菌活下降没有显著性差异(p>0.05),10 min热处理后椰子油微胶囊菌活量下降程度比玉米油微胶囊更大;而相同油脂与不同DE值糖浆制备的益生菌微胶囊样品之间菌活下降没有显著差异(p>0.05)。65 ℃热处理1 min后,DE25/椰子油微胶囊菌存活率为75.66%,为四个样品中最低;10 min后,菌细胞数最低的是DE18/椰子油微胶囊,存活率为49.82%。在65 ℃整个热处理过程中,DE25/玉米油微胶囊的菌活存活率最高。75 ℃热处理1 min及10 min后,DE18/椰子油微胶囊的益生菌存活率均最低,分别为38.40%、15.08%;而DE25/玉米油微胶囊的存活率仍然是最高,分别为46.10%、25.73%。综述所述,玉米油微胶囊表现出比椰子油微胶囊更好的耐热性。

图2 微胶囊热处理后L. plantarum CICC 20270的活菌数Fig.2 The cell number of L. plantarum CICC 20270 after heat treatment of microcapsules
2.4 储藏稳定性
不同益生菌微胶囊及未经包埋的益生菌分别在4、25、37 ℃条件下储藏5周的益生菌存活情况如图3所示。在4 ℃条件下(图3a),4种微胶囊样品菌活均未出现显著性下降,说明在低温条件下益生菌微胶囊的性质都较稳定。图3b中观察到,25 ℃环境下4种益生菌微胶囊活菌数出现了不同程度的下降。其中DE25/椰子油包埋的益生菌活菌数下降最大(3.52 lg CFU/g),其次是DE18/椰子油微胶囊,DE25/玉米油包埋的益生菌下降最少(2.32 lg CFU/g)。在37 ℃条件下(图3c),同样可以观察到椰子油微胶囊活菌数下降数均比玉米油微胶囊下降得更多。这可能是与椰子油和玉米油的熔点分别约为28、-11 ℃,在37 ℃储存过程中,椰子油会发生物理状态改变导致微胶囊结构发生破坏,从而致使益生菌裸露在外界环境中有关。因此,玉米油更利于微胶囊在较高温度环境中的储存。
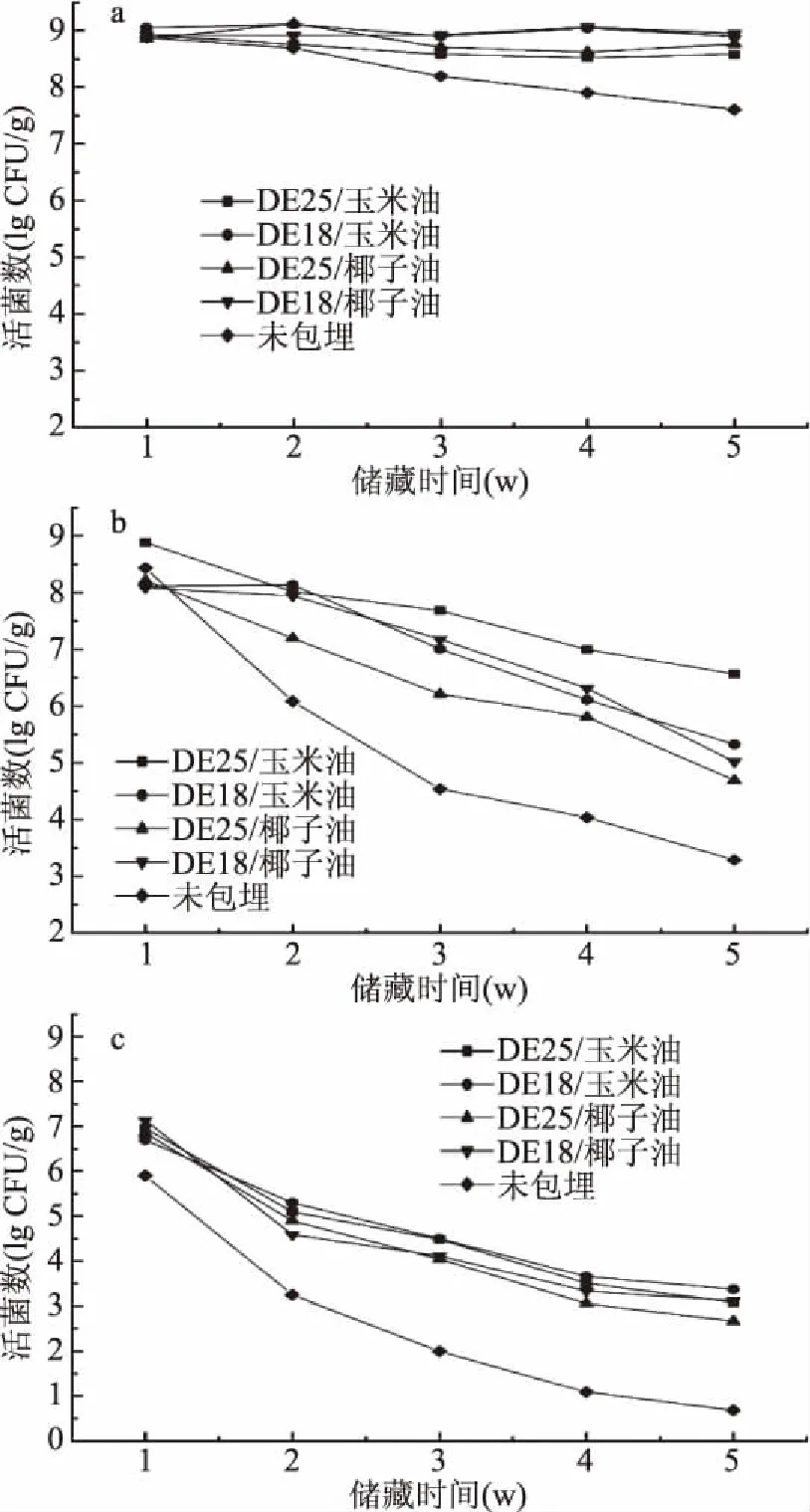
图3 微胶囊在不同温度条件下储藏5周的活菌数变化Fig.3 Changes in viable cell concentration of the microcapsules stored for 5 weeks under different temperature注a:4 ℃;b:25 ℃;c:37 ℃。
图4为益生菌微胶囊及未经包埋的益生菌在25 ℃不同湿度条件下储藏5周的菌活情况。Poddar 等[30]报道在存储过程中,储藏环境中的水分含量对益生菌的存活率有较大的影响,随着水分含量的增加,益生菌的存活率将不断降低。由图4看出随着环境中湿度的不断增大,益生菌菌活下降程度越大,与Poddar等的报道相一致。在33%的环境湿度条件下(图4a),益生菌微胶囊在长时间下可以保持相对较高的活菌数。从图4b中观察到在同一芯材情况下,以DE18糖浆为壁材的微胶囊比DE25活菌数下降程度更大,这一趋势与图4a相同。而在75%环境湿度条件(图4c)条件下,各微胶囊样品活菌数下降趋势有所不同。但DE25微胶囊活菌数下降数量仍低于DE18微胶囊。由图4三种不同环境湿度条件下呈现的整体趋势来看,相对于芯材的不同产生的差异,糖浆的DE值不同对储存过程中活菌数的影响更大,且DE25糖浆给益生菌提供了更好的保护效果。有研究报道指出碳水化合物尤其是多糖,可以作为细菌的选择性营养素[31]。因此在储存过程中,L.plantarumCICC 20270可以通过利用糖浆来维持基本生命活动。在之前的研究中(未发表),以不同DE值糖浆作为碳源对L.plantarumCICC 20270进行液体培养,显示在DE25糖浆情况下培养液pH更低,菌浓度更大。因此,相对于DE18糖浆,L.plantarumCICC 20270将优先选择DE25糖浆作为营养素维持自身基本生命活动,从而利于其在储存过程中的存活。
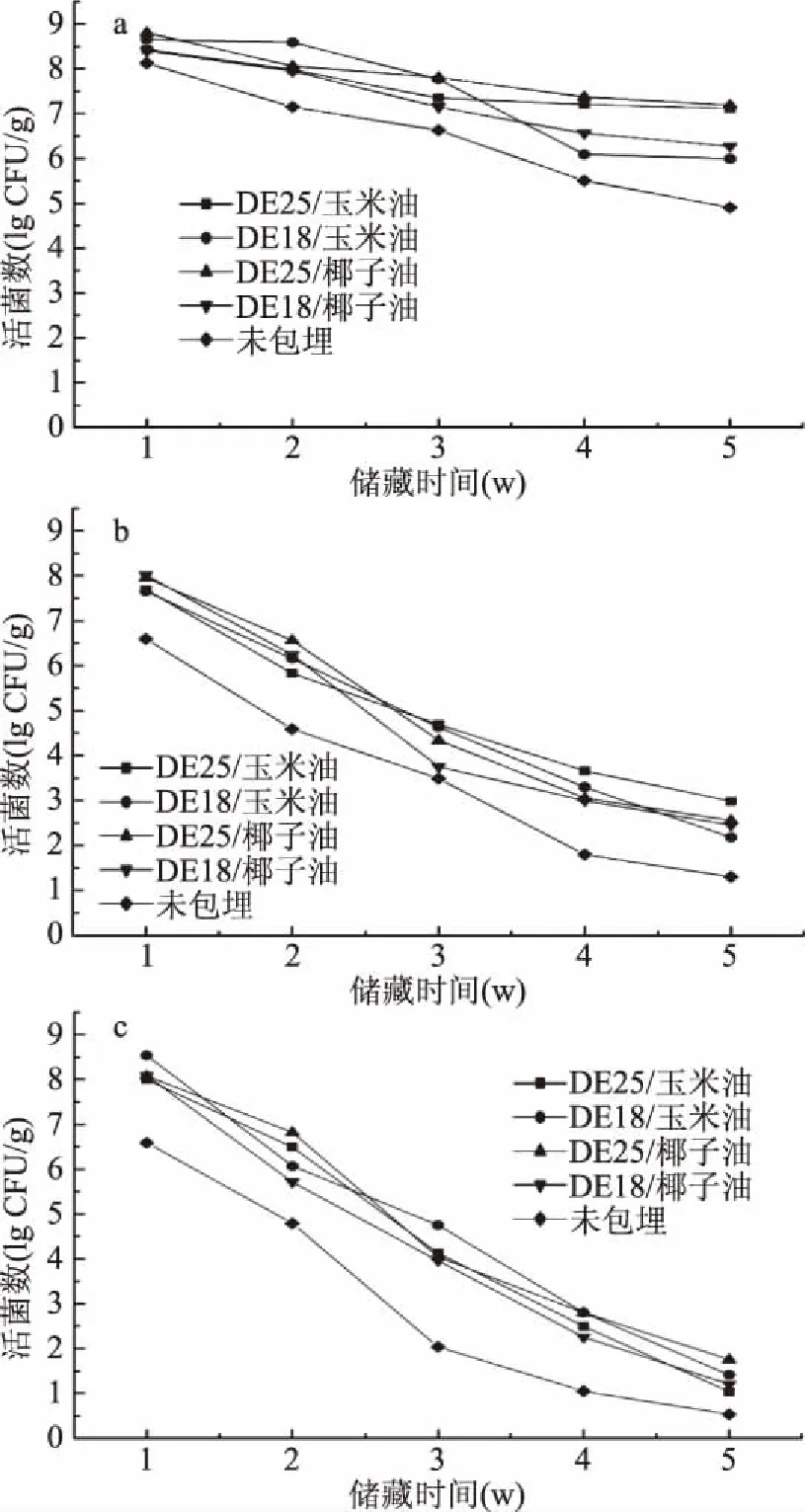
图4 微胶囊在不同湿度条件下储藏5周的活菌数变化Fig.4 Changes in viable cell concentration of the microcapsules stored for 5 weeks under different humidity注:a:33%;b:52%;c:75%。
2.5 益生菌微胶囊体外消化性质
益生菌微胶囊的体外模拟消化性质如图5所示。包埋与未经包埋的益生菌在连续模拟胃肠液中菌活差异较大。未经包埋的游离益生菌在模拟胃液0~2 h后菌活数急剧下降,2 h后菌活数趋于0。而经包埋的益生菌在2 h的模拟胃液消化后活菌数显著(p<0.05)得到提高。在低pH环境下,糖浆和油脂对益生菌起到了很好的缓冲作用,使得益生菌不会快速暴露于外界环境中。连续6 h模拟胃肠液消化后,DE25/椰子油微胶囊在整个过程中活菌数只下降了3.88 lg CFU/g,存活率最高。以相同油脂为芯材的微胶囊,DE25糖浆相比DE18糖浆使得益生菌得到缓慢释放,并提供了更好的抗胃酸消化功能。其中,玉米油微胶囊活菌数下降程度均比椰子油微胶囊大,这可能是因为椰子油中主要含有中链脂肪酸,而玉米油中主要含有长链脂肪酸的原因。在机体肠道中,中链脂肪酸由于其特殊的吸收、转运及氧化途径,与长链脂肪酸相比,能够被快速吸收、转运和氧化,并产生能量[32]。并且中链脂肪酸被认为是抗生素替代品,它们对革兰氏阳性菌和大肠杆菌都具有很强的抗菌活性[33]。在模拟肠液中,中链脂肪酸可以被益生菌吸收利用产生短链脂肪酸降低环境pH起到抗菌作用,使得益生菌存活率得到提高。近年来越来越多的研究表明,中链脂肪酸发挥着积极的生理作用,尤其在结肠中[34]。肠道中的短链脂肪酸能够通过抑制巨噬细胞的分化和成熟来抑制巨噬细胞的吞噬能力,且降低活性氧的产生,并且能够改善肠道菌群,增加厌氧菌的产生[18]。并且,中链脂肪酸的缺乏与炎症性肠病(结肠炎、腹泻)有关,特别是丁酸,在抑制结肠癌发生过程中起着重要的作用[35-36];Tedelind等[37]也报道了中链脂肪酸可以作为结肠癌的免疫调节剂。相关研究表明,中链脂肪酸除了这种抗菌活性,同样也可以改善断奶仔猪的肠道发育[38],这进一步说明了中链脂肪酸可以被益生菌直接利用,并促进机体肠道环境中活菌数的提高。
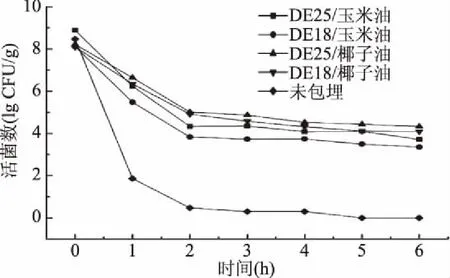
图5 不同益生微胶囊的体外消化性质Fig.5 In vitro digestibility of different probiotic microcapsules
3 结论
本试验主要采用DE25、DE18两种DE值糖浆为壁材,玉米油/椰子油作为芯材,添加入L.plantarumCICC 20270,并通过喷雾干燥法制备益生菌微胶囊,结果显示制得的微胶囊包埋率均在90%以上。SEM观察到DE25微胶囊形态更加圆整光滑,皱缩程度明显小于DE18微胶囊。在不同温度热处理条件下,与椰子油微胶囊相比,玉米油微胶囊中L.plantarumCICC 20270存活率更高。选取DE25糖浆和玉米油制备微胶囊更有助于益生菌在储藏环境中存活率的提高。但在体外模拟消化中,椰子油与DE25糖浆共同作用最有力提高了L.plantarumCICC 20270在模拟胃肠液中的存活率。因此可以得出结论,DE25糖浆更适合作为喷雾干燥法制备益生菌微胶囊的壁材,以玉米油为芯材利于其在储存过程中的稳定性,而椰子油更有助于益生菌在模拟胃肠液中的存活率的提高。
——头发

