苦杏仁苷磷脂复合物的制备及理化性质研究
樊丽雅,燕飞宏,张 璐,石松利,胡 丽,郑春丽*
(1.包头医学院药学院,包头 014040;2.中国药科大学药学院,南京 210009)
苦杏仁苷又名维生素B17,为传统中药苦杏仁、郁李仁和桃仁等的主要有效成分,具有润肠通便和降气利水的作用。现代药理学研究表明,苦杏仁苷具有抗肿瘤[1-3]、降血脂[4-5]、抗肺纤维化[6]和抗炎[7]等作用。但由于苦杏仁苷极性大、亲水性强、油水分配系数小,存在跨膜吸收障碍,限制了苦杏仁苷的临床应用。
磷脂复合物是指药物与磷脂按照一定的配比结合而成的化合物,由于磷脂的结构中同时存在极性与非极性部分,与细胞膜有高度的亲和性,因而有利于药物分子的跨膜转运。研究表明,磷脂复合物具有促进水溶性药物的吸收[8-9]和提高生物利用度的作用[10-12]。本研究旨在筛选具有较高复合率的苦杏仁苷磷脂复合物的制备工艺,初步考察复合物的理化性质,以期提高苦杏仁苷的脂溶性,为进一步开发新型制剂提供参考。
1 仪器与试药
1.1仪器 LC-20AT高效液相色谱仪(日本SHIMADZU公司);SHY-2A 水浴恒温振荡器(江苏金坛市金城国盛仪器厂);BS 124S精密电子天平(德国Sartorious仪器有限公司);SENCO旋转蒸发仪(上海申生科技有限公司);H01-1C恒温磁力搅拌器(上海梅颖浦仪器制造有限公司);DSC 204 差热分析仪(德国Netzsch公司);D8-Advance 型X -射线衍射仪(美国Bruker AXS公司);傅立叶变换红外光谱仪(德国Bruker公司)。
1.2试药 苦杏仁苷原料药(南京草本源生物科技有限公司);中链脂肪酸甘油酯(MCT,阿拉丁试剂公司);正辛醇(南京化学试剂有限公司);甲醇为色谱纯(江苏汉邦科技有限公司);大豆磷脂(德国Lipoid公司);其他试剂均为市售分析纯。
2 方法与结果
2.1苦杏仁苷分析方法的建立
2.1.1色谱条件 色谱柱:Unitary C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇-水(25∶75);柱温:35 ℃;流速:1 mL·min-1;检测器:UVD;检测波长:210 nm。
2.1.2标准曲线的绘制 精密称取苦杏仁苷对照品20 mg,置于50 mL量瓶中,加入体积分数为50%的甲醇溶解后定容,作为储备液。精密量取上述储备液1,2,3,4和5 mL,分别置于10 mL量瓶中,加流动相定容至刻度,分别制得质量浓度为40,80,120,160和200 μg·mL-1的系列苦杏仁苷标准溶液。分别取适量上述标准液,置于离心管中,以1 200 r·min-1离心10 min,取上清液,按照2.1.1项下色谱条件进行测定,以质量浓度(x)对峰面积(y)进行线性回归。标准曲线方程为y=15 338x-51 256(r=0.999 8),苦杏仁苷质量浓度在40~200 μg·mL-1范围内线性良好。
2.1.3回收率 分别精确移取适量储备液加流动相制成质量浓度为40,120和200 μg·mL-1的苦杏仁苷对照品溶液,按照2.1.1项下色谱条件进行测定。计算得到低、中、高质量浓度回收率分别为100.29%(RSD=0.91%),99.12%(RSD=0.16%)和100.32%(RSD=0.82%)。结果表明,该方法测得的回收率符合要求,准确度良好。
2.1.4精密度 取加样回收率的中质量浓度样品,按照2.1.1项下色谱条件于1 d内进样6次,连续3 d进样测定精密度。结果其日内精密度为0.73%,日间精密度为1.12%。结果表明,该方法测得的精密度符合要求,重复性良好。
2.2苦杏仁苷磷脂复合物制备工艺及评价标准的建立 在查阅文献[13-15]及预实验的基础上选用磁力搅拌法制备苦杏仁苷磷脂复合物,设定苦杏仁苷与磷脂的质量比为1∶2,药物的质量浓度为4 mg·mL-1。称取处方量的苦杏仁苷和磷脂溶于适量的有机溶剂中,在30 ℃下反应1 h,旋转蒸发除去反应溶剂。
利用苦杏仁苷不溶于三氯甲烷而磷脂及复合物均易溶于三氯甲烷的特性,在反应产物中加入适量三氯甲烷充分溶解后,过滤收集沉淀,干燥并称定质量,即得到没有与磷脂发生反应的苦杏仁苷的质量M1,根据投药量M0,可计算得到苦杏仁苷与磷脂的复合率:
复合率=M0-M1/M0×100%
2.3苦杏仁苷磷脂复合物的制备
2.3.1反应溶剂 依据2.2项下操作方法,考察不同溶剂(乙醇、甲醇、四氢呋喃)对苦杏仁苷磷脂复合物复合率的影响。结果表明,所得苦杏仁苷磷脂复合物的复合率分别为86.12%±0.83%,99.54%±0.41%和96.44%±1.06%,综合考虑复合率与溶剂的毒性确定反应溶剂为甲醇。
2.3.2反应时间 依据2.2项下操作方法,考察不同反应时间(0.5,1.0,1.5和2 h)对苦杏仁苷磷脂复合物复合率的影响。结果表明,所得苦杏仁苷磷脂复合物的复合率分别为97.46%±0.63%,98.00%±0.21%,95.31%±0.39%和89.37%±0.93%。复合率随反应时间的增加呈先升高后降低的趋势,这可能是由于反应时间增加磷脂发生氧化引起的,因此确定反应时间为1 h。
2.3.3反应温度 依据2.2项下操作方法,考察不同反应温度(20,25,30和35 ℃)对苦杏仁苷磷脂复合物复合率的影响。结果表明,所得苦杏仁苷磷脂复合物的复合率分别为99.49%±0.51%,96.04%±0.42%,93.30%±0.88%和89.60%±0.21%,复合率随着反应温度的升高逐渐降低,而在20和25 ℃时复合率均在96%以上,考虑到温度控制稳定性的问题,确定反应温度为25 ℃。
2.3.4药物的质量浓度 依据2.2项下操作方法,考察不同药物的质量浓度(2,4,8和16 mg·mL-1)对苦杏仁苷磷脂复合物复合率的影响。结果表明,所得苦杏仁苷磷脂复合物的复合率分别为96.67%±0.35%,99.02%±0.60%,95.52%±0.93%和90.87%±0.74%。复合率随药物质量浓度的增加呈先升高后降低的趋势,当药物质量浓度为4 mg·mL-1时,复合物的复合率最高,可能是因为质量浓度过高时,药物与磷脂在甲醇中的溶解已接近饱和,导致复合率降低。因此确定反应药物的质量浓度为4 mg·mL-1。
2.3.5药物与磷脂的比例 依据2.2项下方法操作,考察苦杏仁苷与磷脂不同投料比例(2∶1,1∶1,1∶1.5和1∶2)对苦杏仁苷磷脂复合物复合率的影响。结果表明,所得苦杏仁苷磷脂复合物的复合率分别为96.50%±0.65%,96.59%±01.2%,97.13%±0.33%和96.26%±0.20%,各投料比之间的复合率无明显差异,比例为1∶1.5时,复合率最高,故确定投料比为1∶1.5。
2.4制备工艺的验证 根据2.3项下筛选得到的制备工艺:选择甲醇为反应溶剂,苦杏仁苷与磷脂的质量比为1∶1.5,药物的质量浓度为4 mg·mL-1,在25 ℃下反应1 h。重复3次,制备3批苦杏仁苷磷脂复合物,其复合率为99.36%±0.22%。说明该制备工艺稳定,重复性良好。
2.5苦杏仁苷磷脂复合物的鉴别
2.5.1红外光谱分析(IR) 分别取适量的苦杏仁苷、磷脂、苦杏仁苷磷脂物理混合物(质量比为1∶1.5)、苦杏仁苷磷脂复合物,KBr压片法压片,在400~4 000 cm-1进行红外光谱扫描,结果见图1。
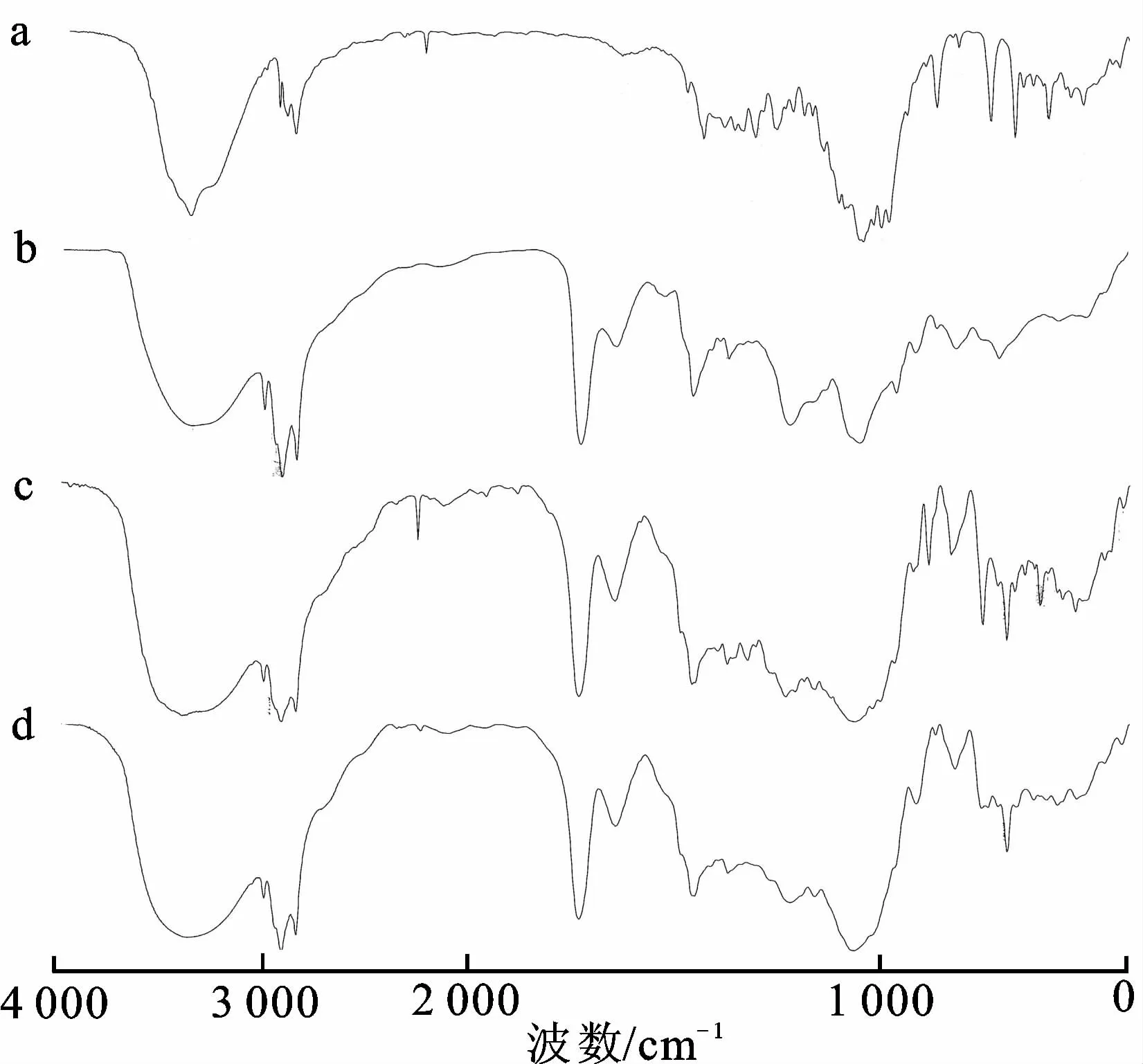
图1红外光谱图
A.苦杏仁苷;b.磷脂;c.苦杏仁苷与磷脂的物理混合物;d.苦杏仁苷磷脂复合物。
Fig.1 Infrared spectrogram patterns
A.amygdalin;b.phospholipid;c.amygdalin and phospholipid physical mixture;d.amygdalin-phospholipid complex.
由图1可知,苦杏仁苷与磷脂物理混合物的图谱基本上是苦杏仁苷与磷脂的叠加,各自的特征吸收峰保持不变,说明混合物中二者之间无相互作用。而与物理混合物的图谱相比,苦杏仁苷磷脂复合物的图谱发生了一定的变化,即苦杏仁苷在2 260.7和3 403.3 cm-1的特征吸收峰消失,磷脂在3 359.5,1 229.0 和1 059.8 cm-1的吸收峰发生位移。由以上分析可知,苦杏仁苷磷脂复合物与二者的物理混合物有明显区别。
2.5.2粉末X射线衍射分析(XRD) 分别取适量的苦杏仁苷、磷脂、苦杏仁苷磷脂物理混合物(质量比为1∶1.5)、苦杏仁苷磷脂复合物,进行X-射线衍射分析。检测条件为:测定管压为40 kV,测定管流为40 mA,衍射分析的范围为3°<θ<80°,结果见图2。
分析X射线衍射图谱可知,苦杏仁苷在3°<θ<80°范围内有许多的结晶峰呈现,这表明苦杏仁苷主要以结晶型形式存在。而磷脂则表现出了无定形的特征,其衍射图谱显示为一条宽带。在其物理混合物图谱中,仍出现了苦杏仁苷的晶型衍射峰,但是部分被掩盖,强度有所减弱,说明简单的物理混合并没有改变其存在状态,仍以结晶状态存在。在苦杏仁苷磷脂复合物的图谱中,苦杏仁苷的晶型衍射峰在图谱上完全消失,而主要呈现出磷脂的无定形峰,表明形成的磷脂复合物改变了其存在状态,由结晶型转变为无定形态,药物高度分散,分子无晶格束缚,自由能大,故有利于改善其溶解性能。
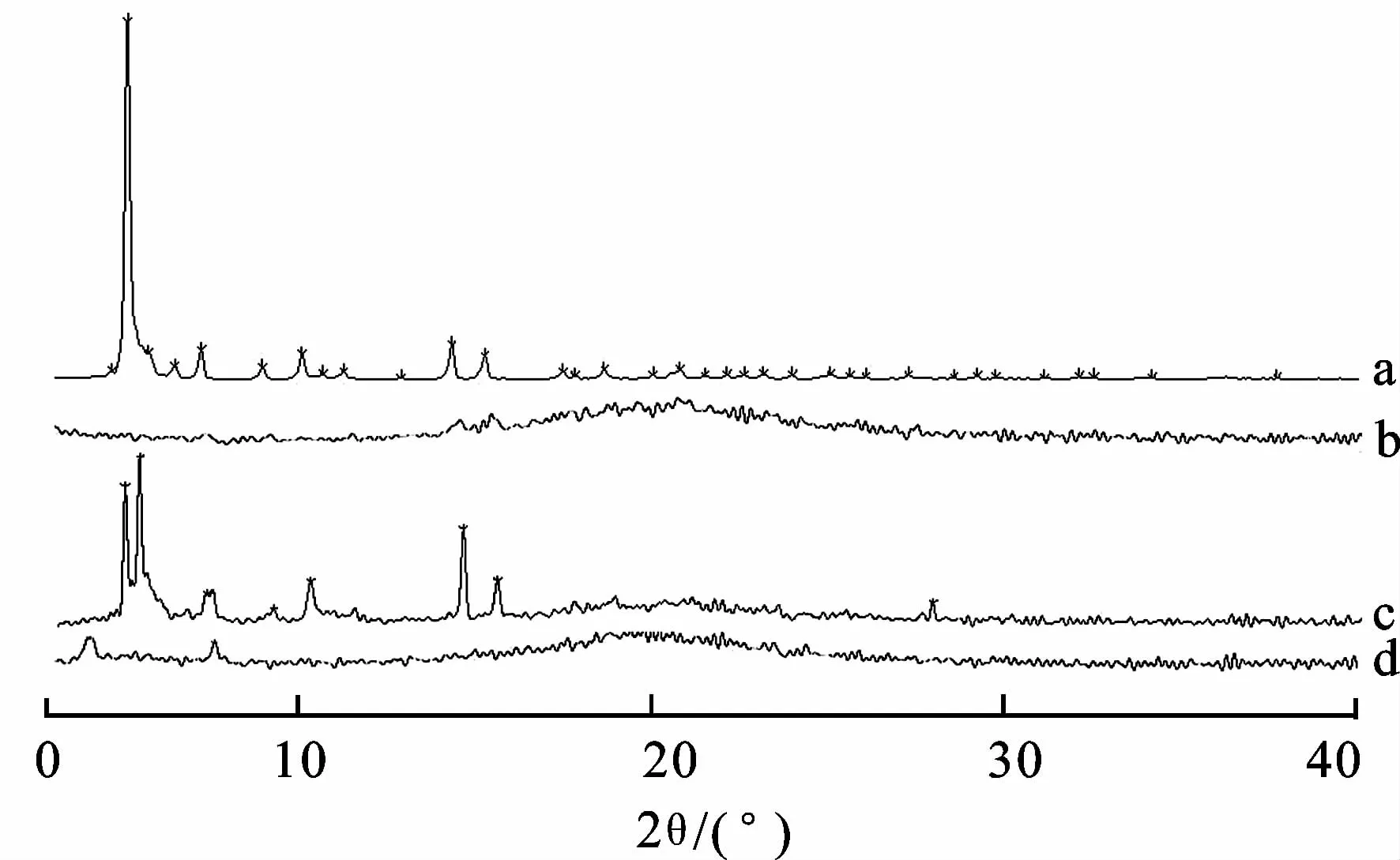
图2X-射线衍射图谱
A.苦杏仁苷;b.磷脂;c.苦杏仁苷与磷脂的物理混合物;d.苦杏仁苷磷脂复合物。
Fig.2 X-ray diffraction patterns
A.amygdalin;b.phospholipid;c.amygdalin and phospholipid physical mixture;d.amygdalin-phospholipid complex.
2.5.3差示扫描量热分析(DSC) 分别取适量的苦杏仁苷、磷脂、苦杏仁苷磷脂物理混合物(质量比为1∶1.5)、苦杏仁苷磷脂复合物,进行差示扫描量热分析。检测条件为30~270 ℃,升温时的速率为10 K·min-1。结果见图3。

图3DSC衍射图谱
A.苦杏仁苷;b.磷脂;c.苦杏仁苷与磷脂的物理混合物;d.苦杏仁苷磷脂复合物。
Fig.3 DSC diffraction patterns
A.amygdalin;b.phospholipid;c.amygdalin and phospholipid physical mixture;d.amygdalin-phospholipid complex.
由图3可知,苦杏仁苷在79.7 ℃时有较小的吸热峰,在225.5 ℃时则表现出了较大而尖锐的熔点峰;磷脂在235.1 ℃时则表现出一个小而尖锐的熔点峰。对比可知,苦杏仁苷与磷脂混合物的图谱仍可观察到苦杏仁苷的特征峰,表明简单的物理混合并未改变其热力学性质;而磷脂复合物图谱中,苦杏仁苷的特征吸热峰均消失,在203.7 ℃附近出现了一个较宽的吸热峰,提示苦杏仁苷形成磷脂复合物后,其热力学性质发生改变,是一种与物理混合物不同的新物相。
2.6苦杏仁苷磷脂复合物的理化性质考察
2.6.1不同介质中平衡溶解度的测定 精确移取油酸、MCT、蓖麻油和纯净水各5 mL,再分别向其中加入过量的苦杏仁苷和苦杏仁苷磷脂复合物,涡旋3 min,混匀,在37 ℃水浴条件下振荡24 h,取出,以12 000 r·min-1离心10 min,分别移取其上清液,用甲醇稀释一定倍数后,按照2.1项下分析方法测定苦杏仁苷、苦杏仁苷磷脂复合物的平衡溶解度。结果见表1。
由表1可知,苦杏仁苷制成磷脂复合物后,其水中溶解度没有改变;而在油酸中的溶解度提高了近3倍,MCT中提高了1.6倍,蓖麻油中提高了3.6倍,即在油中的溶解度显著提高。提示将苦杏仁苷制成磷脂复合物后,脂溶性显著提高。
表1苦杏仁苷、磷脂复合物在不同介质中的溶解度
Tab.1 Solubility of amygdalin and phospholipid complex in different media

(n=3)
2.6.2油水分配系数(PO/W)的测定 采用经典摇瓶法[16],分别取苦杏仁苷、苦杏仁苷磷脂复合物的正辛醇饱和水溶液5 mL,与水饱和正辛醇溶液5 mL混合,37 ℃下以100 r·min-1恒温振荡48 h,使药物在油水两相中的分配达到平衡,取出后以4 000 r·min-1离心10 min。吸取正辛醇层适量,用甲醇稀释至适宜倍数后,按照2.1项下分析方法分别测定苦杏仁苷、苦杏仁苷磷脂复合物的质量浓度,并按照下列公式计算油水分配系数。
PO/W=CO/CW,其中CO为平衡后正辛醇层中的药物质量浓度;CW为平衡后水相中的药物质量浓度。结果表明,苦杏仁苷和苦杏仁苷磷脂复合物的PO/W分别为0.026 0和0.170 6,即将苦杏仁苷制备成磷脂复合物使其油水分配系数提高了6.6倍。
3 讨论
制备磷酯复合物一般选用介电常数小的非质子传递溶剂,如甲醇、丙酮、四氢呋喃和二氯甲烷等[17]。这可能是由于在强极性溶剂中,不利于异种电荷离子间的化合反应。结合实验结果,甲醇与四氢呋喃的复合率均在95%以上,考虑到溶剂的毒性最终选用甲醇作为反应溶剂。
由IR、XRD和DSC研究可知,苦杏仁苷磷脂复合物不同于简单的物理混合物。IR图谱中显示苦杏仁苷中-CN在2 260 cm-1处的特征吸收峰消失,且没有新的化学键形成,推测复合物是通过-CN与磷脂中的极性基团之间的偶极-偶极作用形成复合物。XRD与DSC图谱分别显示与苦杏仁苷相比,复合物的晶体性质与相变特性均发生改变,这可能是由于苦杏仁苷高度分散于磷脂分子中所致。
药物的油水分配系数与药物在体内的吸收密切相关,是剂型设计的重要参数之一[18-19]。理化性质的初步研究表明,苦杏仁苷通过制成磷脂复合物,其油水分配系数提高了6.6倍,脂溶性明显增加,推测其原因,一方面由于苦杏仁苷在磷脂中高度分散并呈无定型状态,另一方面由于苦杏仁苷与磷脂的极性端结合后,磷脂的非极性端可自由转动包裹住磷脂的极性部分形成一个亲脂性的表面[20]。综合以上2种作用,最终使苦杏仁苷复合物表现出较大的脂溶性。
本文制备了苦杏仁苷磷脂复合物,并通过单因素考察确定了其制备工艺:甲醇为反应溶剂,苦杏仁苷与磷脂的质量比为1∶1.5,反应液中药物质量浓度为4 mg·mL-1,在25 ℃下磁力搅拌1 h。IR、DSC和XRD研究均显示,苦杏仁苷与磷脂形成了分子型复合物,复合物的脂溶性提高,油水分配系数增大。下一步将研究苦杏仁苷磷脂复合物肠吸收情况,为进一步开发苦杏仁苷新剂型、提高生物利用度提供实验基础。

