改良经皮介入取异物术在中心静脉导管断裂中的应用
程国兵 李晓阳 陆炜 王李华
外周导入中心静脉置管(peripherally inserted central catheter,PICC)是由外周静脉穿刺置管,并使其头端位于锁骨下静脉或上腔静脉内的深静脉导管植入术,因其操作简便、可留管时间长、痛苦小等优点,临床应用广泛[1]。但随着PICC应用的增多,越来越多并发症被发现,常见的并发症有血栓性静脉炎、导管堵塞、血栓形成、局部感染、导管移位或脱出、导管断裂等[2-5]。导管断裂虽不常见,但可引起异物栓塞、心律失常甚至心包填塞等严重并发症,往往需要及时处理[6]。过去一般采取外科手术取出断裂的导管,但创伤大、风险高,且断裂的导管可能在治疗过程中再次顺着血流移动位置,给手术带来不确定性。随着介入技术及器械的不断提高,经皮血管腔内异物取出术已成为治疗中心静脉导管断裂的首选术式[7-8]。有文献报道经皮血管腔内技术取出的异物,往往需要较为复杂的技术与材料处理[7,9-10],本院采用改良经皮介入取异物术成功取出了6例断裂在患者肺动脉及心脏的中心静脉导管,现将诊治过程报道如下。
1 资料和方法
1.1 临床资料 选取2015年6月至2018年1月本院收治的各种原因导致中心静脉导管断裂移位至心脏和肺动脉内的6例患者临床资料,其中男2例,女4例;年龄51~67岁;乳腺癌2例,食管癌2例,大肠癌1例,胃癌1例;置管时间42~155d;出现房颤1例,无明显不适症状5例;确诊后导管滞留体内1~4d,见表1。断裂导管均为美国巴德公司生产的三向瓣膜式,型号4F,全长60cm。6例患者均因长期化疗的需要而在外院于前臂贵要静脉置入中心静脉导管。患者或医务人员发现体外导管断裂后,经胸部X线摄片明确诊断后转至本院。
1.2 方法 在数字减影血管造影(DSA)下确定断裂导管主体及两端所在位置,见图1a。首先经右侧股静脉入路置入6F血管鞘。进入短泥鳅导丝(1.8m泰尔茂),沿导丝进入猪尾巴导管到达断裂导管主体位置,持续顺时针旋转猪尾巴导管,使其与断裂导管缠绕在一起,见图1b;然后缓慢回撤猪尾巴导管,遇到阻力时沿顺时针方向轻轻旋转导管,直至将断裂导管牵引至下腔静脉下方,见图1c;在这过程中,若出现断裂导管脱落,可能需要重复数次以上操作。然后穿刺左侧股静脉置入6F血管鞘,更换10F输送鞘血管鞘并进入R4导管,配合下腔静脉滤器抓捕器抓捕中心静脉导管断端并缓慢拉出体外,见图1d-e;在DSA下再次确认心血管系统无中心静脉导管残留,见图1f。所有患者在心电监护下进行手术。
2 结果
2例患者断裂导管近端和远端均位于左右肺动脉;2例患者近端位于右心房,远端位于右心室;1例患者近端位于右心房,远端位于肺动脉内;1例患者近端位于右心室,远端位于肺动脉内。其中1例患者术前X线片可见断裂导管近端位于上腔静脉,远端位于右心室;而术中造影透视发现,已移位至左右肺动脉主干。本组6例患者断裂导管均被取出,手术时间20~45min;术中无导管断裂,术后复查DSA发现无断裂导管残留,成功率为100%(6/6)。术中及术后均未出现心包填塞、严重心律失常等并发症,仅1例患者出现皮下瘀血。

表1 6例患者临床资料
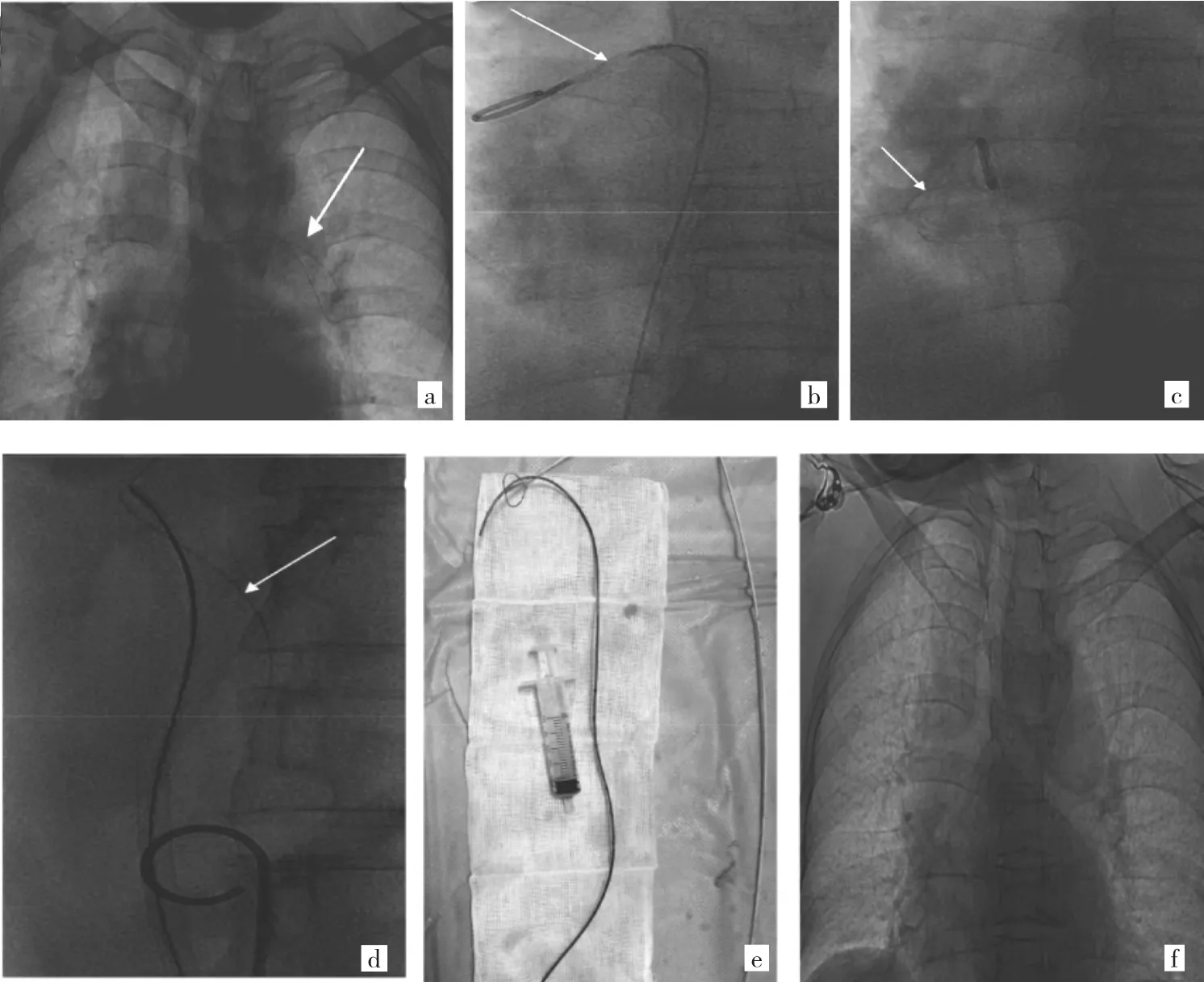
图1 改良经皮介入取异物过程(a:在DSA下确定断裂导管位置;a:旋转猪尾巴导管,使其与断裂导管缠绕在一起;c:缓慢回撤猪尾巴导管,将断裂导管牵引至下腔静脉下方;d:抓捕中心静脉导管断端并缓慢拉出体外;e:取出的断裂导管;f:在DSA下确认心血管系统无中心静脉导管残留)
3 讨论
中心静脉导管一旦断裂,会沿着血流移位至上腔静脉、右心房、右心室、肺动脉主干及其主要分支。Surov等[9]研究215例断裂导管最终迁移的位置,其中15.4%位于上腔静脉或外周静脉,27.6%位于右心房,22.0%位于右心室,35%位于肺动脉。在本研究中,2例患者断裂导管近端和远端均位于左右肺动脉;1例患者断裂导管近端位于上腔静脉,远端位于右心室;1例患者近端位于右心房,远端位于右心室;1例患者近端位于右心房,远端位于肺动脉内;1例患者近端位于右心室,远端位于肺动脉内。值得注意的是,术前断裂导管可能随着血流移位,给手术带来不确定性。本研究有1例患者术前X线摄片示断裂导管近端位于上腔静脉,远端位于右心室;而术中DSA发现断裂导管近端和远端均移位至肺动脉主干,最终顺利取出了该患者断裂的中心静脉导管。
当中心静脉导管断裂并残留在体内,多数患者短时间内无明显不适症状,远期可出现相应的并发症。国外一项综述报道了中心静脉导管断裂在体内可出现中心静脉导管失功(56.3%)、心律失常(13.0%)、胸部不适症状(4.7%)和脓毒血症(1.8%)等并发症[9]。当出现导管栓塞时,患者可能出现房颤、呼吸困难、咳嗽胸痛等症状[7]。本研究有1例患者出现房颤症状,手术移除断裂的中心静脉导管后症状消失。目前文献报道了一些常用的经皮取出技术,包括各种圈套器、猪尾巴导管、导引导丝、球囊、取物钳、网篮导管等[7-8,10-17]。圈套器相对安全、疗效确切,目前在临床上应用最为广泛[10,13,16]。但是取断裂的中心静脉导管时,圈套器必须置于导管的断端去抓捕;如果导管断端紧贴血管壁,就很难成功。此外,若断裂导管在肺动脉主干,特别是在肺动脉分支时,随着心脏的不断搏动,加上圈套器在肺动脉与肺动脉分支移动困难,故圈套器很难抓住中心静脉导管断端。Teragawa等[10]报道了圈套器配合手术缝线成功取出一根断裂在患者肺动脉的中心静脉导管,该自制装置能控制圈套器的方向,以便于抓捕游离在弯曲肺动脉内导管断端,但同时也存在血管损伤和其他尚未解决的风险,且操作复杂、需要自制装置,不利于临床推广。Kawata等[16]报道了一种去除残留在右心室和肺动脉硅胶导管的方法,利用圈套导丝、消融导管和网篮导管等装置并配合使用导管鞘。如果断裂的导管进入右心室小梁部而不能被圈套器抓捕时,通过对侧静脉入路进入导引导丝与断裂导管相交叉,再使用抓捕器抓住导管头端。如何处理断裂的中心静脉导管头端紧贴血管壁的难题,传统的导丝往往力量不足,异物钳是一种有效的方法,优点是抓取牢靠,不足之处是输送鞘管直径较大,不易到达迂曲的血管及小分支[8,13]。网篮导管最常用于胆道系统,这种导管适合取相对较大的异物,或异物紧贴血管壁相对固定且无自由活动的异物。但在取心血管系统异物手术中,同样存在可控性差、材料弹性不佳、需反复多次尝试、引起血管损伤的可能性大等缺点[13]。
本文采用的改良经皮介入取物术是指猪尾巴导管联合鹅颈抓捕器经介入将异物取出的方法。国内最早见于徐仲英等[18]报道的鹅颈导管联合抓捕器取心脏异物。刘婷等[19]介绍了猪尾巴导管联合抓捕器成功取出心血管腔内断裂导管的5例患者围手术期护理。但上述2篇文献均未详细阐述手术步骤及注意事项。本研究患者断裂导管多位于心脏或肺动脉,笔者联合应用猪尾巴导管和下腔静脉滤器鹅颈抓捕器取断裂导管,全部获得成功。猪尾巴导管的柔顺性较好、控制性强,能较好地移动断裂导管,加上头端接近圆形,能轻松地将断裂导管勾住且不易滑脱。鹅颈捕捉器具有操作简便、套圈直径可调节、抓取范围大等优点。笔者的经验是勾住断裂导管后,不断小心旋转并将断裂导管拉至下腔静脉较低位置,最后进入鹅颈抓捕器抓捕导管头端就十分容易,成功率很高,手术时间也较其他相关文献报道的短[12-13]。
总之,经皮介入取心血管异物具有微创、安全等优点,联合运用猪尾巴导管和鹅颈抓捕器两步法取断裂在心血管系统的中心静脉导管具有取材方便、操作简单、成功率高等优点。

