紫玉米、笃斯越桔花色苷与蛋白结合作用比较
于情情,王丹,马越,王宇滨,张敏,赵煜炜,赵晓燕,*
(1.沈阳农业大学食品学院,辽宁沈阳110161;2.北京市农林科学院蔬菜研究中心,北京市果蔬农产品保鲜与加工重点实验室,农业部蔬菜产后处理重点实验室,北京100097;3.龙大食品集团有限公司,山东莱阳265231)
花色苷(anthocyanins,ACN)是一类羟基和甲基化的2-苯基苯并吡喃阳离子与一个或多个糖分子通过糖苷键结合而成的化合物[1]。具有黄酮类特有的C6-C3-C6碳骨架结构,赋予果蔬颜色[2-3]。花色苷作为优良的天然色素,有良好的应用前景。不同作物花色苷的含量和种类不同,紫玉米及笃斯越桔中均含有很高的天然花色苷。研究表明紫玉米及笃斯越桔花色苷加工贮藏过程中易降解,严重限制了其应用。此外,花色苷具有很好的清除自由基、抗炎、抗肿瘤等活性[4],胃肠吸收稳定性是其功能发挥的前提。血清蛋白是血浆中含量最丰富的蛋白质,它能与许多内源及外源化合物结合,并能结合生物体内存在的多种微量元素,起到存储与转运的作用[5]。牛血清白蛋白(bovine serum albumin,BSA)的结构与人血清白蛋白高度近似,其三维结构,由3个结构域组成,每个结构域包含两个亚结构域,亚结构域以槽口相对的方式构成疏水腔,可与小分子化合物相互作用,提高其稳定性,因此常用作研究蛋白质与小分子相互作用的模型蛋白[6]。BSA可以与槲皮素[7]、橘皮苷[8]、蓝莓花色苷[9]相互作用,从而抑制其降解。近来,朱莉等报道紫玉米苞叶花色苷也可与BSA相互作用[10],然而不同来源花色苷与BSA结合作用是否相同,结合后能否提高花色苷稳定性及提高程度如何未有报道。本文采用荧光光谱、Zeta电位、粒径分析等方法比较紫玉米花色苷、笃斯越桔花色苷与BSA的结合效果,并分析不同来源花色苷与牛血清白蛋白相互作用后提高胃肠吸收稳定性的效果,为花色苷的产业化应用提供理论基础。
1 材料与方法
1.1 材料与试剂
紫玉米苞叶(涿紫一号):由北京市农林科学院蔬菜研究中心农产品加工实验室提供。
笃斯越桔提取物:北京绿色金可生物技术股份有限公司,花色苷含量20%。
甲醇(色谱纯):Dima技术公司;甲酸、乙酸乙酯、乙醇、二甲基亚砜(dimethyl sulfoxide,DMSO)、盐酸(分析纯):北京化工厂;三羟甲基氨基甲烷(trismetyl aminomethane,Tris):北京银丰科技发展有限公司;牛血清白蛋白(BSA):上海罗氏制药有限公司。
1.2 仪器与设备
固相微萃取仪(Visiprep DL SPE):美国Supelco公司;旋转蒸发仪(BüCHI-R-215):瑞士布奇公司;CHRIST真空冷冻干燥机(ALPHR Z-4 LD PLUS):北京博励行仪器有限公司;紫外分光光度仪(UV-1800):日本岛津公司;酶标仪(SpectraMaxi3):美国丹纳公司;纳米粒度仪(Nanotrac Wave):美国麦奇克有限公司。
1.3 方法
1.3.1 紫玉米花色苷的提取条件
取原料10 g,置于搅拌机中粉碎1 min,成粉末状。使用的提取溶剂为体积分数60%的乙醇水溶液,并用1 mol/L的盐酸将提取溶剂的pH值调至3;料液比为1 ∶50(g/mL);提取温度 50 ℃;提取时间 1 h;提取次数1次。提取结束后,将提取物进行过滤,其中上清液再放入旋转蒸发仪中旋蒸以得到花色苷的粗提取物,温度设为60℃。
1.3.2 紫玉米花色苷大孔树脂纯化条件
Amberlite XAD-8大孔树脂预处理后,填装在1.6 cm/60 cm的填装柱中,将上述粗提物上样,流速为7 mL/min,0.5%三氟已酸的水冲洗后,采用0.5%三氟已酸的乙醇洗脱,收集液体,45℃条件下旋转蒸发得到浓缩液。
1.3.3 紫玉米花色苷浓缩液与笃斯越桔花色苷C18固相微萃取纯化方法
C18柱用甲醇溶剂预处理后,采用甲醇、水溶剂将干扰组分洗脱下来,浓缩液上样后以一定的流速通过柱子。采用水、乙酸乙酯溶剂将干扰组分洗脱下来,同时保持分析物仍留在柱上,洗脱剂甲醇将分析物洗脱在收集管中,45℃条件下旋转蒸发得到浓缩液,冷冻干燥成干粉备用。
1.3.4 牛血清白蛋白与花色苷结合后荧光光谱测定
取一定量BSA固体溶于0.1 mol/L,pH 7.4的磷酸盐缓冲液,并用缓冲液稀释至5.0×10-7g/mL,备用,取一定量的花色苷用DMSO溶解,得到1.0×10-4g/mL花色苷备用,取BSA储备液400 μL于2 mL离心管中,向其中加入依次加入 1.0×10-4g/mL花色苷 0、40、80、120、160、200 μL,并用磷酸盐缓冲液定容至 2 mL 使其浓度为(0、2×10-6、4×10-6、6×10-6、8×10-6、10×10-6g/mL)于25℃放置1 h,取混合溶液200 μL,于非透明96孔板中,利用酶标仪分析加入花色苷前后荧光光谱的变化,测定参数为激发波长260 nm,发射波长范围290 nm~450 nm。
1.3.5 牛血清白蛋白与花色苷结合后结合量测定
BSA与紫玉米和笃斯越桔花色苷的结合量采用盐析法[11],使结合的紫玉米和笃斯越桔花色苷从未结合的紫玉米和笃斯越桔花色苷中分离开。在15 mL离心管中,加入1 mL BSA储备溶液,再加入不同量的花色苷储备溶液,配制花色苷与BSA的摩尔浓度比分别为 0、4、8、12、16、20、24、28、32 的溶液,加 0.1 mol/L 的磷酸盐缓冲液(pH 7.4)定容至10 mL,用涡流振荡器混匀。BSA的浓度为1.5×10-5mol/L,花色苷的浓度分别为 0、6×10-5、9×10-5、15×10-5、18×10-5、24×10-5、30×10-5、36×10-5、42×10-5、48×10-5mol/L。取制备好的纳米颗粒溶液10 mL,缓慢加入过量硫酸铵粉末,均匀搅拌,直至体系中有未溶解的硫酸铵,再搅拌10 min,仍有未溶解的硫酸铵,静置20 min后,取出上清液,放入离心管中,4℃条件下离心30 min,转速为10 000 r/min。取上清,用UV-Vis分光光度计检测上清液中的花青素的含量,即游离花青素的含量([Lf]),花色苷总量为[L],而结合的花青素的量([Lb])即:
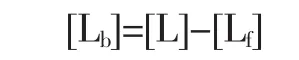
1.3.6 牛血清白蛋白与花色苷结合后Zeta电位与粒径测定
取一定量BSA固体溶于0.1 mol/L,pH7.4的磷酸盐缓冲液,并用缓冲液稀释至1.5×10-4mol/L,备用,取一定量的花色苷用DMSO溶解,得到1.5×10-3mol/L花色苷备用,配制花色苷与BSA的摩尔浓度比分别为0、2、4、6、8、10的溶液,取 BSA 储备液 1 mL 于 10 mL 离心管中,向其中依次加入1.5×10-3mol/L花色苷0、200、400、600、800、1000μL,并用磷酸盐缓冲液定容至10mL,用涡流振荡器混匀。使BSA浓度为1.5×10-4mol/L,花色苷浓度分别为 0、3×10-5、6×10-5、9×10-5、12×10-5、15×10-5mol/L于25℃放置1 h,取混合溶液1 mL于Nanotrac Wave仪器中测量粒径及电势。
1.3.7 牛血清白蛋白与花色苷结合后胃肠消化吸收稳定性测定
取一定量BSA固体溶于0.1 mol/L,pH7.4的磷酸盐缓冲液,并用缓冲液稀释至1.5×10-4mol/L,备用,取一定量的花色苷用DMSO溶解,得到浓度分别为10.5×10-5、6×10-5mol/L,备用。取花色苷储备液 5 mL于45 mL离心管中,向其中加入5 mL BSA,对照加入相应量的磷酸盐缓冲液,依次向离心管中添加2.5 mL抗坏血酸溶液(0.9%NaCl、1%抗坏血酸水溶液)、2.5 mL 胃液(0.3%NaCl、0.11%KCl、0.15%CaCl2·2H2O、0.05%KH2PO4、0.07%MgCl2·6H2O),用 1 mol/L NaHCO3调节pH值至4.0后,加入2.5 mL胃蛋白酶(0.52%猪胃蛋白酶)。氮吹5 min后在37℃下振摇30min,转速为100 r/min。调节pH值至2.0,氮吹5 min,再振摇30 min。然后调节pH值至6.9,加入1.5 mL肠胰蛋白酶(0.4%猪胰蛋白酶、2.5%胆酸盐、0.5%连苯三酚、1%生育酚),氮吹5 min,在37℃下保温2 h,在5 000 r/min条件下离心20 min得上清液,模拟胃肠消化系统揭示消化吸收过程中花色苷与牛血清白蛋白自组纳米颗粒后花色苷变化情况。
1.4 数据统计
采用DPS数据分析软件Duncan新复极差法(P<0.05),Origin 7.5软件作图;试验重复3次。
2 结果与分析
2.1 紫玉米和笃斯越桔花色苷与BSA结合作用研究
BSA分子中主要含有色氨酸、酪氨酸、苯丙氨酸3种氨基酸残基发射内源荧光,在本试验中激发光为260 nm,可认为蛋白质所呈现的荧光源来自分子中的酪氨酸残基[12-13]。通过荧光光谱可检测花色苷与牛血清白蛋白结合后的荧光光谱变化,分析结合情况。
图1反应了BSA与不同浓度花色苷在25℃条件下相互作用后荧光光谱的变化。

图1 花色苷对BSA荧光光谱的影响Fig.1 Effects of anthocyanin on fluorescence spectra of BSA
由图1可知,随着紫玉米苞叶花色苷浓度的增加,BSA的荧光强度逐渐下降,这与Tang L等[14]对矢车菊-3-O-葡萄糖苷和BSA之间的荧光猝灭光谱结果一致。BSA荧光光谱的最大发射峰通常在330 nm处,由图1可见,随着紫玉米与笃斯越桔花色苷浓度的增加,BSA最大发射波长均(λmax)从330 nm到340 nm,光谱有红移现象,进一步证明紫玉米与笃斯越桔花色苷与BSA之间存在一定的相互作用,疏水性下降且微环境中极性增加[15]。
2.2 紫玉米和笃斯越桔花色苷与BSA结合量比较
图2为紫玉米和笃斯越桔花色苷与BSA结合量分析。
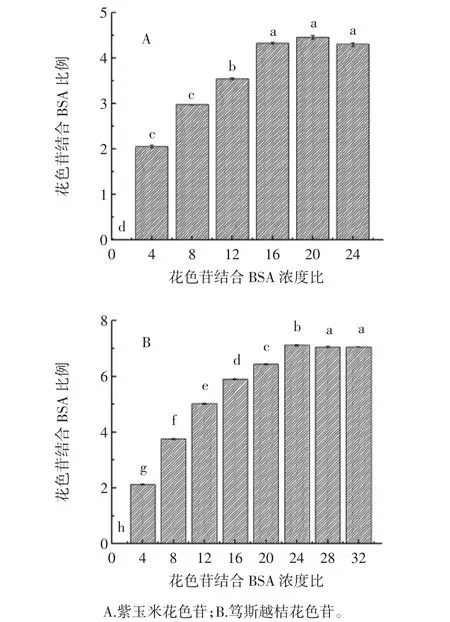
图2 花色苷与BSA的结合量分析Fig.2 Binding capacity of BSA with anthocyanins
随着紫玉米花色苷与BSA的浓度比由0增加到16,与BSA结合的紫玉米花色苷的量也逐渐增加;当紫玉米色苷与BSA的浓度比达到16时,即体系中紫玉米花色苷的浓度达到18×10-5moL/L时,BSA对紫玉米花色苷的结合达到了饱和。1 moL/L BSA最多可结合4 mol/L紫玉米花色苷。与紫玉米花色苷相似,随着笃斯越桔花色苷与BSA的浓度比由0增加到24,与BSA结合的笃斯越桔花色苷也逐渐增加;当笃斯越桔花色苷与BSA的浓度比达到24时,即体系中笃斯越桔花色苷的浓度达到36×10-5moL/L时,BSA对笃斯越桔花色苷的结合达到了饱和。1 moL/L BSA可结合7 moL/L笃斯越桔花色苷(图2)。BSA与笃斯越桔花色苷的结合量高于与紫玉米花色苷的结合量。刘建垒等[7]研究表明,1 moL/L BSA可结合10笃斯越桔花色苷,本研究表明1 moL/L BSA与紫玉米花色苷和笃斯越桔花色苷可结合的量分别为4 mol和7 mol,可见不同来源,不同结构的花色苷与BSA的结合量不同。
2.3 紫玉米和笃斯越桔花色苷与BSA结合后粒径及Zeta电位比较
图3为花色苷与BSA结合后粒径分析情况。

图3 花色苷与BSA结合后的粒径分析Fig.3 Partical sizes of BSA with anthocyanins
如图3,紫玉米及笃斯越桔花色苷与BSA结合后粒径小于10 nm,可见两种花色苷均能与BSA结合形成纳米颗粒。花色苷与BSA结合时在达到饱和结合量前随着花色苷浓度比例的增加即随着结合量的增加,粒径越来越大。进一步以摩尔浓度比10的条件下进行两种花色苷粒径的比较。紫玉米花色苷与BSA结合后平均粒径为6.99 nm,笃斯越桔花色苷与BSA结合后平均粒径为7.23 nm,紫玉米花色苷与BSA形成的纳米颗粒较笃斯越桔花色苷粒径小。
通过Zeta电位,对颗粒之间相互排斥的强度,表征胶体分散系的稳定性[16]。Zeta电位的绝对值越高,体系越稳定,反之,Zeta电位越低,越倾向于凝结或凝聚。Zeta电位与体系稳定性之间的大致关系如下:0~±5 mV 快速凝结或凝聚、±10 mV~±30 mV 开始变得不稳定、±30 mV~±40 mV 稳定性一般、±40 mV~±60 mV较好的稳定性、超过±61 mV稳定性极好。花色苷与BSA的电势分析见图4。
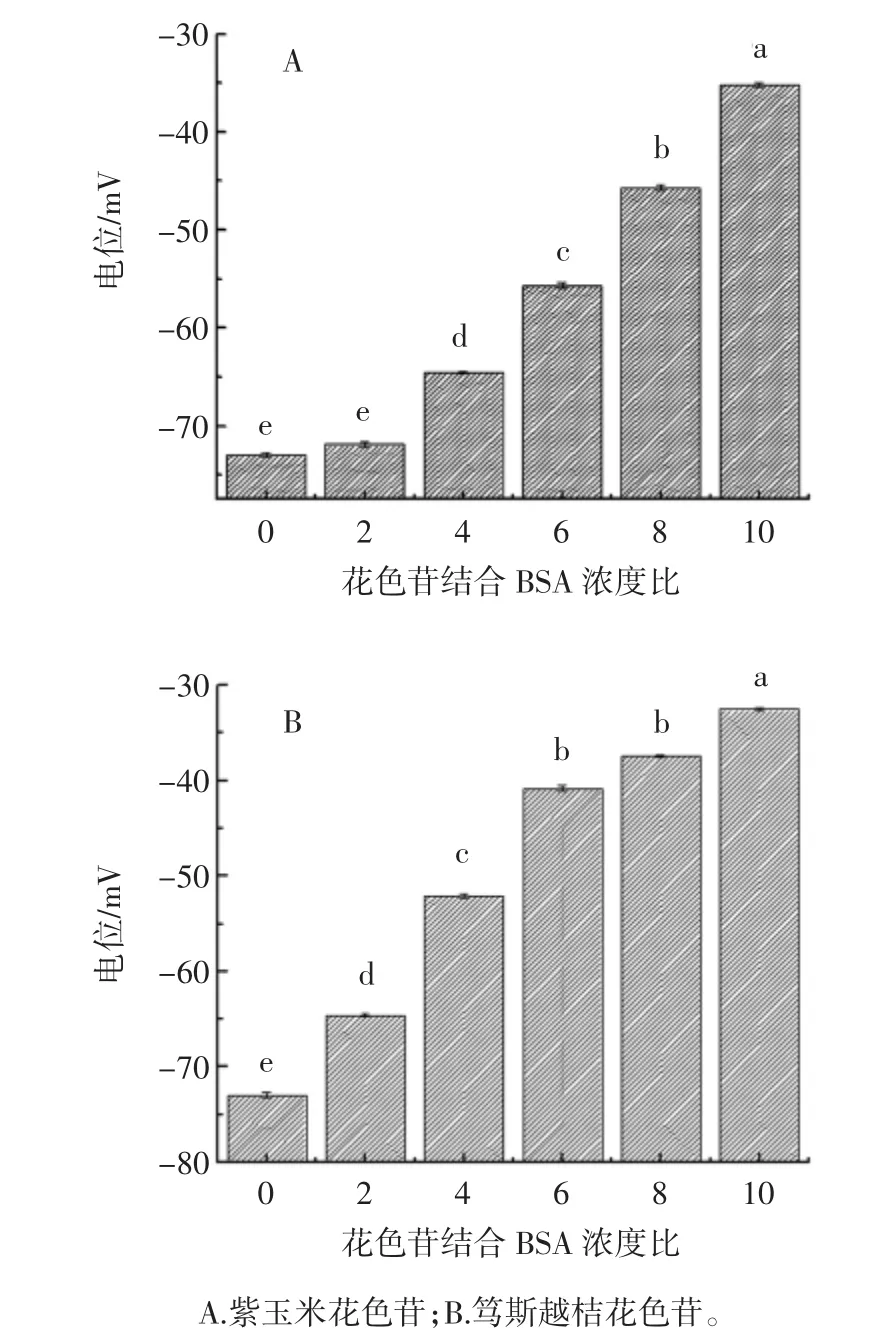
图4 花色苷与BSA的电势分析Fig.4 ζ-potential of BSA with anthocyanins
如图4,BSA 平均电势为-73 mV[17],超过±60 mV,其稳定性极好,且带负电。当加入花色苷后电势绝对值明显下降,紫玉米花色苷与BSA结合后Zeta电位绝对值下降至-71.9 mV,笃斯越桔花色苷与BSA结合后下降至-64.6 mV,可见紫玉米及笃斯越桔花色的加入对BSA的稳定性影响较大。随着紫玉米和笃斯越桔花色苷浓度的增加,与BSA结合后的平均电势分别下降至-35.2 mV及-32.5 mV。尽管加入花色苷后电位下降,然而两种花色苷结合BSA后Zeta电位绝对值均大于30 mV,可见形成的纳米颗粒仍具有一定的稳定性。
2.4 紫玉米和笃斯越桔花色苷与BSA结合后胃肠消化吸收稳定性比较
花色苷食入后,被胃及小肠等消化器官吸收才能参与代谢过程,胃肠消化吸收稳定性是花色苷食用功能发挥的重要前提。图5为添加BSA后花色苷含量的变化。

图5 花色苷与BSA在消化前后的花色苷吸光度Fig.5 Staility of anthocyanins with or without BSA in simulated gastricintestinal model
由图5可知,加入BSA紫玉米花色苷及笃斯越桔花色苷含量都下降。进一步比较消化前后,可观察到紫玉米花色苷及笃斯越桔花色苷含量均急剧下降,而添加BSA的花色苷含量下降则相对缓慢。
表1为花色苷结合BSA后消化吸收降解率的变化情况。

表1 紫玉米花色苷与笃斯越桔花色苷与BSA结合后消化吸收的降解率Table 1 The degradation rate of BSA with purple corn anthocyanins and Vaccinium uliginosum linn anthocyanins
根据表1所示,刚加入BSA时,紫玉米花色苷发生降解,降解率为14.92%,笃斯越桔花色苷的降解率为25.86%,BSA与花色苷的结合后笃斯越桔花色苷的含量降低程度较紫玉米花色苷大。通过模拟胃肠道吸收,测量花色苷的生物利用率,未加BSA的紫玉米花色苷及笃斯越桔花色苷的降解率分别为90.86%和88.05%。加入BSA后紫玉米花色苷降解率为15.56%,笃斯越桔花色苷的降解率为22.41%,明显提高了花色苷的生物利用率,且对紫玉米花色苷的稳定性提高效率高于笃斯越桔花色苷。
3 结论
紫玉米花色苷和笃斯越桔花色苷均与BSA发生相互作用形成较稳定的10 nm左右粒径的纳米颗粒;紫玉米花色苷和笃斯越桔花色苷可结合的量分别为4 mol和7 mol,紫玉米花色苷与BSA的结合量小于笃斯越桔花色苷,且结合后形成的纳米颗粒较笃斯越桔花色苷小;BSA提高了紫玉米花色苷及笃斯越桔花色苷的胃肠吸收稳定性,紫玉米花色苷的稳定性提高效率高于笃斯越桔花色苷。

