紫甘薯花色苷与大肠杆菌在体外的相互作用
王艳丽,李静,高品,王璐瑶,王建新,郑满荣,吕晓玲
(天津科技大学食品工程与生物技术学院,天津300457)
花色苷(anthocyanins),是一种天然、安全、无毒的 色素,具有抗氧化、抑制炎症、预防慢性病以及改善视力等生物学作用[1],而紫甘薯(purple sweet potato)是一种富含花青素的食物[2]。紫甘薯花色苷是保健食品,医药、化工制造业的重要原料。近年来,随着人类微生物组计划(The Human Microbiome Project,HMP)的展开,人类越来越意识到宿主的健康与肠道菌群有着密切的关系[3],对肠道微生物相关的研究空前关注。肠道菌群与人体的健康也是密不可分的,菌群失调会引起诸多疾病,如2型糖尿病、肥胖、肠炎、慢性肝炎等。研究肠道菌与花色苷的相互作用,有利于了解食物成分花色苷对肠道菌群与人体的共生关系的影响,为健康食品的开发提供依据[4]。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
紫甘薯花色苷提取物(花色苷含量以通用的矢车菊-3-葡萄糖苷计为15.59%,紫甘薯花色苷分子量一般在900 g/mol~1 200 g/mol,实际花色苷含量折算大约为40%;色价83.45):葫芦岛茂华生物有限责任公司。
大肠杆菌:取自健康成年女性(2个月内未服用抗生素和任何乳杆菌制剂,包括酸奶)粪便,经分离鉴定。
1.1.2 试剂
伊红美蓝琼脂(eosin-methylene blue agar,EMB):青岛高科园海博生物技术有限公司;LB培养液(胰蛋白胨10 g/L、酵母膏5 g/L、氯化钠10 g/L,调整pH值为7.0~7.2);酵母膏、胰蛋白胨:北京奥博星生物技术有限责任公司;乙腈(分析纯)、二甲基叔丁醚(分析纯):国药集团化学试剂有限公司;正丁醇(分析纯)、三氟乙酸(分析纯):上海麦克林生化科技有限公司。
1.2 仪器与设备
MJ-300-Ⅱ霉菌培养箱、YQX-Ⅱ厌氧培养箱:上海跃进医疗器械有限公司;LC-20高效液相色谱仪(high performance liquid chromatography,HPLC)、LCMS-IT-TOF离子阱飞行时间质谱仪:日本岛津公司;TBE300C高速逆流色谱仪(high-speed countercurrent chromatography,HSCCC):上海同田生物技术股份有限公司。
1.3 方法
1.3.1 大肠杆菌菌体活化
将已经活化好的发酵液,进行梯度稀释后,用平板计数法测定活菌体个数,使其发酵液浓度在9.0×1012cfu/mL。
1.3.2 紫甘薯花色苷对中性菌大肠杆菌体外增殖的抑制作用
采用滤纸片测试培养法[5],测定紫甘薯花色苷对中性菌大肠杆菌抑制作用。以水为空白对照,配制紫甘薯花色苷质量浓度为 3.2、6.4、9.6、12.8 mg/mL的水溶液。将灭菌后的6 mm滤纸片浸入无菌蒸馏水及其4种不同浓度的紫甘薯花色苷溶液中,无菌室内浸泡2 h,令其充分吸收。通风晾干,无菌条件下,将浸泡好的滤纸片贴在已涂布好的供试菌种的平板上,每个平板贴2片。将培养皿倒置37℃恒温培养箱下培养48 h后,用游标卡尺测量抑菌圈的直径。每个浓度做2个平行。
1.3.3 HSCCC溶剂体系的选择
在50 mL离心管中将不同溶剂按比例配置上下相,充分混合后分层,分别取4 mL上相和下相,分别装入另外两个干净的10 mL离心管中。将少量的花色苷提取物加入下相,溶解后取1 mL,用HPLC检测,记为C1。在剩余的含有花色苷的下相中加入3mL的上相。充分混合后再取1 mL下相,用HPLC检测,含量记为C2。
当两相平衡后,花色苷在上下相的分配系数=被分离物质在上相中的含量/在下相中的含量,即在两相中分配系数。据K值选择合适的溶剂体系作为HSCCC的固定相和流动相。
1.3.4 HSCCC制备分离纯化单体花色苷
分离纯化紫甘薯花色苷采用HSCCC方法,以二甲基叔丁醚∶正丁醇∶乙腈∶水∶三氟乙酸(2∶5∶1∶6∶0.01,体积比)为溶剂体系,固定相为上相,流动相为下相,采用正接正转,转速为850 r/min,温度25℃,检测波长为520 nm,流速1 mL/min。将花色苷提取物200 mg溶于15 mL下相溶剂中,注入高速逆流进样器。根据峰形手动收集大约在72 min~78 min流出液组分4,将流出液进行旋蒸后,-40℃减压浓缩冷冻干燥24 h。之后,-80℃冰箱保存,待鉴定。
1.3.5 质谱条件
采用电喷雾离子源ESI,正离子扫描模式,干燥气温度350℃,氮气流速1.5L/min,干燥器压力133.0kPa,喷射电压:4 kV,扫描一级质谱和二级质谱。
1.3.6 肠道缓冲液的配制
肠道缓冲液的配制,其主要参考Fleschhut等[6]研究的方法,是由还原性基质、微量元素混合液和磷酸缓冲液组成,见表1。

表1 肠道缓冲液成分Table 1 The component of intestinal buffer solution
1.3.7 大肠杆菌对单体花色苷的作用
花色苷溶液配制:称取25 mg单体花色苷溶于0.5 mL无菌超纯水中,配制成母液质量浓度为5mg/mL,花色苷最终质量浓度为0.1 mg/mL。吸取0.2 mL的肠道缓冲液加入无菌2 mL离心管中,依次加入0.3 mL大肠杆菌发酵液和100 μL的单体花色苷过滤液(花色苷需经0.22 μm水相膜过膜处理)。体外模拟肠道环境,放置于37℃厌氧培养箱中培养,以LB培养液为空白对照,分别在 0、1、5 h 取样,立即加入 50 μL 磷酸/水(17/3,体积比)溶液阻止花色苷的降解,使其pH值在3.8~4.1之间。
1.3.8 花色苷产物检测
产物采用HPLC法在波长520 nm和280 nm下进行检测,将待测液经0.22 μm过膜后,取滤液20 μL,进样。ZORBAX SB-C18色谱柱,柱温控制在30℃,流动相A:0.2%磷酸水溶液;流动相B:纯乙腈,线性梯度洗脱;0~30 min,B 液从 15%升至 25%;30 min~32 min,B 液从 25%降至 15%;32 min~35 min,B 液保持15%。
1.3.9 统计与分析
所有试验均重复3次,数据处理采用SPSS 22.0软件,采用Origin9.1软件作图。
2 结果与分析
2.1 紫甘薯花色苷对大肠杆菌体外增殖的抑制作用
采用滤纸片法,研究紫甘薯花色苷对大肠杆菌体外增殖的抑制效果。不同浓度花青素作用下大肠杆菌抑菌圈直径见表2。
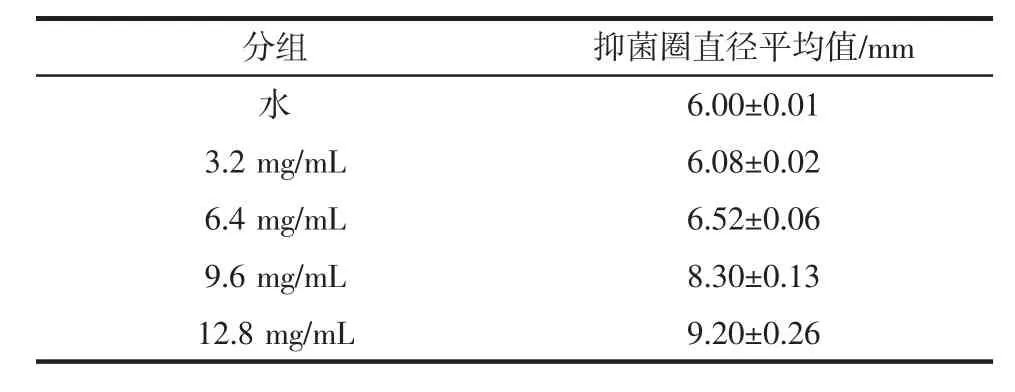
表2 不同浓度花青素作用下大肠杆菌抑菌圈直径Table 2 The inhibition zone diameter of Escherichia coli under different concentrations of anthocyanin
由表2可知,紫甘薯花色苷对大肠杆菌具有抑制作用,且抑菌圈直径随着紫甘薯花色苷质量浓度的增加而增大,花色苷质量浓度为12.8 mg/mL时抑菌圈直径最大达到(9.20±0.26)mm。
紫甘薯花色苷对大肠杆菌有一定的抑制作用,且抑菌效果随着紫甘薯花色苷浓度的增加而增加,呈正比。相对于古荣鑫等[7]研究的花青素浓度达到5 mg/mL,大肠杆菌完全被抑制,本研究抑菌效果要小很多;同时也比陈婵等[8]研究的紫甘薯原花青素质量浓度在10.5 mg/mL时,抑制大肠杆菌抑菌圈直径能达15.5 mm也要小。这可能与品种、试验差别、生长时间等不同有关系。韩永斌等[9]研究显示,花色苷的抑菌性是因为影响了大肠杆菌细胞壁的通透性,花色苷分子上的众多酚羟基与酶或者蛋白质通过氢键方式结合,破坏了膜蛋白质的合成,造成细胞质流失,从而导致了细胞通透性增强,使得细胞无法生存。
2.2 HSCCC法分离制备芍药素-3-咖啡酰-阿魏酰槐糖苷-5-葡萄糖苷
2.2.1 HSCCC溶剂体系的选择
溶剂体系的选择,要求溶剂体系两相间能快速明显地分层,与被分离物质不发生反应,样品能在溶剂体系中很好的溶解,并使其在两相间的分配系数K在0.5~2之间,且样品中不同化合物的分配系数比大于1.5。有较高的固定相保留值(不小于40%),这样快速能够保证有效的分离。紫甘薯花色苷不同溶剂体系的分配系数见表3。

表3 紫甘薯花色苷不同溶剂体系的分配系数(K)Table 3 Partition coefficient(K)of different solvent systems of purple sweet potato anthocyanins
由表3可知,编号1、3、5溶剂体系中,被分离组分3的分配系数超过2;编号2、4溶剂体系中,组分1的分配系数过小,不能很好的分离,故选择编号6溶剂体系2∶5∶1∶6∶0.01的溶剂体系进行紫甘薯花色苷的分离[10]。图1为高速逆流制备紫甘薯花色苷的组分。
2.2.2 花色苷单体结构鉴定
花色苷单体的结构鉴定采用液质联用在正离子模式下,进行一级质谱和二级质谱分析,通过色谱保留时间、紫外最大吸收波长并结合组分质谱的分子离子峰和碎片离子峰与Truong V D等[11-12]的鉴定结果进行比对验证,组分4分子离子1 125 m/z,碎片离子301,463,963,保留时间 18.25 min,用液相色谱-质谱联用技术(high performance liquid chromatography-mass spectrometry,HPLC-MS)鉴定推测为芍药素-3-咖啡酰-阿魏酰槐糖苷-5-葡萄糖苷。
组分4的液相色谱图见图2,峰5为芍药素-3-咖啡酰-阿魏酰槐糖苷-5-葡糖苷,含量为75%。

图1 高速逆流制备紫甘薯花色苷组分图Fig.1 The composition of anthocyanin in purple sweet potato was prepared by HSCCC
2.3 大肠杆菌对芍药素-3-咖啡酰-阿魏酰槐糖苷-5-葡萄糖苷降解作用机理初探
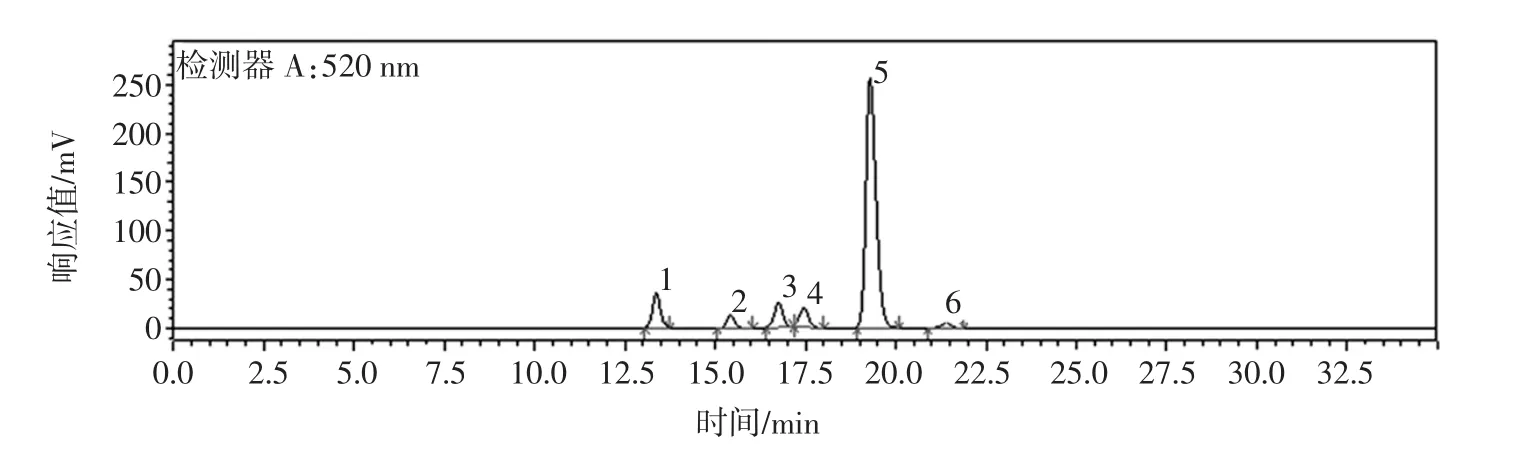
图2 组分4液相色谱图Fig.2 The HPLC diagram of component 4
2.3.1 采用HPLC(检测波长520 nm)法分析大肠杆菌对芍药素-3-咖啡酰-阿魏酰槐糖苷-5-葡萄糖苷(简称单体花色苷)的作用
检测波长在520 nm下,大肠杆菌作用过程中单体花色苷峰面积变化如图3所示。
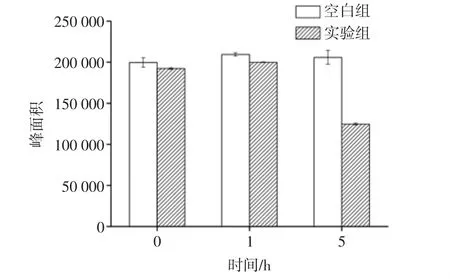
图3 大肠杆菌作用过程中单体花色苷峰面积变化Fig.3 Changes in the area of the monomeric anthocyanin peaks in the Escherichia coli
由图3可以看出,520 nm下,随着时间的延长,单体花色苷的含量在逐渐降低;在其他条件相同的情况下,试验组单体花色苷含量的降低程度明显比空白组大,这说明大肠杆菌对单体花色苷有促进降解的作用。随着时间的延长,紫甘薯单体花色苷峰面积呈逐渐降低的趋势,也就是说紫甘薯单体花色苷的含量降低了,5 h时,相比空白组,降低最明显。
2.3.2 采用HPLC(检测波长520 nm和280 nm)法推测大肠杆菌对单体花色苷降解作用机理
大肠杆菌对单体花色苷的作用液相色谱图(检测波长280 nm)如图4,大肠杆菌对单体花色苷作用(检测波长280 nm与520 nm下)对比液相色谱图如图5所示。
在520 nm可见光区下,由图5分析可知,与大肠杆菌作用的单体花色苷峰面积逐渐降低,说明花色苷含量降低了,花色苷结构被破坏,发生了降解反应,但没有新峰出现,说明没有形成新的有色降解产物。而在280 nm紫外光区下,图4可知,一是单体花色苷出峰位置有吸收峰且峰面积基本没有变化,说明花色苷分子量没有发生显著变化,而且分子中具有紫外吸收的芳香环没有被破坏。二是单体花色苷的出峰位置没有变化,说明分子没有降解成更小的分子,也就是说没有发生水解或者裂解等反应,整个分子没有断裂,但有可能个别的键打开了,花色苷呈色基团发生了改变,变成了没有颜色的降解产物。

图4 大肠杆菌对单体花色苷的作用液相图谱Fig.4 HPLC chromatogram of the effect of monomeric anthocyanin by Escherichia coli
整体从HPLC(280 nm与520 nm)检测结果分析,说明花色苷基团可能出现开环现象,没有了呈现颜色的基团。可能由蓝色或紫色的醌型碱转变成部分无色的甲醇假碱形式,随着时间延长,变成这种甲醇假碱形式的基团逐渐增多,所以在图中520 nm下呈现的显色基团含量就下降了许多。


图5 试验组中大肠杆菌对花色苷作用对比液相色谱图Fig.5 HPLC chromatogram of the effect of monomeric anthocyanin by Escherichia coli
关于花色苷目前可能降解的途径一般包含以下3种:第一种是花色苷发生加成反应,也就是水加成的过程,然后C-O键结构发生开环,生成中间产物查尔酮类糖苷,进而最终降解为香豆素类衍生物;第二种是在第一种生成查尔酮类糖苷后,发生水解反应,糖苷被水解掉,剩下查尔酮,最终降解为苯甲酸类衍生物;第三种是花色苷经水解脱去本身带的单糖葡萄糖,生成糖苷配基,进而生成α-二酮,而α-二酮属于不稳定的中间产物,所以继续降解,降解为醛和苯甲酸衍生物[13],而酰基化的花色苷也可以水解去酰基,成为非酰基化的花色苷。
本试验中大肠杆菌对单体花色苷降解的途径可能是第一种或者第二种。所以,大肠杆菌对芍药素-3-咖啡酰-阿魏酰槐糖苷-5-葡糖苷有降解作用,但在5 h之内,还没有出现进一步的峰值变化,也就是说大肠杆菌只能对其起到开环作用,但没有进一步反应,也没有发生去酰基化作用。这可能是尽管体外在模拟肠道环境,也无法达到与肠道微生物环境相同的程度。因为除了肠道菌,肠道中可能还有其他物质影响对膳食多酚的作用。有研究表明,有些谷物类食品需要在结肠发酵中,细胞壁多糖阿魏酸酯才能在多糖水解酶作用下降解成可溶性的寡聚糖阿魏酸酯[14],进而在双歧杆菌等肠道微生物所产酯酶的催化下形成游离阿魏酸,也就是说在体外还无法达到相同的效果。
3 讨论与结论
1)采用滤纸片法对紫甘薯花色苷的抑菌活性进行试验,结果表明,紫甘薯花色苷对大肠杆菌生长具有一定的抑制作用,抑菌作用强度随着花色苷浓度的增加而增加。
2)利用高速逆流色谱法,从紫甘薯提取物中分离组分4单体花色苷,鉴定为:芍药素-3-咖啡酰-阿魏酰槐糖苷-5-葡糖苷,含量为75%。通过HPLC(520 nm和280 nm)比较分析法,研究大肠杆菌对该单体花色苷的作用。表明在本研究的时间范围内,大肠杆菌的作用没有使花色苷发生水解或者裂解等反应,即没有被降解成更小的分子。分子中呈现紫外吸收的芳香环结构并没有被整体破坏,只是花色苷呈色基团发生了改变,形成了没有颜色的降解产物。

