NLR、FIB和Pgp1评估结直肠癌预后的价值
(陕西省宝鸡市中心医院 肛肠外科,陕西 宝鸡 721008)
结直肠癌是临床常见的恶性肿瘤,发病率和病死率呈逐年上升趋势[1-3]。目前临床上对结直肠癌患者的预评估主要是TNM分期[4-5]。但是TNM分期无法满足个体化治疗的要求。目前,临床上正着力研究可以有效评估结直肠癌预后的检测手段。本研究拟综合检测患者中性粒细胞与淋巴细胞比值(neutrophillymphocyte ratio, NLR)、纤维蛋白原(Fibrinogen,FIB)和P-糖蛋白1(P-glycoprotein 1, Pgp1)在癌组织的表达。以早期发现有转移或复发风险的结直肠癌患者,从而制定精准有效的治疗方案,提高患者的预后。
1 资料与方法
1.1 一般资料
选取2010年1月-2012年5月于陕西省宝鸡市中心医院行结直肠癌根治性切除术的223例患者作为研究对象。纳入标准:①原发性结直肠癌且行根治性切除术;②签署留取病理标本同意书,病理组织保存完整;③由AJCC第7版肿瘤分期指南诊断的Ⅰ期或Ⅱ期的结直肠癌[6]。排除标准:①于本院治疗前进行过放化疗;②行根治术时合并其他肿瘤。本研究经医院伦理委员会审核批准。
1.2 方法
1.2.1 临床资料 于患者手术前后整理并记录完整临床资料,包括发病年龄、性别、肿瘤大小、病理学类型、肿瘤位置、TNM分期、脉管癌栓及淋巴结转移情况,有无术前肠梗阻、术后并发症等。
1.2.2 NLR水平的测定 于次日清晨采集所有患者术前外周血,嘱患者采血前8 h内不要喝水进食。以患者肘正中静脉为穿刺点,穿刺部位2次消毒后,抽取5 ml血液于血常规专用紫色真空采血管中,反复颠倒混匀。标记患者姓名、性别、住院号、采血时间、采血用途及采血人姓名等送检。使用HF-3800血液细胞分析仪(山东海力孚公司)分析患者血液样本,记录中性粒细胞计数(Neutrophil, N)、淋巴细胞计数(Lymphocyte, L),计算两者比值:NLR=N/L。
1.2.3 FIB水平的测定 于次日清晨采集所有患者术前外周血,嘱患者采血前8 h内不要喝水进食。以患者肘正中静脉为穿刺点,穿刺部位2次消毒后,抽取5 ml血液于凝血四项专用蓝色真空采血管中,反复颠倒混匀。注意采血时间尽量≤5 min,采血带不要扎的太紧,以防激活凝血机制。操作过程中避免产生气泡,以防FIB变性。标记患者姓名、性别、住院号、采血时间、采血用途及采血人姓名等送检。使用Clauss法分析患者血液样本,获得凝血四项报告单,记录FIB的数值。
1.2.4 肿瘤组织Pgp1表达水平的测定和评分 采用SP法进行免疫组织化学,一抗为兔抗人Pgp1多克隆抗体,二抗为加入生物素标记的羊抗兔工作液。4%中性甲醛固定病理标本,脱水后石蜡包埋。①以4μm厚进行连续切片,常规烤片及二甲苯脱蜡,梯度酒精脱水,PBS冲洗5 min×4次;②3%H2O2室温避光孵育10 min灭活内源性过氧化氢酶,PBS冲洗5 min×4次;③用柠檬酸抗原修复液进行热抗原修复;④山羊血清工作液室温下封闭10 min后弃去工作液勿洗;⑤将兔抗人Pgp1多克隆抗体分别加入同一患者的几张切片并置于4℃冰箱孵育过夜,次日37℃复温40 min后PBS冲洗5 min×4次;⑥加入生物素标记的羊抗兔二抗工作液,37℃孵育30 min,PBS冲洗5 min×4次;⑦二氨基联苯胺显色,流水冲洗15 min后苏木素轻度复染,常规脱水、透明、干燥及封片,最后于光镜下观察并拍照。
由1位经验丰富的病理科医生观察所有切片,每张切片随机观察10个高倍镜视野,根据染色结果进行评分:0分为<5%;1分为≥5%~<25%;2分为≥25%~<50%;3分为≥50%~<75%;4分为≥75%。染色强度评分:不显色0分;浅黄色1分;棕黄色2分;深棕色3分。每张切片分值=染色细胞数分值×染色强度分值。若每张切片分值<1分,则判断免疫组织化学结果阴性(-);若为1~3分,则为弱阳性(+);若为4~5分,则为中度阳性(++);若>5分,则为强阳性(+++)。定义Pgp1表达中度阳性(++)和强阳性(+++)为高表达,阴性(-)和弱阳性(+)为低表达。
1.3 随访及观察指标
对所有参与研究的223例患者进行为期5年的随访,首次随访为治疗结束1个月后,之后每隔1个月电话随访1次。终点事件为:患者自入选时间起于随访期间发生不良预后事件,包括患者结直肠癌复发、分期上升及出现其他器官转移。原始资料参照患者入院记录、手术记录及麻醉记录,并将末次随访记录作为结果,记录患者发生不良预后的人数并定义为预后不良组,其余患者定义为预后良好组。患者拒绝访问、中途退出及死于其他与研究无关的原因定义为失访。
1.4 统计学方法
数据分析采用SPSS 19.0统计学软件,计量资料以均数±标准差(±s)表示,计数资料以率(%)表示,Kaplan-Meier法绘制生存曲线,单因素Cox回归分析筛选变量,预后影响因素的分析采用多因素Cox回归模型。绘制ROC曲线,利用Kolmogorov-Smirnov检验比较不同指标评估结直肠癌预后的准确性。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料
223例患者肿瘤直径平均(4.32±0.56)cm;TNM分期Ⅰ期46例,Ⅱ期177例;平均淋巴结转移10.46个;脉管癌栓阴性169例,阳性54例;腺癌101例,黏液腺癌122例;术前肠梗阻患者89例,无术前肠梗阻患者134例;术后并发症患者50例,无术后并发症患者173例;Pgp1高表达149例,低表达74例;高NLR值123例,低NLR值100例;高FIB值98例,低FIB值125例。
2.2 患者随访情况
在随访结束时,失访患者共11例,124例患者随访结束未发生终点事件,5年生存率为58.49%(124/212),定义为预后良好组,78例患者出现了终点事件,定义为预后不良组。Kaplan-Meier生存曲线显示,随着时间延长,全体患者不良预后增多,在随访的第20、40个月产生不良预后的患者增长较为明显。见图1。

图1 患者不良预后生存曲线图
2.3 影响结直肠癌患者预后的单因素Cox回归分析
将可能影响疾病预后的因素(年龄、性别、肿瘤部位、TNM分期、病理类型、术前肠梗阻、术后并发症、肿瘤组织Pgp1表达、NLR及FIB水平)逐个纳入Cox比例风险模型中进行单因素分析。结果发现肿瘤部位、TNM分期对疾病预后无影响(P>0.05),患者年龄、性别、病理类型、术前肠梗阻、术后并发症、Pgp1、NLR、FIB水平对疾病预后影响显著(P=0.027、0.003、0.035、0.021、0.013、0.025、0.012和 0.005)。
2.4 影响结直肠癌患者预后的多因素Cox回归分析
筛选单因素Cox回归差异有统计学意义的因素进行多因素Cox回归分析(引入水准0.05,剔除水准0.10)。结果显示:年龄和性别对患者预后的影响不明显(P>0.05);病理类型、术前肠梗阻、术后并发症、Pgp1、NLR及FIB是结直肠癌预后的独立影响因素(P<0.05)。见附表。
2.5 Pgp1的结直肠癌预后分析
将Pgp1表达作为结直肠癌术后预后的指标,Pgp1在结直肠癌患者预后的敏感性和特异性分别为60.23%(53/88)和 70.16%(87/124)。
2.6 NLR和FIB单独及联合诊断对结直肠癌预后转归的评估价值分析
NLR诊断结直肠癌预后的AUC为0.801,最佳诊断点为4.15 ng/ml,其敏感性为62%,特异性为92%;FIB的AUC为0.678,低于NLR,最佳诊断点为594.82 ng/ml,其敏感性为36%,特异性为99%。NLR和FIB两者联合诊断结直肠癌预后的AUC最高,为0.856,其敏感性为78%,特异性为79%。两者联合预测结直肠癌预后的AUC与NLR和FIB比较,差异有统计学意义(Z=4.939和2.591,P=0.000和0.009)。见图2。
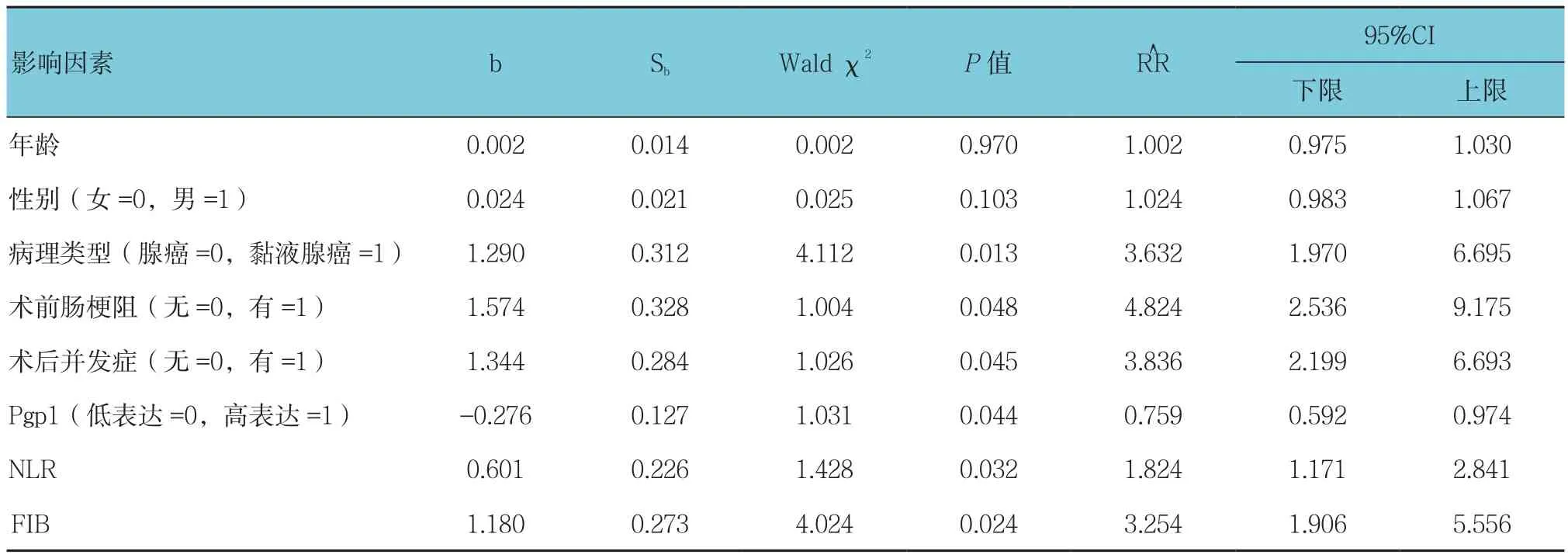
附表 患者不良预后的Cox多因素分析

图2 NLR和FIB单独及联合诊断对结直肠癌预后的ROC曲线
3 讨论
结直肠癌在我国的5年生存率为32.8%~61.4%[7-8]。因此其预后的研究一直是近年的热点。目前临床上主要通过病理分型、TNM分期等评估预后[9-10]。然而疾病的演变随着个体及环境的影响愈发复杂,本研究将NLR、FIB水平和癌组织Pgp1的表达进行综合分析,以提高预测结直肠癌患者预后的准确性。
本研究的5年生存率为58.49%,与KENNEDY等研究结果基本一致[7]。笔者认为可能是由于本研究纳入的患者平均年龄高,大部分合并有其他非肿瘤性的慢性疾病,或由于结直肠癌患者本身的危险因素较多,对预后产生了不良影响。目前越来越多的研究提示血液学指标和免疫学指标与肿瘤预后密切相关[11-12]。本研究中病理类型、FIB、NLR、Pgp1、术后并发症及术前肠梗阻依次为结直肠癌的预后影响因子。血液学指标FIB、NLR和免疫学指标Pgp1会影响结直肠癌患者预后,可能因为:一方面纤维蛋白原FIB升高预示着由纤维蛋白构成的肿瘤细胞骨架被破坏,癌细胞发生了浸润与转移,与大部分发生癌症转移的患者体内凝血系统异常相符[13]。NLR升高标志着肿瘤增殖旺盛但体内免疫防卫机制处于被抑制的状态,预示着预后较差[14]。另一方面,近年来,一些免疫学指标细胞膜跨膜糖蛋白Pgp1可主动泵出对正常细胞来说的异物[15-16]。当其高表达时,可限制癌细胞浸润和转移,提示患者预后良好。
为进一步探究NLR、FIB和Pgp1对结直肠癌患者预后的影响,患者对其进行ROC曲线分析。结果显示,联合NLR和FIB评估患者预后的敏感性可达78%,较3者单独预测时均有提高。可能是因为NLR和FIB分别从机体免疫状态与凝血功能水平方面客观反映肿瘤细胞的增殖转移情况,并且双指标的联合评估在一定程度上减少了血清、组织及机体反应等方面个体差异对预测结果的影响,提高了预测准确性。
本研究纳入的样本量较少,且Pgp1为定性指标,相比计量指标其准确性有所偏差。建议将来的研究者选择更多计量资料进行分析,并分别定义年轻患者和老年患者群体各项危险因素指标的临界值,以提高其预后的准确性。
综上所述,本研究表明Pgp1、NLR及FIB是影响结直肠癌患者预后的独立危险因素,NLR和FIB联合检测可提高预后的特异性,协助临床筛选具有预后不良风险的患者,从而制定高效的治疗方案。

