MicroRNA-486和TGF-β1对人主动脉瓣膜钙化的影响及其机制研究*
(上海健康医学院附属周浦医院,上海 201318)
近年来,全球钙化性主动脉瓣疾病(calcific aortic valve disease, CAVD)的发病率不断上升,成为老龄人最常见的心脏瓣膜疾病之一[1-3]。最新研究提示,多种microRNA(miRNA)在主动脉瓣钙化及瓣膜内异位骨化中起重要调控作用[4],国外学者HEATH等[5]亦在研究中阐述了miRNA与CAVD的联系。但笔者查阅文献发现miRNA-486与CAVD的研究较少,现有研究发现其多数功能作用与转录生长因子-β1(transcription growth factor-β1, TGF-β1)相关,为 CAVD进程中的靶基因及作用机制仍未明确[3-5]。因此,本研究拟通过转染miRNA-486模拟物和抑制物,进一步验证其作用,以期为CAVD的治疗寻找一个潜在靶点。
1 材料与方法
1.1 主要材料及仪器
1.1.1 细胞及试剂 人主动脉瓣膜间质细胞(human aortic valve interstitial cells, VICs)由上海健康医学院附属周浦医院提供,维生素C、地塞米松、β-甘油磷酸、茜素红购自美国Sigma生物公司,胶原酶、SMAD3抗体、TGF-β1抗体购自杭州远方生物科技有限公司,高糖DMEM培养基、青霉素/链霉素、10%胎牛血清、胰蛋白酶购自美国Gibco公司。
1.1.2 主要仪器 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRTPCR)仪(ABI7900HT)、逆转录试剂盒购自美国Applied Biosystems公司,日本Olympus FV1000激光共聚焦显微镜(日本Olympus公司),Eppendorf基因扩增仪、Leica倒置荧光相差显微图像系统、组织切片机、组织包埋机购自上海赛默飞世尔科技有限公司,多功能酶标仪则(美国BioTek公司),Odyssey双色红外激光成像系统(美国LICOR公司),免疫荧光试剂包括多聚甲醛、Triton X-100、BSA、PBS、DAPI、抗淬灭封片剂购自上海国药集团化学试剂有限公司,核酸蛋白电泳设备(上海生工生物工程股份有限公司),各种离心及冷藏设备(低温冰箱和液氮罐)(上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 细胞培养 用胶原酶溶解人主动脉瓣组织后,刮取内皮细胞层再次溶解制成细胞悬液。常规培养于高糖DMEM培养基,添加10%胎牛血清、100μg/ml青霉素和链霉素,控制培养箱条件为37℃、5%二氧化碳CO2恒温。密切观察12 h后改用钙化培养基(含10 nmol/L地塞米松、50 mg/L维生素C和10 mmol/L β-甘油磷酸钠)培养细胞,观察两组细胞状态,每隔2天更换培养液,当细胞生长至70%~80%时,胰蛋白酶消化传代,取传代后3~7代细胞进行后续实验。
1.2.2 双荧光素酶报告基因检测 初步应用TargetScan 6.2版本等生物信息学软件检索miRNA-486靶基因,结果显示TGF-β1基因可能是其潜在靶基因。收集第3代VIC细胞按1×106个/孔接种于6孔板,利用PCR法获取VIC细胞中的cDNA模板,构建包含miRNA-486结合位点TGF-β1基因3’-UTR的序列,插入pMIR-REPORT luciferase报告载体中,经限制性内切酶处理后,纯化鉴定。构建获得的TGF-β1-WT(野生型)重组载体质粒和TGF-β1-Mut(突变型)重组载体质粒,所有构建获得的表达质粒经酶切和测序鉴定。按照Lipofectamine 2000试剂盒说明书进行操作,将上述重组质粒载体和miR-486 mimic、miR-486 mimic NC、miR-486 Inhibitors、miR-486 Inhibitors NC(美国Invitrogen公司合成)共转染293T细胞(生长状态良好),24 h后行双荧光素酶报告基因检测。以荧光素为底物,检测萤火虫荧光素酶活性,加入Stop&Glo8试剂,检测海肾荧光素酶活性,以海肾荧光素酶活性作为内参照,同时加入抑制荧光素酶催化荧光素发光的物质,计算各组细胞内的相对荧光素酶活性。荧光素酶活性=萤火虫荧光素酶活性值/海肾荧光素酶活性值。实验操作重复3次。
1.2.3 miRNA-486转染及分组 分别将miR-486 mimics、miR-486 mimics NC、miR-486 mimic Inhibitors、miR-486 mimic Inhibitors NC通过Lipofectamine 2000转染第3代VICs细胞,分为4组。PBS洗涤3次后,各组按量加入DEPC处理的水,轻荡混匀。调整细胞状态,在500μl无血清、无双抗的转染专用opti-MEM培养基中加入Lipofectamine 2000,作用5 min。轻轻吹打,室温静置20 min。弃培养皿中细胞上清样,配成0.5 ml转染液,PBS清洗培养皿中细胞2次,加入无血清的1.5 ml opti-MEM。放入培养箱孵育6 h,弃转染液,PBS洗1次,加入成骨诱导液继续孵育。
1.2.4 Western blot检测 采用Western blot检测内源性TGF-β1蛋白表达水平。选取第3代细胞,转染miRNA并成骨诱导后第7天,取6孔细胞培养板,PBS清洗2次,1 200 r/min离心5 min,弃上清液,加入细胞裂解液,摇匀,静置20 min。4℃、12 000 r/min离心10 min,取上清液置于新的离心管中。用BCA蛋白质浓度测定试剂盒进行蛋白定量,样品按量加入96孔的蛋白标准孔,再加入200μl BCA工作液,反应30 min,SDS-PAGE(8%分离胶,5%浓缩胶)凝胶电泳分离后转移至PVDF膜,5%脱脂奶粉封闭1.5 h后分别加入TGF-β1抗体稀释液(1∶1 000),4℃过夜孵育,TBS洗膜3次,5 min/次。室温下加入1∶3 000的二抗稀释液(辣根过氧化物酶标记的羊抗兔IgG)孵育1.5 h,TBS洗3次。
1.2.5 茜红素染色 沉积的钙可与茜素红发生显色反应,细胞外基质被染成橘红色,而细胞本身被染成粉红色。用100 ml蒸馏水溶解1 g Tris,滴管缓慢滴加HCl到溶液中,观察溶液酸碱度,当pH=8.3时,向溶液中加入0.1 g茜红素粉末,配置为pH=8.3的0.1%茜素红-Tris-HCl工作液。同时,取转染后细胞,在100倍倒置显微镜下观察消化后细胞的形态变化,用血球计数板计数,24孔板加入爬片,细胞2万个/孔;贴壁加入PBS清洗2遍,95%乙醇固定。10 min后,双蒸馏水清洗3次,加入配置好的工作液,37℃恒温作用30 min。将茜素红染液用0.22μm滤纸过滤,加入染液覆盖住底孔,室温染色放置5 min,PBS漂洗3次,风干,甘油明胶封片,倒置显微镜观察钙结节染色情况,橘红色矿化结节为阳性结果。根据实验需要,在加入成骨诱导液7和14 d时进行染色;每组设3个重复,每样本随机取1个视野,比较各组间差异。
1.2.6 碱性磷酸酶活性测定 PNPP制备:5.4 ml Assay Buffer溶解2片PNPP,制成5 mmol工作液。ALP酶制备:1 ml Assay Buffer 加入ALP酶。取160μl Assay Buffer混入40μl PNPP制成1 mmol标准品。标准孔中每个梯度加入0、4、8、12、16和20μl Assay Buffer,吹打摇匀后孵育5 min,加入10μl ALP酶。清洗转染后细胞,加入50μl Assay Buffer,13 000 r/min离心3 min。取20μl样品,加入Assay Buffer至80μl,加入50μl/孔 PNPP反应液50μl,25℃避光作用60 min,加入20μl终止液混匀,于405 nm处测定吸光度值,制作标准曲线并计算ALP活性。
1.2.7 qRT-PCR 采用 qRT-PCR 检测 TGF-β1、SMAD3,以及成骨相关因子RUNX2、骨钙素。选取第3代细胞,于转染后24 h、2 d和7 d,检测各组细胞TGF-β1、SMAD3、RUNX2及骨钙素mRNA相对表达量。弃用培养基后,PBS清洗细胞3次,加入Trizol试剂,裂解细胞。反复吹打后,将裂解液转移至无RNA酶的离心管中,振荡离心10 min,取上清液。将上清液转移至另一离心管中(无RNA酶),加入氯仿,反复震荡,静置10 min,11 200 r/min离心,待样品分层后取上清,同时加入等体积异丙醇,混匀后低温过夜。次日取出,溶解后离心10 min,收集沉淀,用75%乙醇(DEPC溶解)清洗摇匀,弃上清,风干,取2μl总RNA溶解液稀释。引物长度18~22 bp,TGF-β1、SMAD3、RUNX2、骨钙素扩增片段长度分别为185、224、233和202 bp以GAPDH为内参,检测各目的基因的Ct值,采用公式2-△△CT计算各目的基因的相对表达量,操作重复3次,内参基因及目的基因引物序列见表1。

表1 qRT-PCR引物序列
1.2.8 免疫荧光 采用免疫荧光检测各组TGF-β1、RUNX2蛋白相对表达量。各组细胞成骨诱导后第14天,弃去培养基,用PBS清洗2、3次,4%多聚甲醛固定1 h,0.01 mol PBS浸洗3次,3 min/次。采用0.1% Triton X-100透膜作用15 min,0.01 mol PBS浸洗3次;1% BSA-PBS封闭,倾去,滴加稀释后的一抗(1∶100),放入湿盒中4℃避光过夜。次日拿出,弃一抗,0.01 mol PBS冲洗3次,滴加对应荧光标记二抗(1% BSA-PBS以1∶100比例稀释),37℃孵育30 min,弃二抗,PBS冲洗后用DAPI复染细胞核,染色约20 min,PBS冲洗3次,3 min/次。抗淬灭封片剂封片,荧光显微镜下观察并拍照记录。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较用方差分析,两两比较用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 TGF-β1是miRNA-486的直接靶基因
荧光素酶活性检测结果显示,miR-486 mimic、miR-486 mimic NC组、miR-486 mimic组及miR-486 mimic NC组比较,经方差分析,差异有统计学意义(F=6.052,P=0.000)。进一步两两比较经SNK-q检验,miR-486 mimic+TGF-β1-WT共转染组细胞的荧光素酶活性强度低于miR-486 mimic NC组(P<0.05)。进一步转染miR-486 Inhibitors+TGF-β1-WT、miR-486 Inhibitors NC+TGF-β1-WT、miR-486 Inhibitors+TGF-β1-Mut和 miR-486 Inhibitors NC+TGF-β1-Mut至293T细胞,经方差分析,差异有统计学意义(F=5.006,P=0.003);miR-486 Inhibitors +TGF-β1-WT共转染组细胞的荧光素酶活性强度高于miR-486 Inhibitors NC+TGF-β1-WT共 转 染 组(P<0.05)。 见 表 2和图1。
表2 双荧光素酶报告基因检测结果 (±s)
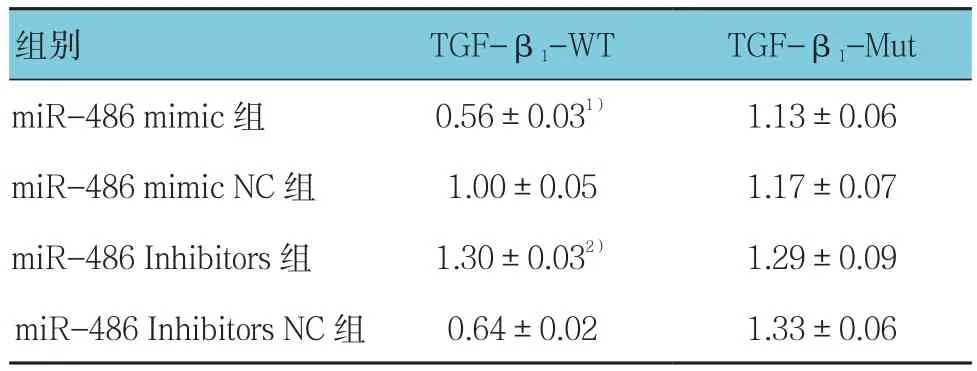
表2 双荧光素酶报告基因检测结果 (±s)
注:1)与miR-486 mimic NC组比较,P <0.05;2)与miR-486 Inhibitors NC组比较,P <0.05
组别 TGF-β1-WT TGF-β1-Mut miR-486 mimic组 0.56±0.031) 1.13±0.06 miR-486 mimic NC 组 1.00±0.05 1.17±0.07 miR-486 Inhibitors组 1.30±0.032) 1.29±0.09 miR-486 Inhibitors NC 组 0.64±0.02 1.33±0.06
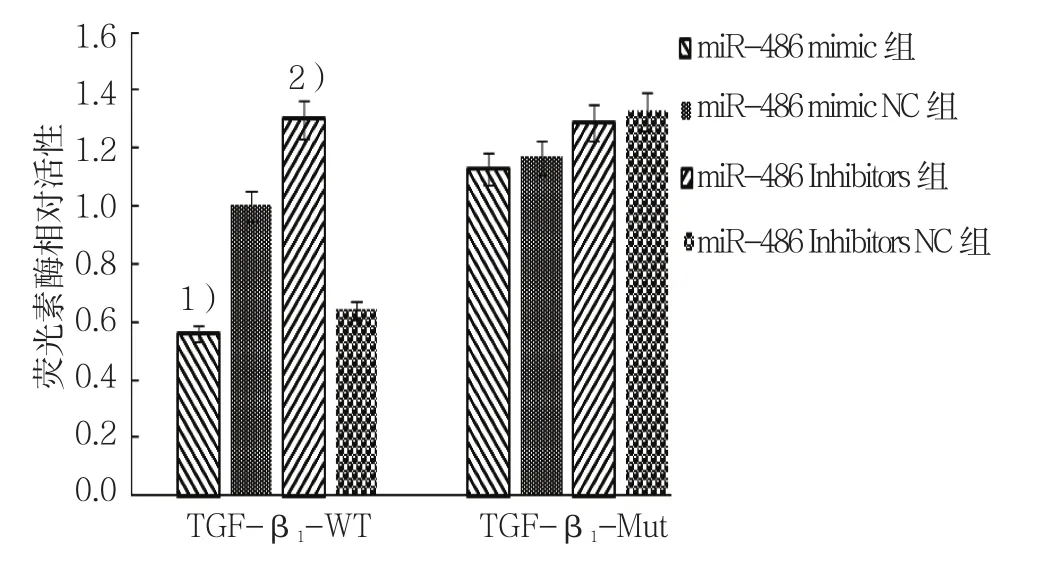
图1 双荧光素酶报告基因检测结果比较 (±s)
2.2 miRNA-486对内源性TGF-β1蛋白表达的影响
Western blot检测显示,miR-486 mimic组、miR-486 mimic NC组、miR-486 Inhibitors组、miR-486 Inhibitors NC组的TGF-β1蛋白相对表达量分别为(87.31±3.11)、(103.34±4.38)、(118.15±3.46)和(106.07±4.57),经方差分析,差异有统计学意义(F=4.148,P=0.028)。进一步两两比较经SNK-q检验,miR-486 mimic组TGF-β1蛋白表达水平降低(P<0.05);miR-486 Inhibitors组 TGF-β1蛋白水平较miR-486 Inhibitors NC 组升高(P<0.05)。见图 2。

图2 各组TGF-β1蛋白的表达水平比较 (±s)
2.3 各组钙盐沉积情况
茜素红染色结果显示,miR-486转染后,培养第14天时,miR-486 mimic NC组可见着色小点形成,少量橘红色沉淀;miR-486 mimic组可见大量橘红色钙盐沉积;miR-486 Inhibitors NC组橘红色沉淀较少;miR-486 Inhibitors组钙盐沉积减少。见图3。
2.4 各组ALP活性比较
miR-486 mimic组、miR-486 mimic NC组、miR-486 Inhibitors组、miR-486 Inhibitors NC组ALP活性分 别 为(6.23±0.31)、(3.96±0.22)、(2.07±0.14)和(4.15±0.27)mmol/(min·mg),经方差分析,差异有统计学意义(F=7.361,P=0.000)。进一步两两比较经SNK-q检验,miR-486 mimic组ALP活性高 于 miR-486 mimic NC组(P<0.05);与 miR-486 Inhibitors NC组比,miR-486 Inhibitors组ALP活性下 降(P<0.05);miR-486 Inhibitors NC 组 与 miR-486 mimic NC组ALP活性比较,差异无统计学意义(P>0.05);miR-486 mimic组ALP活性高于miR-486 Inhibitors组(P<0.05)。见图 4。

图3 各组miR-486转染后14 d钙盐沉积情况 (茜素红染色×100)
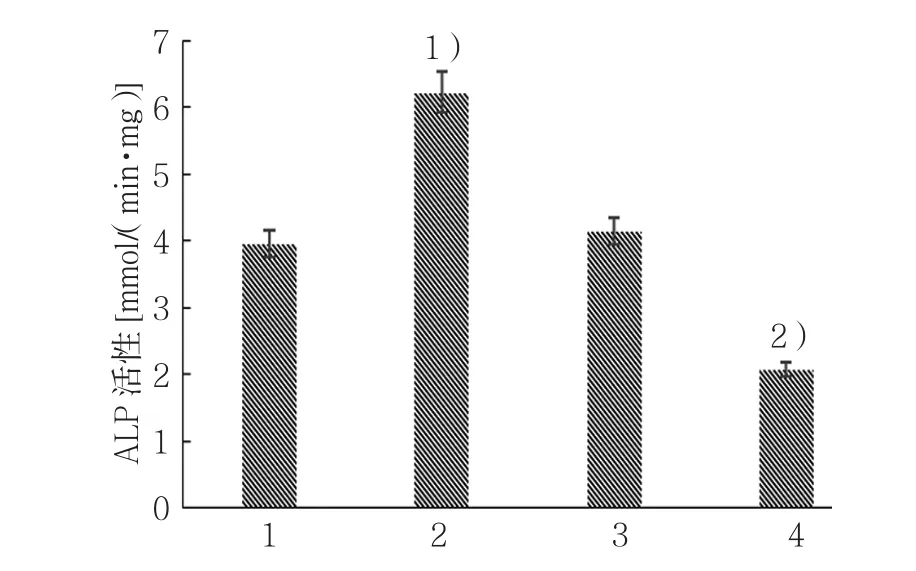
图4 各组成骨诱导14 d后ALP活性比较 (±s)
2.5 各组TGF-β1、SMAD3、RUNX2及骨钙素mRNA表达水平
miR-486 mimic组、miR-486 mimic NC组、miR-486 Inhibitors 组、miR-486 Inhibitors NC 组 TGF-β1、SMAD3、RUNX2及骨钙素mRNA水平比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经SNK-q检验,miR-486 mimic组TGF-β1和SMAD3 mRNA表达水平低于miR-486 mimic NC组(P<0.05),Runx2和 骨 钙 素 mRNA 高 于 miR-486 mimic NC 组(P<0.05);miR-486 Inhibitors组TGF-β1和SMAD3 mRNA表达水平高于miR-486 Inhibitors NC组(P<0.05),RUNX2和骨钙素mRNA低于miR-486 Inhibitorsost NC组(P<0.05);miR-486 mimic NC组与miR-486 Inhibitors NC组各mRNA表达水平比较,差异无统计学意义(P>0.05)。见表3和图5。
表3 各组TGF-β1、SMAD3、RUNX2及骨钙素mRNA表达水平比较 (±s)
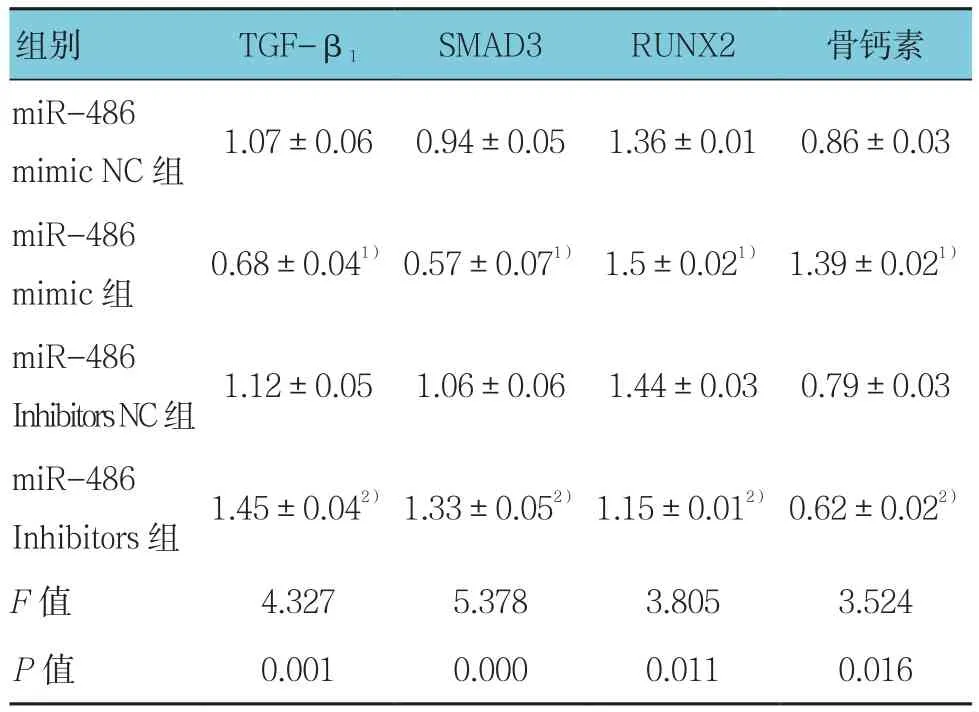
表3 各组TGF-β1、SMAD3、RUNX2及骨钙素mRNA表达水平比较 (±s)
注:1)与miR-486 mimic NC组比较,P <0.05;2)与miR-486 Inhibitors NC组比较,P <0.05
组别 TGF-β1 SMAD3 RUNX2 骨钙素miR-486 mimic NC 组 1.07±0.06 0.94±0.05 1.36±0.01 0.86±0.03 miR-486 mimic 组 0.68±0.041) 0.57±0.071) 1.5±0.021) 1.39±0.021)miR-486 Inhibitors NC组 1.12±0.05 1.06±0.06 1.44±0.03 0.79±0.03 miR-486 Inhibitors 组 1.45±0.042) 1.33±0.052) 1.15±0.012) 0.62±0.022)F值 4.327 5.378 3.805 3.524 P值 0.001 0.000 0.011 0.016
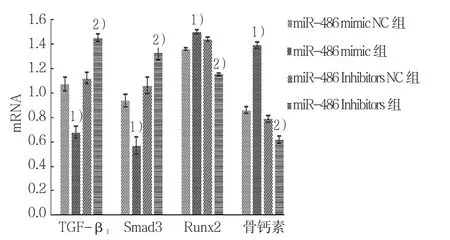
图5 各组TGF-β1、SMAD3、RUNX2及骨钙素mRNA表达水平比较 (±s)
2.6 各组TGF-β1、SMAD3、RUNX2的蛋白表达
培养14 d后经免疫荧光检测,对比miR-486 mimic组、miR-486 mimic NC组、miR-486 Inhibitors组、miR-486 Inhibitors NC组RUNX2蛋白表达水平,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经SNK-q检验,miR-486 mimic组Runx2蛋白表达水平高于miR-486 mimic NC组,荧光增强(P<0.05);miR-486 Inhibitors组较miR-486 Inhibitors NC组荧光强度降低,仅表达少量RUNX2蛋白(P<0.05)。各组TGF-β1和SMAD3蛋白表达水平比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经SNK-q检验,miR-486 mimic组TGF-β1、SMAD3蛋白表达水平低于miR-486 mimic NC组,荧光强度降低(P<0.05);而转染miR-486 Inhibitors后,miR-486 Inhibitors组 TGF-β1、SMAD3荧光强度增加,蛋白表达水平升高(P<0.05)。见表4和图 6、7。
表4 各组TGF-β1、SMAD3、RUNX2蛋白表达水平比较 (±s)
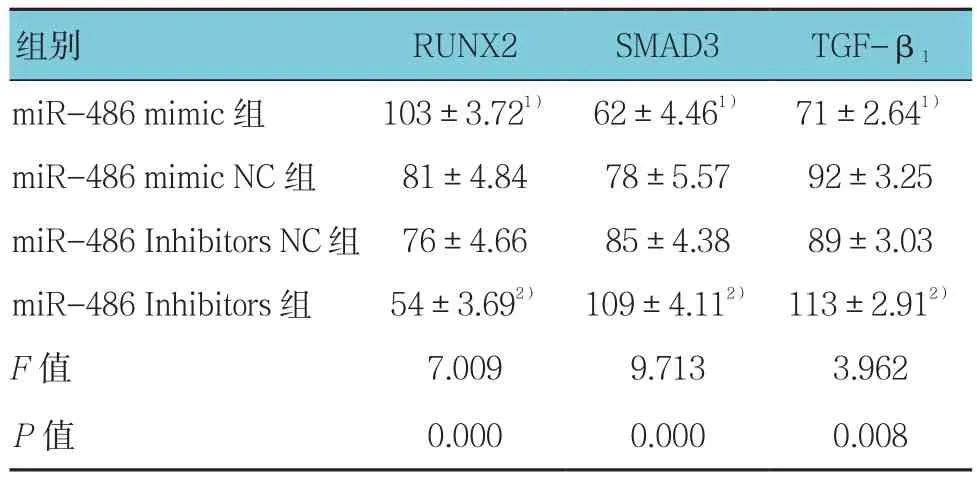
表4 各组TGF-β1、SMAD3、RUNX2蛋白表达水平比较 (±s)
注:1)与miR-486 mimic NC组比较,P <0.05;2)与miR-486 Inhibitors NC组比较,P <0.05
组别 RUNX2 SMAD3 TGF-β1 miR-486 mimic 组 103±3.721) 62±4.461) 71±2.641)miR-486 mimic NC 组 81±4.84 78±5.57 92±3.25 miR-486 Inhibitors NC组 76±4.66 85±4.38 89±3.03 miR-486 Inhibitors组 54±3.692) 109±4.112) 113±2.912)F值 7.009 9.713 3.962 P值 0.000 0.000 0.008
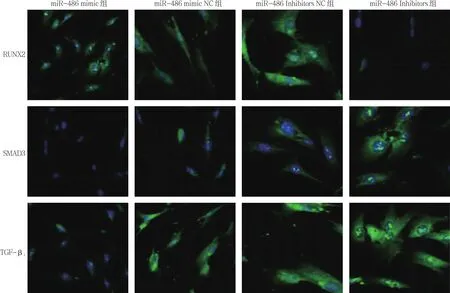
图6 各组TGF-β1、Smad3、Runx2蛋白免疫荧光强度

图7 各组TGF-β1、SMAD3、RUNX2蛋白表达水平比较 (±s)
3 讨论
CAVD发病率随年龄增长而升高,是一种常见的老年慢性疾病,病情呈缓慢进展趋势。到中晚期时,CAVD可显著增高心肌梗死发生率、心血管死亡率[6-7];尽管经导管主动脉瓣置换术治疗主动脉瓣狭窄已取得一定成效,但是在减缓CAVD发生、阻止病情进展上仍未达到预想效果。主动脉瓣钙化到主动脉瓣狭窄是一个相对漫长的过程,可研究的作用因子较多,病情延缓可依靠持续的药物作用,因而药物的早期干预已成为当前临床治疗CAVD的目标之一[8],而寻找与CAVD相关的靶基因则是研究新型有效药物的方向之一。目前,已有研究在钙化性主动脉瓣狭窄动物实验中发现某些microRNA变化与异位骨化、炎症细胞激活等现象相关[9]。国外学者OHUKAINEN等[10]通过体外培养的人THP-1巨噬细胞,检测microRNA靶预测数据库与瓣膜microRNA表达谱结合度,证实micro125b、趋化因子CCL4的水平含量与CAVD关系密切。尽管证实多种microRNA具有调控发育、增殖、凋亡、代谢和免疫等多方面的生物学作用[11],但其参与调控CAVD的作用及可能机制仍属于国内较新的研究。
TGF-β在炎症、组织修复及胚胎发育等方面有不可或缺的调控作用,其主要类型分为TGF-β1、TGF-β2及TGF-β3,其中TGF-β1在细胞和组织中含量较为丰富,其调控的信号通路多为Smads通路,可结合受体TβRII使SMAD2和SMAD3磷酸化,进而调节靶基因的转录[12]。在本研究中,双荧光素酶报告基因系统结果显示,miR-486 mimic+TGF-β1-WT共转染组荧光素酶活性强度降低,而miR-486 Inhibitors+TGF-β1-WT共转染组细胞的荧光素酶活性强度升高,对照组间无差异,这提示TGF-β1可能是miR-486的直接靶基因。笔者采用Western blot检测miR-486 mimic、miR-486 Inhibitors转染后,钙化性VICs细胞中TGF-β1的表达差异,结果提示与各对照组相比,miR-486 mimic组TGF-β1较低,miR-486 Inhibitors组则相反。以上结果进一步证明TGF-β1可能是miR-486的靶基因,miR-486的某些作用与TGF-β1存在密切联系。学者MARTÍNEZ-MICAELO等[13]认为,miR-486与miR-718在主动脉瓣疾病的发生中扮演重要角色,其靶基因可能是TGF-β1、RUNX2,与本研究结论一致。
茜素红染色可显示成骨细胞培养中矿化结节的数量、大小及形态,实验中观察到的深红色带色化合物即为茜素红与钙结合而成的显色物质,常用于判断体外诱导细胞向成骨细胞分化程度的高低及成骨活性的大小[14]。在本实验中,对钙化培养14 d后的各组细胞进行茜素红染色,结果显示,miR-486 mimic组可见大量橘红色钙盐沉积;miR-486 Inhibitors组钙盐沉积减少,提示miR-486可能具有促使VICs细胞成骨分化的作用,可加速细胞钙化。碱性磷酸酶作为成骨细胞和骨组织的标志物,在主动脉钙化瓣膜及体外培养细胞成骨分化后,其表达增强,含量升高。在ALP实验中,可发现转染miR-486 mimic后细胞ALP活性增加,而miR-486 Inhibitors转染后却降低,此现象提示,miR-486能增强VICs细胞中ALP的活性,即能促进VICs细胞钙化。
RUNX2是骨发生过程中调节间充质干细胞成骨分化至成熟的重要转录因子之一,亦是成骨细胞特异转录因子,在大部分CAVD患者细胞中呈高表达状态,常作为骨代谢状态的一种检测指标[15]。SMAD3作为TGF-β1的下游因子,联合TGF-β1形成TGF-β1-SMAD3信号通路可介导多种生理反应,作用广泛。本研究采用qRT-PCR和免疫荧光检测各组成骨相关因子及可能信号通路中基因的表达含量。结果提示,TGF-β1、SMAD3 mRNA和蛋白水平在miR-486 mimic组降低,在miR-486 Inhibitors组中升高,对照组无差异;miR-486 mimic组RUNX2、骨钙素mRNA水平较高,miR-486 Inhibitors组降低,且RUNX2蛋白在miR-486 mimic组表达较高;上述现象均提示miR-486能下调TGF-β1的表达,可能通过TGF-β1-SMAD3信号转导,促进RUNX2、骨钙素的表达和活性,诱导间质细胞向成骨细胞分化,发生异位骨化。
本研究尚有不足,TGF-β1介导的信号通路较复杂,未能进行深入讨论;成骨分化相关因子较多,本研究纳入较局限。笔者将在以后的研究中,增加实验类型与难度,进一步探讨TGF-β1下游因子在CAVD进展中的作用,纳入更多成骨分化相关因子,以证实该结论。
综上所述,本研究通过转染miR-486模拟物及抑制物,参照各对照组,分析其对VICs细胞成骨分化的影响及可能的作用机制,证实miR-486的靶基因可能为TGF-β1,其可促进VICs细胞成骨分化。

