CpG 684-乙肝疫苗食蟹猴重复免疫安全性评价
刘 丽,姜 华,潘东升,张 琳,张 頔,谢 寅,齐卫红,张 翊,邵 彦,王丽颖,于永利,李 波
(1.中国食品药品检定研究院国家药物安全评价监测中心,药物非临床安全评价研究北京市重点实验室,北京 100176;2.云南沃森生物技术有限公司,云南昆明 650106;3.长春华普生物技术有限公司,吉林长春 130012;4.吉林大学白求恩医学院基础医学院,吉林长春 130021)
乙型病毒性肝炎是严重危害人类健康的传染性疾病,由乙型肝炎病毒(hepatitis B virus,HBV)感染所致。据统计,目前全球有约20亿人感染HBV,我国HBV感染者近1亿人,其中慢性乙肝患者约2000万例,每年有2%~10%发展为肝硬化,部分可发展为肝癌,预后较差[1-2]。接种乙肝疫苗是预防乙肝的主要方法。传统的乙肝疫苗使用铝佐剂,以HBV表面抗原(HBV surface antigen,HBsAg)为免疫原。免疫功能正常人群中有5%~10%接种该疫苗后不能产生持久的血清保护性抗体[3]。另外,铝佐剂经常会引起注射部位的不良反应,并且通常诱导偏向于辅助性T细胞2(T helper cells 2,Th2)型的免疫应答,易引起过敏反应[4-5]。因此,需要对疫苗的佐剂系统进行改进,以诱导产生更持久、更高水平的免疫反应,并提高疫苗安全性,满足临床需求。
应用新型佐剂的疫苗研究成为热点,能诱导平衡的Th1/Th2型免疫应答的疫苗被认为具有更好的免疫原性和安全性[6-8]。含CpG基序的寡聚脱氧核苷酸(oligodeoxynucleotides containing CpG motifs,CpG ODN)具有较强的免疫刺激作用,可促进Th1型免疫反应,近年来被作为新型佐剂用于多种不同类型的疫苗中[9-12]。CpG 684是我国自行设计合成的一种B型CpG ODN,CpG 684-乙肝疫苗是我国制药企业以CpG 684联合铝佐剂乙肝疫苗制备的一种新型疫苗。为考察CpG 684-乙肝疫苗的非临床安全性,本研究对食蟹猴重复im给予该疫苗,观察其产生的不良反应及其严重程度、主要毒性靶器官及损害的可逆程度,为临床设计人用剂量、临床不良反应的监测提供参考依据。
1 材料与方法
1.1 受试物和对照品
CpG 684-乙肝疫苗,批号20080702,为淡乳白色混悬液,装在预填充注射器内,每支0.5 mL。由重组(汉逊酵母)乙肝疫苗〔含AL(OH)3佐剂〕加CpG 684制备而成。由长春华普生物技术有限公司研发,特定序列为5′-TCGACGTTCGTCGTTCGTC⁃GTTC-3′,专利号为03140821.4,其冻干粉批号:080701,内毒素含量<100 EU·g-1(云南沃森生物技术有限公司),50 μg CpG 684-乙肝疫苗组(CpG 50 μg 组):每 0.5 mL 含 50 μg CpG 684+10 μg HBsAg,500 μg CpG 684-乙肝疫苗组(CpG 500 μg组):每0.5 mL 含500 μg CpG 684+10 μg HBsAg。2种浓度疫苗(0.5 mL)中均含0.25 mg AL(OH)3。本研究所用疫苗与临床拟用制剂制备方法和所含成分完全相同,CpG 500 μg组与临床规格完全一致,CpG 50 μg组仅CpG 684的添加量低于临床拟用制剂。稳定性试验表明,本研究所用受试物2~8℃条件下可存放2年。所用CpG 684溶媒对照品为0.9%氯化钠注射液。受试物和溶媒对照品均由云南沃森生物技术有限公司提供,2~8℃条件下避光保存。
1.2 实验动物和饲养条件
食蟹猴30只,购入时2~3岁,雌雄各半,繁育单位为海南金港实验动物科技有限公司,许可证号:SCXK(琼)2004-0001。免疫开始时体质量范围:雌性,1.95~2.65 kg;雄性:2.10~3.30 kg。不锈钢笼具饲养,每笼1只。饲养室温度16~26℃,日温差≤3℃,相对湿度40%~70%,换气次数为每小时8~10次,照明每天12 h。定量给予膨化猴料和水果(比例为1∶1,北京科澳协力饲料有限责任公司),每日总给料量约300 g,由饮水瓶自由饮用自来水。食蟹猴购入后检疫,适应环境4周后用于试验。本研究在开始前已通过本单位动物福利伦理委员会的伦理审批。
1.3 试剂和仪器
血液学测定试剂(北京佳康瑞得医用电子仪器有限公司);血清生化测定试剂(北京周天华枫医疗仪器有限公司);乙肝抗体检测用辣根过氧化物酶(horse radish peroxidase,HRP)标记兔抗猴IgG抗体(北京博奥森生物技术有限公司);包被用HBsAg(云南沃森生物技术有限公司);抗核抗体ELISA检测试剂盒(欧蒙医学实验诊断有限公司);检测白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)流式细胞微珠法(cyto⁃metricbeadarray,CBA)(美国BDPharmingen公司)。
ADVIA 120血液分析仪和Rapidchem 744电解质分析仪(德国拜耳公司);CA-1500血凝分析仪(日本Sysmex公司);HITACHI 7060型全自动生化分析仪(日本日立公司);显微镜(日本Olympus公司);Tissue-Tek TEC包埋机、Tissue-Tek VIP6-E2脱水机、Tissue-Tek DRS染色机和Tissue-Tek Glas封片机(日本SAKURA公司);MICROX SPINNER血细胞离心涂片机(日本OMRON公司);Shandon Cytospin4骨髓细胞离心涂片机(美国Thermo公司)。
1.4 分组设计和免疫次数
30只食蟹猴随机分为3组:溶媒对照组、CpG 50 μg疫苗组和CpG 500 μg疫苗组。每组10只,雌雄各半。在第0,2,4和6周im免疫各1次,共4次,每次0.5 mL。设计依据:CpG 684-乙肝疫苗临床拟用于≥18岁人群乙肝补充免疫,采用0,1和6个月3针免疫。临床拟用疫苗中每针含500 μg CpG 684和10 μg HBsAg抗原(按成人体质量60 kg计,分别为8.3 μg·kg-1和0.17 μg·kg-1)。在食蟹猴重复给药毒性研究中设定2个剂量组,分别为每针50 μg CpG 684+10 μg HBsAg和500 μg CpG 684+10 μg HBsAg。按本试验食蟹猴平均体质量2.5 kg计,经体质量折算,2组CpG 684的剂量分别为20和200 μg·kg-1,分别为成人拟用剂量的 2.4 倍和24倍。临床试验中拟固定乙肝疫苗HBsAg的剂量,因此,食蟹猴毒性试验中亦固定乙肝疫苗HBsAg的剂量不变,均为每针10 μg,即4 μg·kg-1,为成人拟用剂量的24倍,免疫次数比临床拟定免疫次数多1次。
1.5 症状观察和体质量等指标的测定
试验期间每天观察食蟹猴的症状和下肢股四头肌注射部位刺激性,每周1次测定体质量,每天测定摄食量,首次免疫后1 d、末次免疫后1 d和4周测定体温和心电图。
1.6 血液学和血清生化指标的测定
检疫期第15天和第24天、首次免疫后3 d、末次免疫后1 d和4周分别进行血液学和血清生化测定。文中仅显示部分测定结果。
1.7 食蟹猴血清HBsAb测定
免疫前,首次免疫后2,4,6,8和10周采血,分离血清,将血清置-80℃冰箱内保存,试验结束后ELISA法统一进行HBsAb测定。用HBsAg 10mg·L-1包被96孔板,每孔100 μL,4°C包被15 h。洗涤后每孔加300 μL 1%BSA封闭液,37°C孵育2 h,之后每孔加100 μL 25倍稀释的血清样品,37°C孵育1 h。洗涤后每孔加100 μL HRP标记兔抗猴IgG抗体(1000倍稀释),37℃孵育1 h。洗涤后加邻苯二胺底物液,37℃避光显色15 min后终止显色。用酶标仪读取492 nm波长下的吸光度值(A492nm)。各实验组血清样本A492nm值大于溶媒对照组A492nm值2.1倍,判定为阳性。
1.8 ELISA法检测血清细胞因子和抗核抗体水平
检疫期、首次免疫后1周、第3次免疫后1周和末次免疫后4周,CBA法测定血清中IL-6和TNF-α水平;第3次免疫后1 d、末次免疫后1 d和4周ELISA试剂盒测定抗核抗体水平。
1.9 病理学检查
末次免疫后3 d和4周分别对部分食蟹猴麻醉后进行解剖和大体病理学检查(末次免疫后3 d解剖动物数为每组雌雄各3只,末次免疫后4周解剖动物数为每组雌雄各2只),对主要组织器官和病变部位进行组织病理学检查。固定后的组织经修块取材,逐级乙醇脱水,石蜡包埋,滑动切片机切片(厚约3 μm),经苏木精-伊红(hematoxylin-eosin,HE)染色,光镜下检查。
1.10 统计学分析
实验结果数据均采用x±s表示,使用的统计软件是TOXSTAT2006。①首先用Bartlett检验方法进行数据均一性检验。如数据均一,则进行方差分析检验(F检验);如Bartlett检验的结果显著(P<0.05),则进行Kruskal-Wallis检验。②如方差分析检验结果显著(P<0.05),则进一步用Dunett参数检验法进行多重比较检验;如方差分析结果不显著,则统计结束。③如Kruskal-Wallis检验结果显著(P<0.05),则进一步用Dunett非参数检验法进行多重比较检验;如Kruskal-Wallis检验结果不显著,则统计结束。应用Fisher精确检验(Fisher′s exact test)进行病理学检查计数数据组间统计。
2 结果
2.1 CpG 684-乙肝疫苗对食蟹猴体质量等指标的影响
试验期间,给予CpG 684-乙肝疫苗的食蟹猴均未见异常症状,疫苗未引起过敏反应,注射部位肉眼观察均未见异常。与溶媒对照组相比,各实验组体质量变化、摄食量、体温和心电图指标变化无统计学差异(数据略)。
2.2 CpG 684-乙肝疫苗对食蟹猴血液学和血清生化指标的影响
血液学检测结果(表1)显示,首次免疫后3 d,与溶媒对照组相比,CpG 500 μg组雌性食蟹猴单核细胞百分比显著增加,为溶媒对照组的2倍(P<0.01);免疫结束时,CpG 500 μg 组雌性食蟹猴单核细胞百分比仍高于溶媒对照组(P<0.05);末次免疫后4周2组无明显差异。以上结果说明,CpG 500 μg组CpG 684-乙肝疫苗引起雌性食蟹猴外周血单核细胞增加。血清生化检查结果(表2)显示,第1次免疫后3 d,雌性CpG 50 μg组甘油三酯水平显著低于溶媒对照组(P<0.05)。
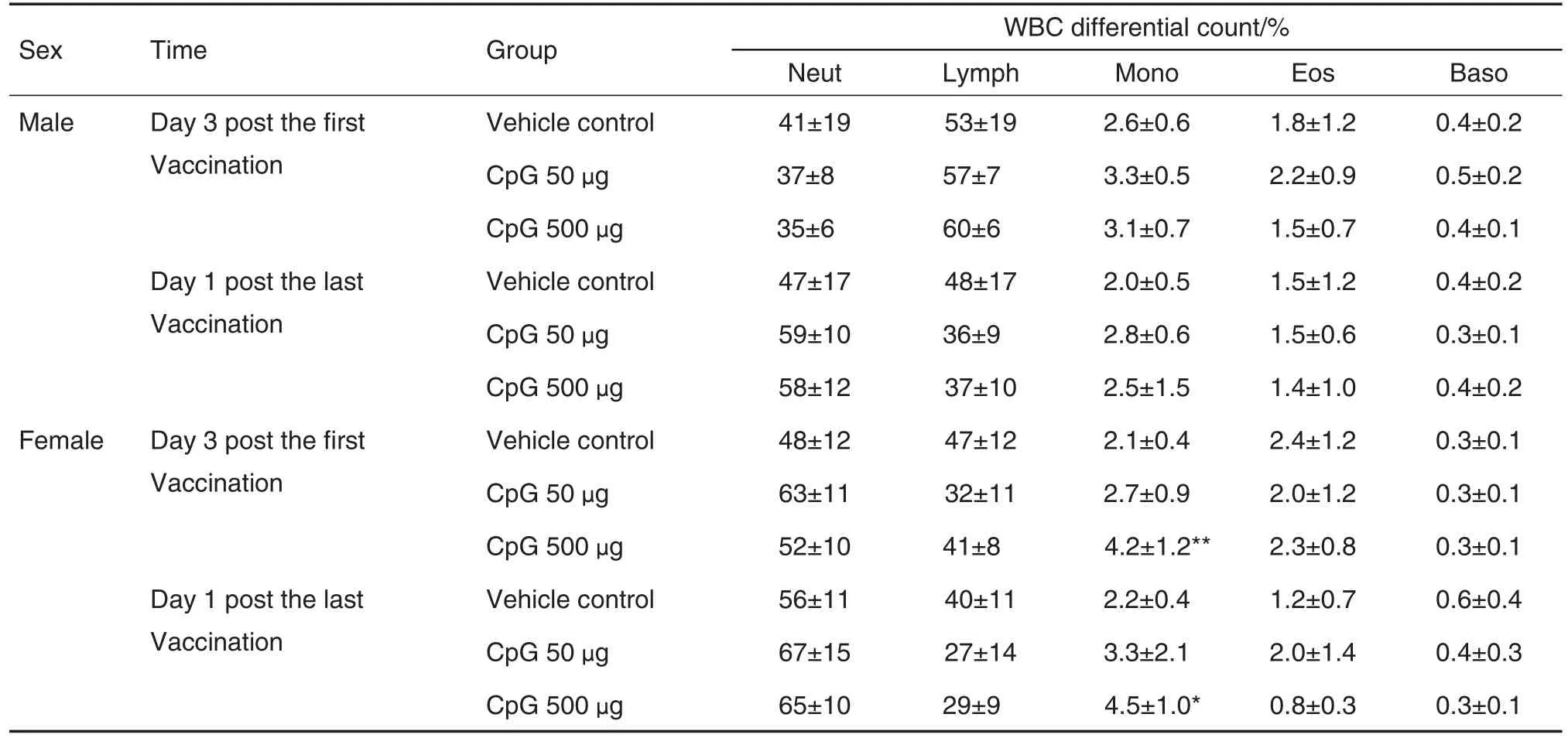
Tab.1 White blood cell differential count data of cynomolgus macaques immunized with CpG 684-HBV vaccine

Tab.2 Serum chemistry data of cynomolgus macaques immunized with CpG 684-HBV vaccine
2.3 CpG 684-乙肝疫苗的食蟹猴免疫效果
HBsAb检测结果显示(图1),免疫前各组食蟹猴血清中的HBsAb为阴性,免疫后2周,疫苗免疫组只有1只食蟹猴血清HBsAb呈阴性,其它血清HBsAb均呈阳性。免疫后4周起,疫苗免疫组所有食蟹猴血清HBsAb呈阳性。雌雄食蟹猴HBsAb水平无明显差异。随免疫时间延长,HBsAb水平出现上升趋势,在首次免疫后6~8周达到高峰,到10周时抗体水平有所下降。CpG 500 μg组雄性猴血清中的HBsAb水平在第6,8和10周时均高于CpG 50 μg组(P<0.05),CpG 50 μg组雌性猴HBsAb水平在免疫后第6周高于CpG 500 μg组(P<0.05)。

Fig.1 Serum HBsAb levels in male(A)and female(B)cynomolgus macaques immunized with CpG 684-HBV vaccine.See Tab.1 for the treatment.,n=5.*P<0.05,compared with CpG 50 μg vaccine group.
2.4 CpG 684-乙肝疫苗免疫后血清IL-6、TNF- α和抗核抗体水平的变化
细胞因子检测结果(表3)显示,在首次免疫后1周,雄性CpG 500 μg组IL-6水平高于溶媒对照组(P<0.05),雌性CpG 50和500 μg组TNF-α水平低于溶媒对照组(P<0.05);第3次免疫后1周,雄性CpG 500 μg组TNF-α水平低于溶媒对照组(P<0.05),但变化的幅度均很小,说明在所测时间点,给予CpG 684-乙肝疫苗对食蟹猴血清中IL-6和TNF-α水平无显著影响。
抗核抗体测定结果显示,第3次免疫后1 d、末次免疫后1 d和4周各组食蟹猴血清抗核抗体均为阴性(数据略)。
2.5 CpG 684-乙肝疫苗免疫后食蟹猴组织病理变化
食蟹猴大体病理学检查未见与疫苗相关的异常变化。CpG 50和500 μg组仅各有1只食蟹猴可见注射部位肌肉轻度肌纤维变性,其余食蟹猴均未见肌纤维变性、坏死,表明im给予CpG 50和500 μg疫苗对肌纤维无明显刺激性作用。CpG 50和500 μg疫苗均可诱导注射部位肌束间轻至中度炎症细胞浸润,对照组只有1只食蟹猴有肌束间轻度炎症细胞浸润灶,恢复期结束时疫苗组局部炎症反应无明显消退。免疫结束及恢复期结束,除CpG 50 μg组1只食蟹猴可见肌束间中度纤维组织增生外,其他各组均未见肌束间明显纤维组织增生,受试物致纤维化作用较轻。免疫结束后4周,其局部炎症反应有恢复,但未能完全消退。CpG 684-乙肝疫苗对注射局部淋巴结、胸腺及脾未引起显著应激性病理反应。其余镜检器官或组织未见特异性组织病理学改变(数据略)。

Tab.3 Serum IL-6 and TNF- α level of cynomolgus macaques immunized with CpG 684-HBV vaccine
3 讨论
CpG ODN的免疫调节作用被认为是通过直接或间接激活表达Toll样受体9(Toll-like receptor-9,TLR9)的细胞来实现的,这些细胞包括浆细胞样树突状细胞(plasmacytoid dendritic cells,PDC)、巨噬细胞、B细胞和单核细胞等[13-14]。TLR9激活后的B细胞和PDC表达协同刺激分子CD86,CD80和CD40增加,促进Th1型免疫反应的趋化因子和细胞因子的分泌增加,可诱导机体固有免疫和获得性免疫反应偏向于Th1型的细胞和体液免疫反应[15],机体的Th1样免疫环境对于细胞内病毒感染的预防和治疗非常重要[16]。由于CpG ODN的强免疫刺激作用,对其安全性也存在着一些担忧。有相关研究报道,CpG ODN可引起一些副作用,如合成的CpG ODN可诱导小鼠胃炎的发生[17];对HLA-B*57:01转基因小鼠同时给予CpG ODN和阿巴卡韦(一种人免疫缺陷病毒逆转录酶抑制剂),可引起谷丙转氨酶活性升高和肝损伤病变[18]。有研究显示,对小鼠和大鼠皮下或腹腔内注射给予一定剂量的CpG ODN会引起发育毒性[19-20]。因此,对以CpG ODN为佐剂的疫苗进行系统的安全性评价非常重要。
不同的动物种属表达TLR9的细胞种类有所区别,TLR9在啮齿类动物免疫细胞的表达要比哺乳类的广泛[21]。因此,使用非人灵长类动物进行非临床安全性评价比使用啮齿类动物对临床的预测价值更大。CpG 684是我国自行设计合成的一种全硫代修饰B型CpG ODN。前期实验结果表明,本疫苗中的佐剂CpG 684可使食蟹猴外周血单个核细胞表达协同刺激分子CD86和CD80明显增加。食蟹猴是CpG 684的敏感动物,而恒河猴的敏感性则相对较低。因此,选择食蟹猴作为实验动物进行CpG 684-乙肝疫苗安全性评价更有意义。
疫苗对实验动物有免疫原性是进行安全性评价的前提。HBsAb检测显示,CpG 50和500 μg组CpG 684-乙肝疫苗在食蟹猴均诱导了较好的免疫应答,抗体水平呈一定的剂量-效应关系。多数食蟹猴在首次免疫后2周即产生了一定水平的抗体,抗体产生较早。其他疫苗研究中也发现,CpG 684可促进产生更早和更高水平的抗体[22],这与CpG ODN增强细胞免疫的作用有关,是其作为疫苗佐剂应用的重要优势。本研究中,各剂量疫苗在首次免疫和末次免疫后引起雌性食蟹猴外周血单核细胞数量增加,为可逆性改变。在大鼠肌注CpG 684共28 d毒性研究和小鼠重复肌注CpG 684-狂犬疫苗毒性研究中,也发现免疫组单核细胞数量增加[23-24],与本研究结果一致。单核细胞有趋化作用和吞噬作用,可识别并加工处理抗原,并把抗原呈递给淋巴细胞,引起免疫反应。单核细胞表达TLR-9,CpG 684可促进单核细胞活化和增殖[23]。因此,本研究中单核细胞数量增加与反复注射含CpG 684的乙肝疫苗引起免疫反应增强有关,是疫苗药理效应的体现,也非毒性作用,符合研究预期。第1次免疫后3 d,雌性CpG 50 μg组甘油三酯水平虽然显著低于溶媒对照组(P<0.05),但与自身检疫期甘油三酯测定结果相比无明显变化,因此该差异为动物间的个体差异,与给予疫苗无关。
首次免疫后1周、第3次免疫后1周、末次免疫后4周分别检测猴血清中细胞因子IL-6和TNF-α水平,未见与给予疫苗相关的变化。本研究是应用CBA法直接测定食蟹猴血清中的细胞因子,猴血清中细胞因子的基础水平较低。此外,细胞因子在体液或组织中的变化可能是短暂的过程,受食蟹猴实验采血频率和采血量的限制,其出现显著变化的时间点较难捕捉,这也可能是疫苗免疫后未能检测到前述Th1型细胞因子升高的原因之一。从疫苗安全性方面考虑,说明在检测的几个重要时间点,细胞因子未明显升高,也未引起过度炎症反应。血清抗核抗体阴性结果提示,疫苗未引起自身免疫反应。
本研究发现,CpG 684-乙肝疫苗对食蟹猴多次肌注,仅诱导了轻至中度的肌束间炎症反应,炎症细胞浸润病变程度与疫苗剂量无明显关系,表明疫苗肌注后沿局部肌束间浸渍,诱导局部肌束间炎症细胞浸润。疫苗未引起明显纤维组织增生,也未引起注射部位肌肉的严重变性和坏死等不良反应,肉眼观察注射部位未见明显异常。这说明局部刺激性较小,是应用ODN作为疫苗佐剂的优势之一,符合研究预期。此外,本疫苗在诱导较好免疫反应的同时,未引起过敏反应和其他明显的毒性作用,具有较好的开发前景。本研究主要是在食蟹猴进行CpG 684-乙肝疫苗的安全性评价,伴随开展的免疫原性研究中未进行进一步抗体滴度检测,可在今后的研究中补充。另外,只在免疫后3个时间点进行了猴血清中2种细胞因子的检测,在今后的研究中可增加检测时间点,并对更多种细胞因子进行检测,以更全面地评价疫苗对细胞免疫的影响。
综上所述,在本研究条件和应用剂量下,CpG 684-乙肝疫苗除引起食蟹猴外周血单核细胞数量增加、注射部位肌肉轻度炎症反应外,未引起其他明显的毒性作用,本疫苗对食蟹猴具有较好的免疫原性和安全性。本研究为评价新型CpG 684-乙肝疫苗的非临床安全性提供了实验数据,为临床设计人用剂量和临床不良反应的监测提供了参考依据。

