紫草素体外对细胞色素P4501A2和羧酸酯酶2介导氟他胺代谢的抑制作用
李佳男,赵欣慰,郭 斌,吴敬敬
(1.锦州医科大学药学院,辽宁锦州 021001;2.中国科学院大连化学物理研究所,辽宁大连 116023;3.大连医科大学药学院,辽宁大连 116044)
氟他胺(flutamide,Flu)是一种非甾体雄激素拮抗剂,因其在前列腺癌治疗方面效果显著而在临床广泛应用,成为晚期前列腺癌的首选治疗药物[1],但严重的不良反应也是用药过程中不容忽视的问题[2]。研究发现,羟基化和水解过程是Flu在人体内生物转化的2条重要代谢通路。其中,经由细胞色素P450 1A2(cytochrome P450 1A2,CYP1A2)酶催化生成的2-羟基氟他胺是发挥抗癌作用的重要活性产物;而另一条通路可由羧基酯酶2(carboxy⁃lesterase 2,CES2)水解生成〔4-硝基-3-(三氟甲基)苯胺,Flu-1〕,后者会进一步被CYP3A4和CYP2C9代谢生成2种代谢产物:2-氨基-5-硝基-4-(三氟甲基)苯酚(Flu-3)和Flu-1的N-羟基代谢物(Flu-1 N-OH)。其中,大部分Flu-3经尿液排出体外,而Flu-1 N-OH则可作为一种代谢活性中间体,与体内的谷胱甘肽等大分子蛋白结合引发氧化损伤,这也是Flu导致肝毒性的主要因素[3-5]。药动学研究发现,服用Flu 2~4 h后,由CES2所催化生成的Flu-1的血浆浓度可达到220 μg·L-1。除迟发性腹泻等不良反应外,由Flu所引发的肝毒性发生率可达到0.36%~9%,且死亡率较高[6-7]。虽然市面上有多种缓解或减轻肝毒性的药物,但实际效果并不显著[8-9]。CES2[10]和CYP1A2[11]皆为体内重要的Ⅰ相代谢酶,参与多种内源性及外源性化合物的代谢,其中CES2主要代谢具有较大醇基和较小酰基的化合物[12-13],CYP1A2则参与绝大部分药物的氧化与还原代谢[14-15]。由此可推测,通过抑制CES2的活性从而阻断Flu的水解过程,不仅可以提高Flu的药效,还能显著降低肝毒性风险。
随着对中药研究的不断深入,在中药提取物中发现越来越多的代谢酶抑制剂,如丹参新酮和洋甘菊挥发油成分对CYP1A2活性均具有极强的抑制作用(IC50<10 μmol·L-1)[11,14];甘草提取物中的甘草次酸及其多种类似物可明显抑制CES2的活性(IC50<10 μmol·L-1)[16]。最新的研究发现,紫草素(shikonin)10 μmol·L-1可抑制55% 的CES2活性,且这种抑制效果在活细胞中仍然存在[17]。但对Flu水解过程中的CES2活性影响仍待研究。
从紫草根部提取出来的天然萘醌型化合物紫草素,除具有镇痛、抗炎和抗氧化等多种药理学活性外,对骨肉瘤、慢性粒细胞白血病和乳腺癌等也表现出明显的抗肿瘤活性[18-20]。此外,以紫草素为主要成分的药物制剂在亚洲及欧洲的大部分国家中已被广泛应用。在将紫草素与拓扑异构酶Ⅰ抑制剂拓扑替康联用时发现,细胞周期延长,细胞增殖减缓,二者表现出较好的协同抗癌效果[21-22]。因此推测,紫草素与Flu联用时不仅可以降低肝毒风险,同时发挥药效协同作用,达到减毒增效的目的。
本研究采用体外肝微粒体孵育体系模拟体内代谢环境,在确定Flu的水解反应动力学的基础上,深入考察紫草素分别对Flu代谢的2种关键酶CYP1A2和CES2的抑制作用,同时定量预测其体内抑制可能性,对临床联合用药策略具有指导意义。
1 材料与方法
1.1 药品、试剂和仪器
标准品:紫草素(批号wkq1600501)和Flu(批号L-Q400086),纯度均>98%(四川维克奇生物科技公司)。NADPH(批号264671,瑞士罗氏)。7-乙氧基试卤灵(批号130508,中国美仑生物)。人肝微粒体(human liver microsome,HLM)(美国 Biorecla⁃matiIVT);乙腈、甲醇和二甲亚砜(dimethyl sulfoxide,DMSO)均为高效液相级别(美国赛默飞世尔科技有限公司)。协同H1多功能混合酶标仪(美国伯腾公司),高效液相色谱仪(HPLC系统,日本岛津公司)。
根据文献[23],选定7-乙氧基试卤灵的发光检测Gain值为80,积分时间为1 s。此外,根据预实验确定7-乙氧基试卤灵的激发波长为530 nm,发射波长为590 nm。
利用高效液相色谱仪对Flu及其代谢物Flu-1进行检测,系统装配有1个DGU-20A真空脱气器,2个LC-30AD泵,1个SIL-30AC自动取样器,CTO-30A柱温箱和RF-20A荧光检测器,1个CTO-20AC圆柱温箱和1个SPD-M 20A二极管阵列探测器。1个岛津的XR-ODSⅡ分析柱(75 mm×2.0 mm,2.2 μm)和1个ODS保护柱(5.0 mm×2.0 mm,2.2 μm,日本岛津)。流动相的组成为乙腈(B)和水(A),分析梯度设置为:0~3.00 min,10%~60%B;3.00~6.00 min,60%B;6.00~10.00 min,60%~90%B;10.00~15.00 min,90%~10%B;15.00~18.00 min,10%~1%B。流速为0.3 mL·min-1,柱温保持在40℃,进样体积为10 μL,检测波长为230 nm。
1.2 氟他胺水解线性反应时间与线性微粒体浓度的测定
分别设定不同孵育时间(5,10,15,25,40和60 min)与不同浓度的HLM(0.1,0.2,0.4,0.5,0.6和0.8 g·L-1)进行体外孵育实验,200 μL孵育体系〔4 μL HLM+194 μL PBS(100 mmol·L-1)+2 μL Flu(10 μmol·L-1)〕,在37 ℃恒温振荡混匀仪中预孵育10 min,加入Flu启动水解反应,继续孵育相应时间后,向反应体系中加入等体积冰乙腈剧烈振荡终止反应,经20 000×g,4℃离心20 min去除蛋白质,取上清液于进样瓶中放入高效液相色谱仪中,检测其代谢产物的生成量。
1.3 氟他胺水解反应动力学的测定
按1.2测定的最优反应时间和HLM浓度,设定Flu浓度为10,25,40,50和60 μmol·L-1,重复1.2中的孵育步骤,将 4 μL HLM(0.4 g·L-1)与 194 μL PBS(100 mmol·L-1)在37℃恒温振荡混匀仪中预孵育10 min后,加入2 μL Flu启动水解反应,继续孵育40 min后终止反应,离心取上清液后,再利用高效液相色谱法检测产物生成情况。
1.4 紫草素对氟他胺水解反应的抑制动力学测定
依照上述孵育条件,首先,设置15组不同的紫草素浓度(0,0.2,0.5,0.7,1,3,5,7,10,20,30,50,60,80和100 μmol·L-1)进行半数抑制浓度(IC50)测定;其次,采用多组Flu浓度(5,15,30和45 μmol·L-1)和紫草素浓度(0,5,10,15和25 μmol·L-1)对抑制动力学常数(Ki)进行测定,其他实验步骤参考1.2。反应40 min后,加入等体积冰乙腈,充分混匀终止反应,然后4℃下20 000×g离心20 min,取上清液放入高效液相色谱仪中进行检测。分析方法参考文献[24-25]。用GraphPad Prism对数据进行分析。IC50与抑制强度成反比。通过使用竞争型抑制(式1)、非竞争型抑制(式2)或混合型抑制(式3)3种动力学模型进行非线性回归分析,计算Ki值。

式中,v是反应速度;S和I分别为底物和抑制剂浓度;Ki是描述抑制剂对酶的亲和力抑制常数;Km是1/2最大反应速度(Vmax)时的底物浓度。α值决定抑制剂改变酶对底物的亲和力程度。当α很大时(α>1)抑制剂与酶的结合阻碍底物的结合,混合型抑制与竞争型抑制相同。从数据拟合和酶抑制类型确定抑制类型。从R2值、测定参数标准差、95%置信区间对动力学和抑制类型进行最好的拟合与评估。
1.5 紫草素对CYP1A2活性抑制作用的测定
采用三点法进行初筛实验,设置3个浓度梯度的紫草素(1,10和100 μmol·L-1),查阅文献确定CYP1A2的荧光底物7-乙氧基试卤灵的浓度为6 μmol·L-1[26],将含有 4 μL HLM(0.4 g·L-1),174 μL PBS(100 mmol·L-1)及 2 μL7-乙 氧 基试卤 灵(6 μmol·L-1)的体系于恒温混匀仪中预孵育10 min,加入20 μL NADPH(100 mmol·L-1)启动反应,反应60 min后加入等体积的冰乙腈终止反应。4℃下20 000×g离心20 min,取上清液放入荧光酶标仪,检测其荧光强度(fluorescence intensity,FI)。预实验中的方法学验证HPLC分析氟他胺羟化产物的回收率>86%,准确率>94%,相对标准差<1.8%。不同浓度的紫草素对CYP1A2的抑制强度用残余活性表示,对照组以等体积溶剂〔2 μL甲醇(1%,V/V)〕替代,计算残余活性。残余活性(%)=药物组FI/对照组FI×100%。
1.6 紫草素对氟他胺水解反应抑制强度的预测
利用紫草素的最大血药浓度(Cmax)及Flu的肝提取率(Eh)来估计浓度时间曲线下面积(area under the concentration-time curve,AUC)的改变,计算紫草素所导致的Flu在体内暴露水平的变化Cmax/IC50,即AUC增幅(式4)。其中Flu的Eh通过式5进行预测。参考文献,紫草素在体内的Cmax为5.53~37.4 μmol·L-1[27-29]。参考文献中Flu 在体内经HLM中CES2代谢的Vmax值(Vmax=1.113 mol·min-1·mg-1蛋白)[3],Flu的Km通过 1.3实验测定(Km=15 μmol·L-1);Flu的fm(0.18)及fu(0.51)[6];fhep设定为1;Qh及MSP按1.29 L·min-1和61.88 g进行计算[6],对FLU的Eh预测。参考FDA提出的药物相互作用的判断标准[30],以此推测紫草素对Flu水解过程的抑制。
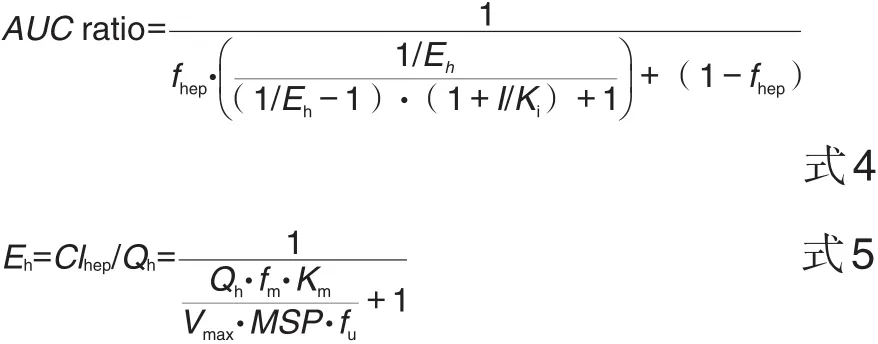
其中fhep是由CES2介导的肝清除百分比;I为血浆中抑制剂的浓度;fm代表由CES2介导的代谢清除占总代谢清除率的百分数或比例;fu为非结合部分;Km(μmol·L-1)为底物与酶的亲和力常数;Vmax(mol·min-1·mg-1蛋白)为最大反应速度;Qh(L·min-1)为人肝血流量;MSP(g)是HLM蛋白总量。
1.7 统计学分析
实验结果数据以表示,均采用GraphPad Prism进行双侧t检验分析,P<0.05认为差异有统计学意义。
2 结果
2.1 氟他胺最佳孵育时间和最佳微粒体浓度
如图1所示,拟合的线性反应时间中,0~40 min范围内Flu-1的生成量随时间增加呈线性增加,在40 min后增长速率减慢;而HLM浓度增加至0.8g·L-1几乎与产物生成量成正比,考虑到为避免蛋白结合因素干扰,体内外酶动力学反应中酶的浓度不宜超过0.5 g·L-1[31],选择HLM 0.4 g·L-1作为Flu的体外代谢酶浓度。因此,选定40 min为最佳孵育时间,0.4 g·L-1为最优HLM浓度进行Flu的水解动力学实验及紫草素对Flu水解抑制实验。

Fig.1 Linear reaction time(A)and linear human liver microsome(HLM)concentration(B)curves of flutamide.
2.2 氟他胺的水解反应动力学
Flu水解反应动力学如图2所示,代谢产物的转化量在Flu为0~20 μmol·L-1期间呈线性趋势增加,在 40 μmol·L-1时开始进入平台期,经 GraphPad Prism拟合得出Flu的Km约为15 μmol·L-1。
2.3 紫草素对氟他胺水解反应的抑制作用
以Flu为CES2底物,在不同浓度的紫草素作用下,CES2的残余活性如图3所示。经GraphPad Prism拟合其IC50为7.01 μmol·L-1,可知紫草素可通过对CES2活性的抑制,对Flu的水解反应产生强抑制作用。进一步选择不同的紫草素浓度及Flu浓度测定紫草素的Ki值为7.88 μmol·L-1(表1),并通过Lineweaver-Burk及Dixon作图对其抑制类型进行分析(图4),发现紫草素对Flu的水解作用呈现非竞争型抑制。

Fig.2 Metabolic kinetic curve of flutamide.

Fig.3 Concentration-response inhibition curve of shiko⁃nin towards hydrolysis reaction of flutamide.

Tab.1 Magnitude of potential inhibitory interaction of shikonin with CES2 was evaluated by estimating area under concentration-time curve(AUC)ratio in pres⁃ence or absence of shikonin.

Fig.4 Inhibitory kinetics of shikonin towards hydrolysis reaction of flutamide.A:Lineweaver-Burk plot for inhibition of shikonin towards hydrolysis reaction of flutamide;B:corre⁃sponding Dixon plot.
2.4 紫草素对CYP1A2活性的抑制作用
CYP1A2残余活性如图5所示。当紫草素浓度为100 μmol·L-1时,CYP1A2的残余活性>55%,可推测紫草素对CYP1A2并不存在显著性的抑制作用(IC50>100 μmol·L-1)。
2.5 紫草素对氟他胺水解反应抑制强度的定量预测
如表1所示,紫草素对CES2活性的抑制程度为:IC50为7.01 μmol·L-1,Ki为7.88 μmol·L-1。通过式5对Flu的Eh预测所得范围为0.1~0.91。查阅文献后计算紫草素在人体内的Cmax为5.53~37.4 μmol·L-1。经式4计算后可知,紫草素在体内可显著抑制Flu的水解过程,造成Flu在体内暴露水平呈6%~43%的增加幅度,进而减轻不良反应的发生。

Fig.5 Inhibitory effect of shikonin towards substrate(7-ethoxyresorufin)of CYP1A2.7-Ethoxyresorufin was incu⁃bated with HLMs at 37℃in absence and presence of shikonin(1,10 and 100 μmol·L-1),respectively.
3 讨论
本研究通过建立体外孵育体系模拟体内代谢环境,首先对Flu的水解反应动力学、线性反应时间及线性微粒体浓度进行摸索。以此为前提,考察紫草素对Flu代谢过程中2种关键酶CES2和CYP1A2的抑制作用。其中,紫草素在生理浓度(37.4 μmol·L-1)条件下,对CYP1A2几乎没有明显的抑制作用(抑制率<50%),即紫草素不会对Flu的羟基化进程产生明显阻碍作用;相比之下,紫草素对水解作用酶CES2则存在极强的抑制作用,IC50为7.01 μmol·L-1,并以非竞争型方式发挥抑制作用,抑制Flu水解反应,从而减少Flu-1的产生,达到减轻肝毒性的目的。在对紫草素的体内定量预测时发现,紫草素可造成体内Flu的暴露量增加6%~43%,具有抑制Flu水解从而减轻不良反应的作用。此外,文献报道,紫草素在体内仍具有极强的抑制CES2活性的作用[17],且在与其他抗肿瘤药物联用时,可使抗肿瘤效果明显增强[21]。由此可推测,在将紫草素作为抗肿瘤辅助用药与Flu联用时,发挥着减毒增效的作用,为将来开创新型临床用药策略提供极大的可能性。以此为依据,开发副作用较小的中药与抗癌药物联用的用药策略,可以在实现减毒增效的前提下优化临床安全用药方案。

