肉豆蔻挥发油对低氧诱导肺动脉平滑肌细胞增殖的抑制作用及其抗氧化活性
马 可,南星梅,苏姗姗,张得钧,李占强,,芦殿香,
(1.青海大学高原医学研究中心,青海西宁 810001;2.青海省高原医学应用基础研究重点实验室,青海西宁 810001;3.青海出入境检验检疫局,青海西宁 810006;4.青海大学生态环境工程学院,青海西宁 810016)
低氧性肺动脉高压(hypoxic pulmonary artery hypertension,HPAH)在临床是一种由低氧引起的危及生命的慢性进行性疾病,伴有肺压异常升高和右心衰竭等症状,其病因复杂,预后极差,属于肺动脉高压中重要的一类[1]。目前,HPAH的发病机制尚无明确定论,持续低氧会引起肺动脉平滑肌一系列的适应性变化,包括肺动脉平滑肌细胞(pulmo⁃nary artery smooth muscle cells,PASMC)增殖和肺动脉管腔狭窄等[1],其发病机制包括2个阶段:早期低氧性肺动脉收缩和后期低氧性肺血管重构[2]。国内外多项研究证实,低氧诱导PASMC的异常增殖是HPAH发病进程中的关键因素,同时PASMC也是引起肺血管收缩及肺血管重构过程的主要效应细胞[3]。目前,临床上现有的药物包括他汀类、一氧化氮类和内皮素类[4]等,作用虽较明显,但临床表现的副作用也十分严重[5-6]。
三味檀香散最早收载于藏医药经典著作《四部医典》,由檀香、肉豆蔻和广枣3味药材组成,具有清热的功效,用于胸闷不适和心烦心痛等症状。前期研究发现,该药能改善低氧诱导的大鼠肺动脉高压及肺小动脉血管的重构[7-8]。肉豆蔻(Myristica fragrans)作为三味檀香散中主要药材之一,其活性成分主要为挥发油和木脂素类化合物,具有抗菌、抗炎、抗氧化、抗癌、降血糖和保肝等作用[9],但这些成分在该药干预低氧性肺动脉高压过程中的作用和机制尚不明确。本研究分析肉豆蔻挥发油(volatile oil fromM.fragrans,VOMF)的化学成分,并对其体内外抗氧化及对低氧诱导的PASMC增殖的作用进行研究,为三味檀香散干预HPAH的药效物质及作用机制研究提供基础。
1 材料与方法
1.1 药材、试剂和主要仪器
药材于2017年8月购于青海中藏药材市场,由青海大学张得钧教授鉴定为肉豆蔻。1,1-二苯基-2-三硝基苯肼(DPPH,美国 Sigma公司),2,4,6-三吡啶基三嗪(TPTZ,东京化工业株式会社)、抗坏血酸(Vc)(天津市永大化学试剂有限公司),MTS(美国普罗麦格公司),乙醇、乙酸、浓盐酸、硫酸亚铁(Fe⁃SO4)和三氯化铁(FeCl3)(分析纯);Gibco胎牛血清(美国赛默飞公司),双抗(北京索莱宝有限公司),DMEM培养基(美国Hyclone公司),丙二醛(malo⁃ndialdehyde,MDA)、谷胱甘肽(glutathione,GSH)和超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(南京建成生物工程研究所)。
细胞培养瓶、细胞培养板(美国Corning公司),气相色谱-质谱联用仪(gas chromatographymass spectrometer,GC-MS)(美国赛默飞世尔,ISQ单四极杆气质),色谱柱DB-1701毛细管色谱柱(柱长30 m,内径0.25 mm,涂布厚度0.25 μm,Agilent Technologies),X-MarK全自动酶标仪分析系统(美国Bio-Rad),电热恒温水浴箱(北京市六一仪器厂),CO2培养箱和三气培养箱(瑞士TECAN公司),普通光学显微镜(德国Zeiss公司)。
1.2 SD大鼠PASMC的制备
Sprague-Dawley(SD)健康雄性大鼠,购于西安交通大学动物实验中心〔实验动物使用许可证号SCXK(陕)2012-003〕,体重150~220 g。给于普通大鼠饮料喂养,自由进食饮水,饲养环境温度22~24℃,相对湿度为45%~55%。健康SD大鼠,经2%戊巴比妥钠腹腔注射麻醉,置于75%乙醇中浸泡1 min。用无菌手术剪沿大鼠剑突向上剪开暴露胸腔后取出心脏和肺脏,找到肺动脉主干并快速分离血管,保留2~3级肺小动脉血管。之后将分离的肺小动脉血管剪开后轻轻刮去内膜,同法处理以除去外膜,将处理过的血管剪成约2 mm组织块后轻轻平铺于培养瓶中,加入3 mL含20%胎牛血清DMEM培养基中(组织块不飘起)。放回培养箱中培养,期间不做移动,贴壁4 d后,显微镜下观察组织块周围是否爬出细胞,待细胞密度约达70%时,用0.25%胰酶消化并传代。用含15%胎牛血清DMEM培养基培养大鼠原代PASMC并传代,培养箱条件为5%CO2,37℃,取3~8代细胞用于实验。
1.3 VOMF提取
取肉豆蔻种仁,粉粹,称取1000 g粉末,用水浸泡8 h,采用水蒸气蒸馏法提取至无油滴出,收集后用无水Na2SO4脱水,即得淡黄色VOMF 48.25 g,产油率为4.83%,备用。
1.4 VOMF气相色谱-质谱分析条件
程序升温(初始温度50℃,保持2 min,以2℃·min-1的速率升温至120℃,保持5 min,以2℃·min-1的速率升温至190℃,保持2 min,以20℃·min-1的速率升温至280℃,保持2 min;进样量1.0μL;不分流进样;载气(流量)为氦气(1.2mL·min-1);进样口温度250℃,离子传输管温度250℃。离子源温度280℃。质谱检测器为EI离子源,70 eV;扫描范围50~600m/z。
1.5 DPPH法检测VOMF自由基清除能力
准确量取0.3 mmol·L-1DPPH乙醇溶液180 μL于96微孔板内,再加入20 μL无水乙醇制备不同浓度(0.1,0.2,0.4,0.8,1.6,3.2和6.4 g·L-1)的VOMF溶液,以6.4 g·L-1的Vc作为阳性对照。用封板胶封板后,室温下避光,静置60 min,测定517 nm处吸光度值为Ai,以等体积无水乙醇代替样品溶液测得的吸光度为Ao,以等体积的无水乙醇代替DPPH溶液测得的吸光度为Aj,平行3组测定。自由基清除率(%)=〔1-(Ai-Aj)〕/Ao×100%。
1.6 铁离子还原/抗氧化能力(ferric ion reducing antioxidant power,FRAP)法检测VOMF的还原能力
精密称取TPTZ样品3.12 mg,配制10 mmol·L-1TPTZ盐酸溶液,置冰箱冷藏中备用。在300mmol·L-1醋酸盐缓冲溶液(pH=3.6)中,加入2.5 mL TPTZ备用溶液和2.5 mL 20 mmol·L-1FeCl3溶液,混匀得到TPTZ工作液。准确吸取TPTZ工作液100 μL于96微孔板内,再加入100 μL不同浓度(0.5~32 g·L-1)的VOMF溶液,以溶剂作空白对照,加样后混匀,置37℃水浴锅中反应10 min,593 nm处测定吸光度值(A593nm),同时测定 FeSO45,10,20,40,60,80和160 μmol·L-1标准溶液A593nm。
1.7 MTS法检测细胞增殖
将贴壁细胞用0.2%胰酶消化后离心收集,配制成5×107L-1单细胞悬液,接种于96孔板中,每孔培养24 h至贴壁后,换无血清培养基,12 h后将细胞分为2组:常氧组(5%CO2+95%O2条件下培养)和低氧组(3%O2+5%CO2+92%N2条件下培养),每组设置VOMF 1.0,1.5,2.0,2.5,3.0,3.5和4.0 g·L-1处理,37℃作用12 h后,每孔加入10 μL MTS试剂,反应3 h,490 nm波长下测定吸光度值(A490nm),并用空白孔调零。计算细胞增殖抑制率及IC50值。细胞增殖抑制率(%)=1-低氧组A490nm/常氧组A490nm×100%。
1.8 检测细胞SOD,GSH和MDA水平
将贴壁细胞用0.2%胰酶消化后离心收集,配制成5×107L-1单细胞悬液,接种于6孔板中,每孔培养24 h至贴壁后,换无血清培养基同步化处理,12 h后将细胞分为2组:正常对照组(5%CO2+95%O2条件下培养)和低氧组(3%O2+5%CO2+92%N2条件下培养),每孔分别加入3 mL不同浓度(0.8,1.6和3.2 g·L-1)的VOMF,作用12 h 后,以超声波提取法收集蛋白,按照SOD,GSH和MDA试剂盒说明书进行检测。
1.9 统计学分析
实验结果数据采用表示,采用SPSS13.0软件进行统计学分析。组间比较采用单因素方差分析,P<0.05认为差异具有统计学意义。
2 结果
2.1 VOMF化学成分
经GC-MS分析,并通过Xcalibur色谱工作站NIST谱库检索标准MS图库及有关MS图文献解析,从VOMF中共鉴定出75个化合物,鉴定化合物的百分比为99.95%,并利用峰面积归一化法确定各组分在VOMF中的相对含量(表1)。
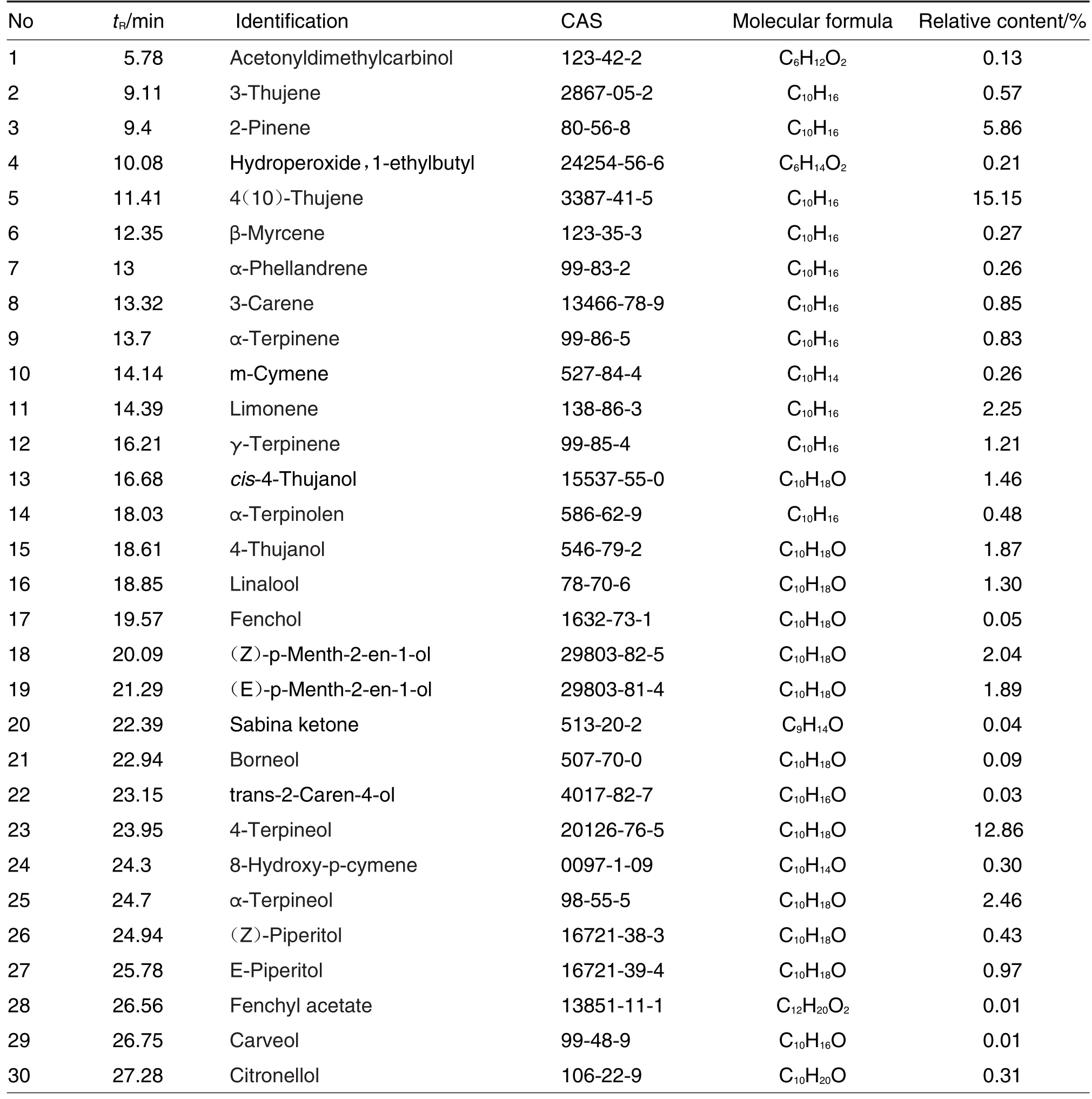
Tab.1 Chemical composition of volatile oil from M.fragrans(VOMF)
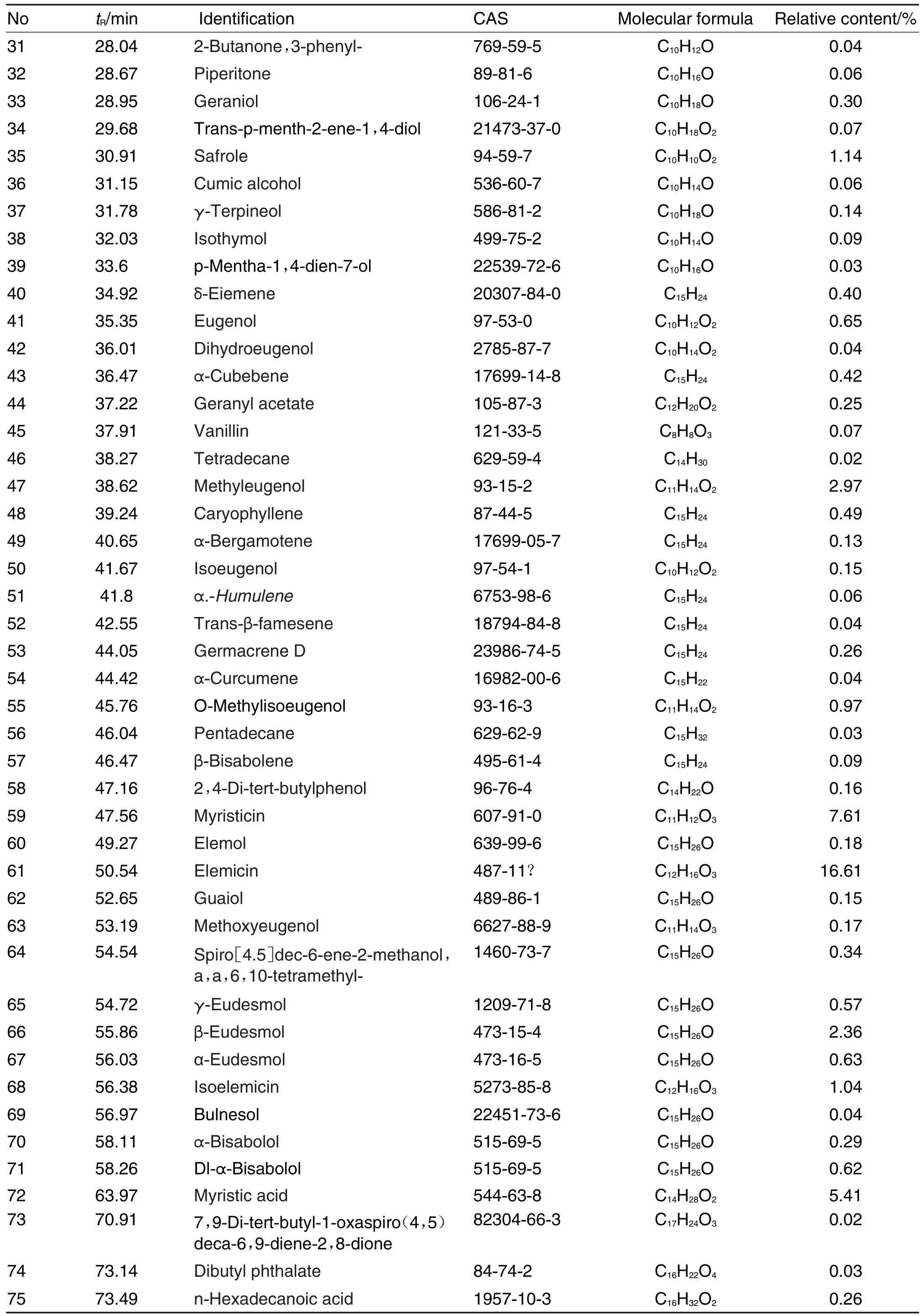
续表1
2.2 不同浓度VOMF清除DPPH自由基的能力
VOMF清除DPPH自由基结果(图1)表明,Vc(阳性对照组)浓度在6.4 g·L-1时,对自由基清除能力达到80%。VOMF在0.1~6.4 g·L-1范围内的清除率具有一定的量-效关系(P<0.05),但VOMF<3.2 g·L-1的自由基清除能力较Vc弱(P<0.05)。
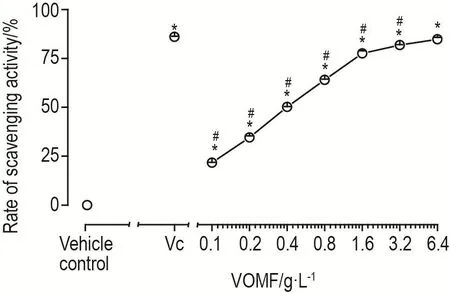
Fig.1 Scavenging activity of VOMF on 1,1-diphenyl-2-picrylhydrazyl(DPPH) free radical.Pulmonaryartery smooth muscle cells(PASMCs)in 96-well microplates were treated with DPPH 0.3 mmol·L-1,meanwhile,different concen⁃trations of VOMF(0.1-6.4 g·L-1),Vc 6.4 g·L-1(positive con⁃trol) or alcohol(vehicle control) were added according to groups.Absorbance was measured at 517 nm.,n=3.*P<0.05,compared with vehicle control group;#P<0.05,compared with Vc group.
2.3 VOMF对Fe3+还原能力的影响
以FeSO4浓度为横坐标,吸光度为纵坐标,得标准曲线方程为y=0.0059x-0.0088(R2=0.9977),在10~160 μmol·L-1浓 度 范 围 内 线 性 关 系 良 好。VOMF在实验浓度范围内对Fe3+具有一定的还原能力(P<0.05),但其还原能力较Vc 6.4 g·L-1弱(P<0.05)(图2)。
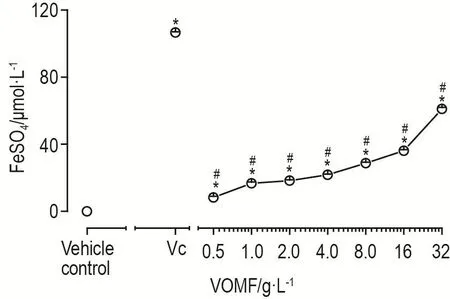
Fig.2 Reducing power of VOMF on Fe 33++.PASMCs in 96-well microplates were treated by tripyridyltriazine(TRTZ),mean⁃while,different concentrations of VOMF(0.5-32 g·L-1),Vc 6.4 g·L-1(positive control)or alcohol(vehicle control)were added according to groups.Absorbance was measured at 593 nm.Reducing power was calculated from standard curve of FeSO4.,n=3.*P<0.05,compared with vehicle control group;#P<0.05,compared with Vc group.
2.4 VOMF对PASMC增殖的影响
不同浓度VOMF对低氧诱导的PASMC增殖的影响结果(图3)显示,VOMF 1~4 g·L-1对低氧诱导的PASMC增殖的抑制作用呈浓度依赖性(r=0.938,P<0.05),明显高于常氧条件下的增殖抑制作用(P<0.05)。VOMF对低氧诱导的PASMC增殖抑制作用的IC50为1.66 g·L-1。因此,以肉豆蔻挥发油0.8,1.6和3.2 g·L-1进行后续相关实验。
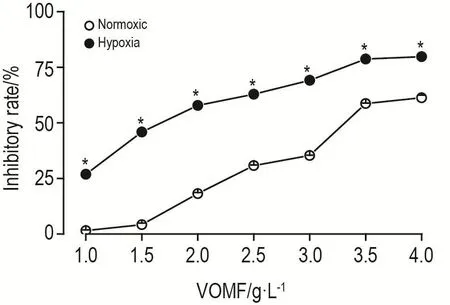
Fig.3 Inhibitory effect of VOMF on PASMCs.PASMCs were treated with VOMF 1.0,1.5,2.0,2.5,3.0,3.5 and 4.0 g·L-1 for 12 h.Cellular proliferation inhibitory rate(%)=1-hypoxia group A490 nm/normoxic group A490 nm×100%.n=3.*P<0.05,compared with corresponding normoxic group.
2.5 VOMF对GSH,MDA和SOD水平的影响
在无挥发油干预情况下,与常氧组相比,低氧组PASMC中GSH含量降低(P<0.05)。经VOMF干预后,当VOMF浓度达到1.6和3.2 g·L-1时,低氧组中GSH含量均升高,分别是常氧组的1.64和1.86倍(P<0.05),且随VOMF浓度的升高,GSH含量呈上升趋势(图4)。
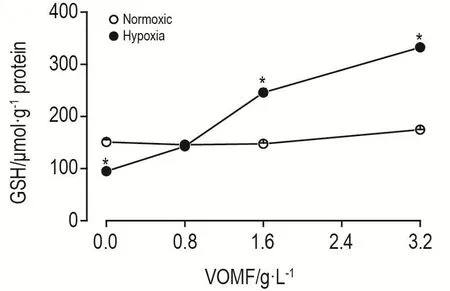
Fig.4 Effect of VOMF on level of glutathione(GSH)in PASMCs.PASMCs were treated with VOMF 0.8,1.6 and 3.2 g·L-1for 12 h.,n=3.*P<0.05,compared with corre⁃sponding normoxic group.
在无挥发油干预的情况下,低氧刺激PASMC导致MDA含量比常氧组提高,是常氧组的1.28倍(P<0.05)。经过VOMF干预后,低氧刺激下PASMC中MDA含量降低(P<0.05)(图5)。
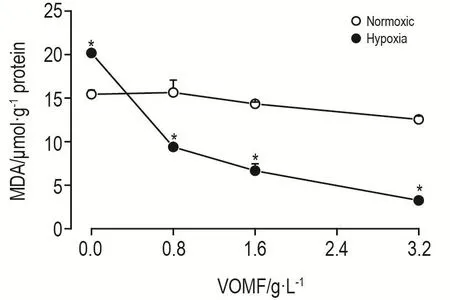
Fig.5Effect of VOMF on level of malondialdehyde(MDA)in PASMCs.See Fig.4 for the cell treatment.,n=3.*P<0.05,compared with corresponding normoxic group.
低氧下未加VOMF组细胞SOD的活性与相应常氧组相比降低(P<0.05),经过VOMF处理后,细胞中SOD的活性升高(P<0.05)。当VOMF浓度达到3.2 g·L-1时,低氧刺激下PASMC中SOD的活性是常氧组的1.12倍(图6)。
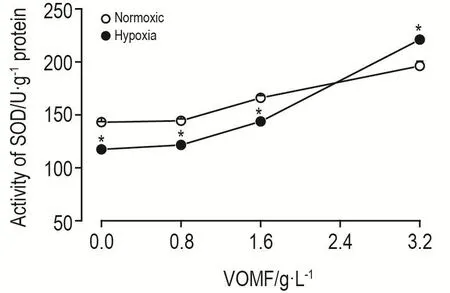
Fig.6 Effect of VOMF on activity of superoxide dismutase(SOD)in PASMCs.See Fig.4 for the cell treatment.,n=3.*P<0.05,compared with corresponding normoxic group.
3 讨论
持续发生的肺动脉血管收缩和PASMC增殖是发生HPAH的2个关键因素[2]。前期研究发现,三味檀香散能有效改善低氧诱导的肺动脉高压[10-11],而肉豆蔻作为其主要药材之一,其药用效果一直受到广泛关注,但迄今尚未见肉豆蔻对PASMC增殖影响的文献报道。
本研究通过GC-MS实验分析并鉴定了VOMF的化学成分。结果发现,其中以萜类化合物的含量最多(60.26%),其次是芳香族化合物(32.36%)和其他类化合物(7.33%)。VOMF中主要化学成分的分析结果与张根荣等[12]报道的结果基本一致。
体外抗氧化实验结果表明,VOMF具有清除DPPH自由基的能力,并具有一定的量-效关系,同时VOMF对于Fe3+具有一定的还原能力,但其能力较Vc(6.4 g·L-1)弱。结合已有实验结果和相关文献可以初步推测,抗氧化活性应与其含有的单萜类和芳香族类化合物有关。Nguyen等[13]研究报道,肉豆蔻抗氧化的活性成分主要是VOMF。亦有文献报道,单萜类化合物以及芳香性化合物中的肉豆蔻醚和榄香脂素等具有明确的抗氧化作用[10-13]。本研究结果表明,VOMF有较好的抗氧化能力。
本研究通过考察不同浓度VOMF对低氧刺激下PASMC增殖的抑制作用,发现其对低氧诱导PASMC增殖的抑制作用明显高于对常氧条件下的抑制作用,且具有浓度依赖性,提示VOMF对低氧刺激下的PASMC增殖具有选择性抑制作用。作为肉豆蔻中的主要成分,VOMF中的成分复杂,各成分之间含量差异大,且中药中的药效物质并不一定是其中活性强的化学成分[14]。所以尽管本研究结果发现其活性浓度偏高,但为后续药效物质的确定仍具有指导意义。
在细胞水平的抗氧化实验中,发现VOMF能显著提高细胞内GSH的含量和SOD活性,降低MDA含量,从而清除细胞内有害自由基,发挥细胞抗氧化能力。而且在常氧条件下依然具有此活性,并且VOMF浓度达到3.2 g·L-1时,抗氧化活性最高。
Chen等[15]和Rao等[16]研究表明,在低氧诱导的PASMC增殖过程中,氧化应激反应增强。而体内的氧化应激常常会促进细胞的增殖、生长和分化。因此,本研究中VOMF很可能通过抗氧化途径抑制低氧环境下PASMC增殖。VOMF的抗氧化活性与其治疗HPAH之间的关系有效成分有待进一步研究。

