急性冠状动脉综合征患者血清膜突蛋白抗体含量测定及相关性分析
朱芳萱 邓金龙 卢锋
膜突蛋白(Moesin)是一种连接细胞膜和细胞骨架的蛋白,除了参与细胞外部形态的维持外, 在细胞的信号转导、增殖迁移及聚集粘附等生物学过程中也发挥十分重要的作用[1,2]。大量的研究显示, 在高血压、动脉粥样硬化、糖尿病和代谢综合征患者血清中Moesin抗体表达量较高, 且和内皮损伤程度有明显相关性[3-5]。在ACS中, 内皮细胞损伤是始动和重要的发病环节, 虽然也有文献报道了Moesin抗体在ACS患者血清中的表达量较高, 但是目前两者的关系尚未有定论。本研究通过ELISA试剂盒检测ACS患者血清中Moesin抗体含量的OD值, 并且与GRACE评分进行相关性分析, 来探讨Moesin抗体和ACS病情严重程度的关系, 可能为临床ACS的诊断提供一种新的标志物。现报告如下。
1 资料与方法
1. 1 一般资料 选取广西民族医院2016年1月~2017年6月收治的120例经冠状动脉造影确诊的ACS患者, 根据造影影像学显示的病变程度不同分为3组:单支病变组40例, 其中男22例, 女18例;双支病变组44例, 其中男25例, 女19例;多支加左主干病变组36例, 其中男20例, 女16例。选择同期入院的有相关胸闷、胸痛症状但行冠状动脉造影冠脉狭窄<50%的非ACS患者120例作为对照组。有长期慢性心脏病史、免疫系统疾病、凝血功能障碍、肝肾功能不全、恶性肿瘤及不耐受造影剂的患者不纳入研究。
1. 2 冠状动脉造影检查 采用Judldns法的标准对检查结果进行判断, 血管狭窄程度>50%即为病变血管[6], 检测患者冠状动脉的左主干、前降支、回旋支和右冠状动脉支。
1. 3 GRACE评分 低危患者<108分, 109分≤中危患者≤140分, 高危患者>140分。
1. 4 临床样本收集检测 患者均于入院当天早上8点采集空腹血, 离心后收集上层血清, 使用人Moesin抗体检测ELISA试剂盒(美国CST公司)检测血清中Moesin抗体的OD值,采用双波长450 mm/630 mm, OD值>0.3纳入统计。
1. 5 统计学方法 采用SPSS21.0统计学软件对数据进行统计分析。计量资料以均数±标准差()表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验;计量资料相关性分析采用Pearson相关性检验。P<0.05表示差异具有统计学意义。
2 结果
2. 1 ACS组和对照组临床资料比较 对照组的TC、SBP、空腹血糖、ST段改变、心肌标志物改变情况均优于ACS组,差异具有统计学意义(P<0.05)。见表1。
表1 ACS组和对照组临床资料比较(n, )
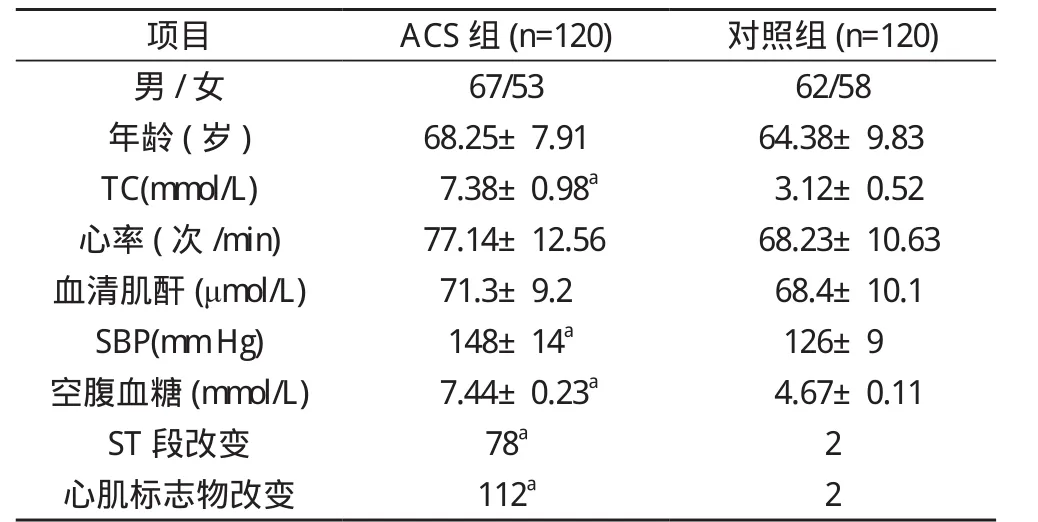
表1 ACS组和对照组临床资料比较(n, )
注:与对照组比较, aP<0.05;1 mm Hg=0.133 kPa
项目 ACS组(n=120) 对照组(n=120)男/女 67/53 62/58年龄(岁) 68.25±7.91 64.38±9.83 TC(mmol/L) 7.38±0.98a 3.12±0.52心率(次/min) 77.14±12.56 68.23±10.63血清肌酐 (μmol/L) 71.3±9.2 68.4±10.1 SBP(mm Hg) 148±14a 126±9空腹血糖(mmol/L) 7.44±0.23a 4.67±0.11 ST段改变 78a 2心肌标志物改变 112a 2
2. 2 ACS组和对照组Moesin抗体检出率比较 ACS组Moesin抗体OD值>0.3共58例, 抗体检出率48.3%;对照组Moesin抗体OD值>0.3共1例, 抗体检出率0.8%。ACS组Moesin抗体检出率高于对照组, 差异具有统计学意义(P<0.05)。
2. 3 ACS病变程度与Moesin抗体检出率及OD值的关系 随着病情加重, 患者血清Moesin抗体检出率和OD值逐渐增加。多支加左主干组Moesin抗体检出率及OD值均高于单支病变组, 差异有统计学意义(P<0.05)。见表2。
表2 ACS病变程度与Moesin抗体检出率及OD值的关系(n, %, )

表2 ACS病变程度与Moesin抗体检出率及OD值的关系(n, %, )
注:与单支病变组比较, aP<0.05
组别 例数 OD值>0.3 Moesin抗体检出率 OD值单支病变组 40 13 32.5 0.28±0.12双支病变组 44 20 45.5 0.39±0.16多支加左主干病变组 36 25 69.4a 0.47±0.21a
2. 4 GRACE评分与Moesin抗体OD值的相关性分析 ACS患者GRACE评分显示低危47例、中危37例、高危36例,高危组ACS患者血清Moesin抗体OD值与低危组、中危组比较, 中危组血清Moesin抗体OD值与低危组比较, 差异均有统计学意义(P<0.05)。相关性分析显示Moesin抗体OD值与GRACE评分呈正相关(r=0.476, P<0.05)。见表3。
表3 GRACE评分与Moesin抗体OD值的相关性分析(n, )

表3 GRACE评分与Moesin抗体OD值的相关性分析(n, )
注:与低危组比较, aP<0.05;与中危组比较, bP<0.05
组别 例数 单支病变组 双支病变组 多支加左主干组 OD值低危组 47 26 18 3 0.26±0.16中危组 37 11 17 9 0.36±0.18a高危组 36 3 9 24 0.48±0.15ab
3 讨论
ACS的发病机制十分复杂, 其中斑块稳定学说得到许多认可。该学说认为ACS中脂质斑块的稳定性是核心[7]。斑块主要是由脂质核心加纤维帽组成, 纤维帽的厚度以及平滑肌细胞与泡沫细胞的比例决定了斑块的稳定性。而当内皮细胞损伤时, 大量的脂质进入内膜下层, 刺激泡沫细胞的大量形成, 斑块的稳定性被破坏, ACS的发病凶险程度大大增加[8-10]。Moesin蛋白被认为可能是一种新型的与内皮细胞损伤疾病相关的血清标志物蛋白, 大量的研究已经表明, 在各种伴有内皮细胞损伤为特征的疾病如糖尿病、高血压等中,患者血清Moesin蛋白抗体的含量是明显增高的[11-13]。在本次研究结果中, 发现在ACS患者的血清中, Moesin蛋白抗体的检出率较非ACS患者有明显的增高, 这与之前的研究结果相符合。另外, 通过进一步研究还发现, ACS患者的血清Moesin蛋白抗体的OD值与患者的GRACE评分呈正相关(r=0.476, P<0.05), 提示在ACS疾病中, 血清Moesin蛋白抗体可能可以作为一种新型的标志物辅助诊断病情。
Moesin蛋白参与ACS的发病机制可能有几种。在内皮细胞损伤后, 炎症因子肿瘤坏死因子-α(TNF-α)大量分泌, 激活了下游的Moesin蛋白, 使其发生了磷酸化, 诱导内皮细胞骨架蛋白F-actin及通透性发生改变, 进一步加重病情[15-17]。另外有研究显示, 内皮细胞损伤后还有大量血管内皮生长因子(VEGF)产生, 也可以调节Moesin蛋白的磷酸化[18]。最后, Moesin蛋白可能通过下游的Rho信号通路促进巨噬细胞在内皮细胞的聚集和黏附, 加重内皮细胞损伤[19]。
综上所述, Moesin蛋白在ACS中可能是一种新型内皮细胞损伤的标志物, 且可以帮助评估ACS病情的危险程度, 在临床上有一定的应用价值。

