一种新型SnO2@BNNSs@C纳米复合结构及其电化学储能特性
艾 青,杨灿星,黄仁忠,杨艳飞,邹文祥,袁颂东
(湖北工业大学 太阳能高效利用湖北省协同创新中心,武汉 430068)
石墨因为相对低廉的价格,资源丰富等优势成为目前广泛使用的商业化锂离子电池阳极材料,但其理论容量仅为372mAh/g,已无法满足高能量密度存储应用对电池的需求;二氧化锡因其优异的高能量密度以及安全的工作电势[1-5],有效地避免大电流运行时所产生的安全问题而收获了广泛关注[6],但二氧化锡也存在充放电过程中体积变化大(约300%)易团聚而造成循环寿命短[7]的问题,Liu等[8]还认为SnO2在初始放电中还原为Li2O和金属Sn的过程是不可逆转的,会产生巨大的不可逆容量和较低的库仑效率。二氧化锡的反应机理可如下所述:
SnO2+ 4Li++ 4e-→ Sn + 2Li2O
(1)
xLi++xe-+Sn←→LixSn( 0≤x≤4.4 )
(2)
最近的研究表明,当SnO2是纳米尺度的或者被导电材料包覆时,反应(1)也是部分可逆的,这可以有效地提高SnO2的可逆容量并影响SnO2的循环性能[5]。Guo等[3]通过水热反应,紧接着高温热处理制备出了二氧化锡/碳中空微球,而Bonino等[9]制得了SnO2/C复合纳米纤维,Paek等[10]则构建了具有三维分层柔性结构的SnO2/r-GO纳米孔电极,这几种不同结构的纳米复合材料与单独的SnO2粒子相比,其可逆容量和循环性能以及库仑效率均得到显著提高。
h-BN作为石墨烯的类似物,也被称为白色石墨,因其比表面积大,热稳定性好,抗氧化能力强,机械应力高,受到越来越多研究人员的关注[11],最近Li等[12]通过真空过滤,随后进行热处理制备了无黏合剂的r-GO@BNNSs复合膜阳极材料,以100mA/g的电流密度对其进行充放电测试发现,200个循环后仍保有278mAh/g的容量;Chowdhury等[13]以h-BN作为 phosphorene(Pn)的封端剂,避免了Pn的结构与化学降解,使复合材料中的Pn既保留了电子属性又提高了化学稳定性,益于成为锂离子电池电极材料。这表明尽管h-BN纳米片具有差的导电性,但也可应用于电极活性物质的支撑材料,提高纳米活性材料的分散性和结构稳定性。据此,本工作设计了一种碳包覆SnO2@BNNSs的新型复合微观结构,以柔性BN纳米片作为纳米SnO2粒子的负载基底,使SnO2纳米粒子在BNNSs上均匀分布,形成微观点阵结构,有效地阻止纳米SnO2的再次团聚,减缓了在充放电过程中产生的体积效应;同时对此复合材料进行碳包覆,提高复合材料的整体导电性,进一步减缓体积效应,该研究从微观结构上对SnO2基负极材料进行优化设计,以获得更佳的电化学储能特性。
1 实验材料与方法
1.1 材料制备
1.1.1 实验材料
四氯化锡(国药集团,分析纯),尿素(西龙化学有限公司,分析纯),BN粉末(>99%,青州市氮化硼厂),浓硫酸(>98%,国药集团),葡萄糖(西龙化学有限公司,分析纯),无水乙醇(国药集团,分析纯)。
1.1.2 BN纳米片的制备
采用浓硫酸热膨胀法制备BN纳米片,该方法具有反应时间短、 成本低、生产设备简单,产率高(可达14.3%)、环境友好、易于规模化生产等优点,并且通过这种方法可获得质量良好的3~7层的寡层BN纳米片。
按一定质量比将BN原料与浓硫酸加入至圆底烧瓶中,常温下搅拌混合,然后转移至一定量去离子水中,同时超声,洗涤样品至中性。静置分层,取上层悬浮液过滤干燥得到少层的BN纳米片。
1.1.3 SnO2@BNNSs@C复合材料的制备
将BNNSs分散于去离子水中,然后将四氯化锡与尿素按照一定摩尔比加入至BNNSs分散液中,超声搅拌,水浴锅中反应4h,反应完全后用去离子水,乙醇交替洗涤,并用0.1mol/L的硝酸银稀溶液检验滤液至无沉淀析出,说明氯离子洗涤干净,干燥即得到Sn(OH)4/BN纳米复合材料;将所制备的纳米复合材料均匀分散到一定量的葡萄糖溶液中,低温干燥,在氮气保护下煅烧获得三元复合材料SnO2@BNNSs@C。本工作所述纳米二氧化锡,纳米二氧化锡/碳,纳米二氧化锡/氮化硼纳米片三种材料也采用共均匀沉淀法制备。
1.2 材料表征
扫描电子显微镜(SEM,SU8010型),透射电子显微镜(TEM,Tecnai G220型)表征样品的形态和结构;傅里叶转换红外光谱仪(FTIR,波长范围500~4000cm-1,最高分辨率为0.02cm-1)进行官能团结构分析; X射线衍射仪(XRD)表征样品晶相:铜靶(λ=0.15418nm),管压40kV,衍射角度10°~90°,样品为干燥12h的固体粉末。
1.3 电化学测量
工作电极由活性物质(SnO2@BNNSs@C,SnO2,SnO2@BNNSs,SnO2@C纳米粒子)、乙炔黑(AB)、羧甲基纤维素(CMC)按质量比80∶10∶10制成均匀浆料涂覆在Cu箔上,80℃真空箱干燥12h,并切成12mm的圆形电极片制成,以金属锂为对电极,PC/PE/PC膜作为隔膜,以1mol·L-1LiPF6(溶剂为碳酸亚乙酯(EC):碳酸二甲酯(DMC)=1∶1,体积比)作为电解液,将其在充满Ar的手套箱,[O2] <10-6,[H2O] <10-6中组装成半电池(CR2032)。通过CT2001a电池测试仪器(LAND Electronic Co.)在室温下对扣式电池进行恒温充放电性能测定,电压为0.01~3.0V;循环伏安曲线(CV),交流阻抗(EIS)由电化学工作站以扫描速率0.5mV/s进行测试。
2 结果与分析
图1为纯相纳米SnO2以及SnO2@BNNSs,SnO2@C,SnO2@BNNSs@C纳米粒子的XRD谱图,图1四组图谱中均出现了多个SnO2特征衍射峰,图1 SnO2@BNNSs复合物,与SnO2一样,SnO2@BNNSs图谱并未出现表征h-BN的特征峰,但所有衍射峰的峰强度降低,这可能是由于BN纳米片(002)晶面的衍射峰也出现在26.7°左右[14-15],与SnO2材料的(110)晶面衍射峰重合;SnO2@C,SnO2@BNNSs@C纳米粒子的衍射谱图与上述两个谱图相比,也没有出现新的衍射峰(例如表征石墨(002)的特征衍射峰26.4°),但衍射峰的整体强度变弱很多,这是由于SnO2与SnO2@BNNSs表面均包覆了一层无定型碳,影响了整体材料的晶化强度,削弱了衍射峰的峰强度,这也从侧面说明所制备的样品SnO2@BNNSs@C碳包覆较为均匀[16-18]。
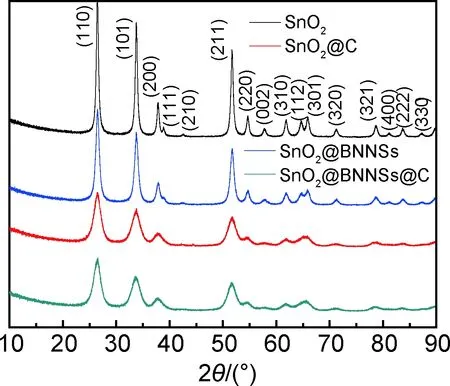
图1 SnO2,SnO2@C,SnO2@BNNSs和SnO2@BNNSs@C 的XRD图Fig.1 XRD spectra of SnO2,SnO2@C,SnO2@BNNSs and SnO2@BNNSs@C
采用FTIR对SnO2,SnO2@C,SnO2@BNNSs@C纳米材料进行官能团结构分析,由图可知,在3405cm-1和1645cm-1附近处均出现O—H的伸缩振动和弯曲振动吸收峰,这是由于样品吸收了水分[19];在627cm-1附近处出现的吸收峰归属于SnO2材料中Sn—O键的振动吸收[20-21]。图2中SnO2@BNNSs@C位于1377cm-1和810cm-1附近处出现的吸收峰对应于h-BN纳米片的B—N面内拉伸振动和B—N—B弯曲振动[22],除此之外,并没有O—B键或Sn—N键的出现,说明SnO2与BNNSs之间并不是以化学键的方式结合,而是简单的物理吸附;结合XRD衍射谱与红外谱图说明所制备的SnO2@BNNSs@C主要由SnO2与BN构成,这与后面TEM分析的结果相一致。
图3为SnO2与SnO2@BNNSs@C复合材料的SEM图,由图3(a)可知,单纯SnO2纳米颗粒呈近似球形,颗粒间紧密排列,团聚成较大的球,在循环充放电过程中将会有一个较大的体积效应,造成材料粉化,影响材料的循环稳定性;图3(b)中,SnO2纳米颗粒均匀地分散在BN纳米片上,阻隔BN纳米片的再次堆叠,提供更多的负载位点,同时具有良好机械应力的BN纳米片作为SnO2的负载基底,抑制了SnO2颗粒在充放电循环过程中的再次团聚,使其保持在一个较小的粒径范围,同时也作为缓冲层,容纳SnO2纳米粒子的体积改变,改善材料的机械应力,提高复合纳米粒子的结构稳定性。
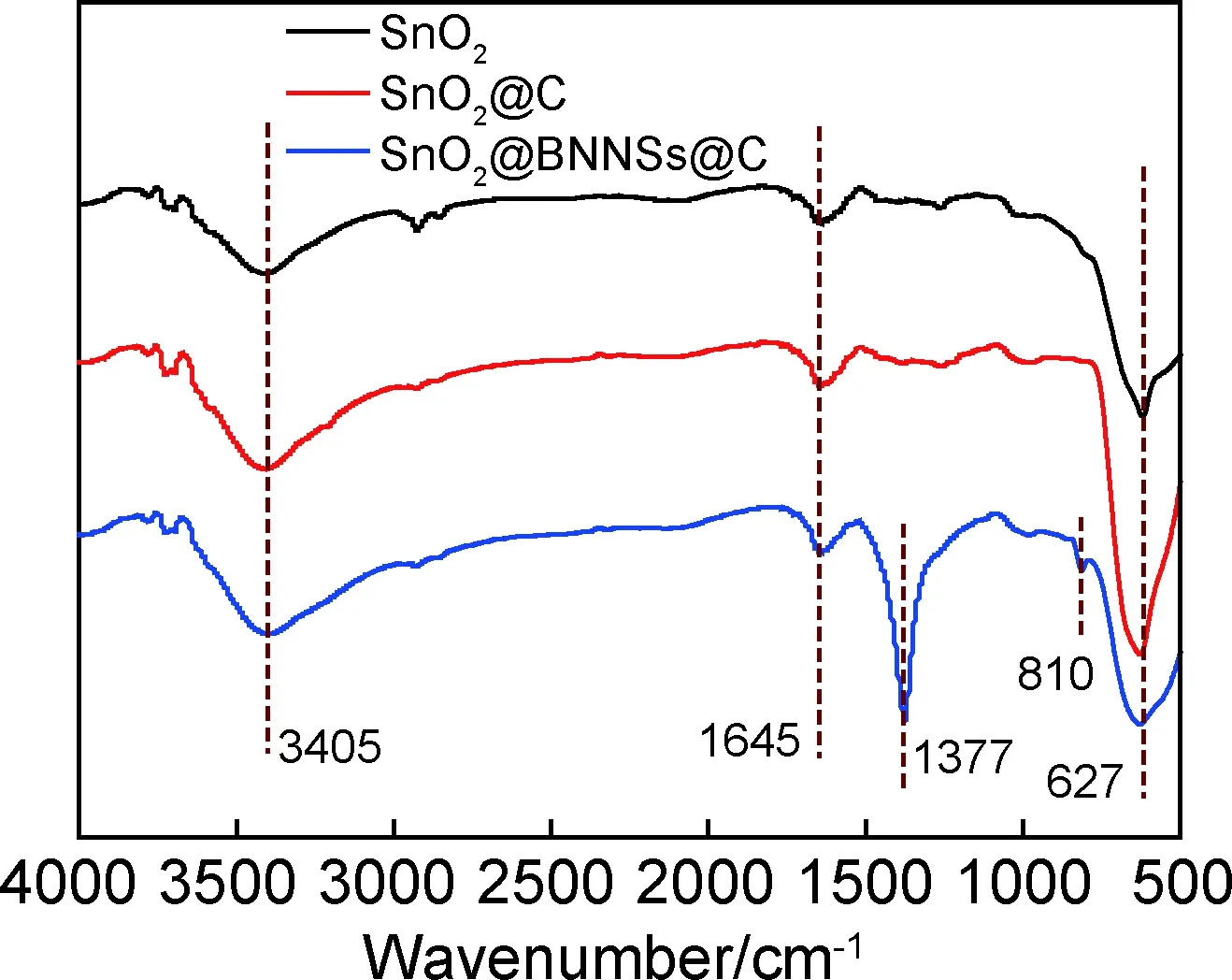
图2 SnO2,SnO2@C和SnO2@BNNSs@C的红外光谱图Fig.2 FITR spectra of SnO2,SnO2@BNNSs and SnO2@BNNSs@C

图3 SnO2(a)与SnO2@BNNSs@C(b)的扫描电镜图Fig.3 SEM images of SnO2(a) and SnO2@BNNSs@C(b)
采用TEM对SnO2@BNNSs@C复合纳米粒子进行表征,如图4。由图4(a),(b),(c)可知,大部分SnO2纳米粒子为近似球形分布在h-BN纳米片上,形成较好的“点阵”纳米复合结构,无明显的团聚现象,但分布的密度有一点差异。这与上述的SEM图像相一致,使整体材料具有一个较大的比表面积,可容纳SnO2在充放电过程中的体积变化[18],避免在循环过程中因锂离子的多次嵌入脱出,使电极材料的结构遭到严重破坏,影响材料的循环稳定性与倍率性能。而观察图4(d)可知,在高倍率透射电镜下,纳米SnO2平均粒径为5nm左右(图中箭头所指),图中清晰可见的晶格间距为0.33nm对应于六方SnO2(110)晶面,同时,图中也标出了h-BN的晶面间距为0.334nm,其对应于BN的(002)晶面,结合XRD,SEM与红外图谱分析这三种表征手段,证实了复合材料中大部分SnO2纳米粒子在BNNSs上的成功负载,并且无化学反应发生。

图4 SnO2@BNNSs@C复合材料不同倍率下的透射电镜图(a)0.2μm;(b)100nm;(c)20nm;(d)5nmFig.4 TEM images of SnO2@BNNSs@C composite at different magnifications respectively(a)0.2μm;(b)100nm;(c)20nm;(d)5nm
采用电化学工作站测量SnO2@BNNSs@C纳米粒子的电化学储能性能,同时以SnO2,SnO2@C纳米粒子作为实验对照组,分别作为负极组装进半电池中,进行循环性能测试。图5是通过电化学工作站以扫描速率0.5mV/s,测试电压为0.005~3V得到的SnO2@BNNSs@C复合材料的前三次循环伏安图,在第一次放电过程中,0.75~1V区间内出现了一个极明显的还原峰,对应于放电过程中SnO2还原为Sn单质与合成Li2O的过程,在这个电势区间下,峰电流下降极快;随着电势降低,位于区间0.2~0.3V内又出现了一个小的还原峰,证明了Sn合金化反应的发生;在初次充电过程中,0.5~0.75V区间内出现了第一个氧化峰,对应于LixSn的去合金化反应,位于1.25~1.5V范围内出现了第二个氧化峰,表明SnO2+4Li++4e-→Sn+2Li2O可逆反应的发生,该峰在接下来的第二次、第三次循环过程中也存在,说明在该复合结构中,SnO2与Li+之间的反应是部分可逆的,这种现象有助于提高材料的储锂容量,降低不可逆容量,再次证实了过渡金属的粒径在30nm以下并且具有一个大的比表面积时,生成Li2O的反应是部分可逆的[6,23-25]。
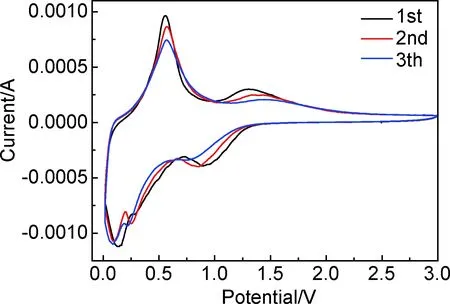
图5 SnO2@BNNSs@C复合材料的前三次循环伏安曲线图Fig.5 Cyclic voltammetry curves of SnO2@BNNSs@C composite for the first three cycles
比较图6(a)SnO2与图6(b)SnO2@BNNSs@C纳米粒子在第1,2,10次循环过程中充放电比容量发现,SnO2@BNNSs@C纳米粒子在第10次循环的可逆比容量高达764mAh/g,是第二次放电比容量的78%,而纳米SnO2负极材料经过10次循环后可逆比容量降为618mAh/g,容量保持率仅为62%,远低于SnO2@BNNSs@C纳米材料,较于SnO2纳米粒子,SnO2@BNNSs@C复合材料具有一个更好的循环稳定性,这主要归功于复合材料新型的微观结构,引入BN纳米片作为SnO2的柔性负载基底在一定程度下容纳了活性材料SnO2的体积变化与再次团聚,使材料在充放电过程也保有高的结构稳定性与大的比表面积,保证材料与电解液之间高的活性接触,利于锂离子在活性材料中传输;而碳包覆作为材料的缓冲层进一步减缓材料的体积膨胀效应,降低材料结构的粉化程度,同时在材料内部构建了导电通道,促进电子的传递速率,降低极化程度,提高材料的充放电比容量,改善SnO2作为锂离子电池负极材料的电化学储锂性能。

图6 SnO2(a)与SnO2@BNNSs@C复合材料(b)的充放电曲线图Fig.6 Charge-discharge voltage profiles of SnO2(a) and SnO2@BNNSs@C composite(b)
为进一步说明SnO2@BNNSs@C复合材料优异的电化学性能,本工作以100mA/g的电流密度,0.005~3V的电压范围对SnO2@BNNSs@C,SnO2,SnO2@C纳米粒子进行充放电测试,比较三种材料的循环稳定性。如图7所示,SnO2@BNNSs@C复合材料经过50次充放电循环后具有一个高的可逆比容量490mAh/g,库仑效率高达98.8%,展现了优异的电化学可逆性;SnO2纳米粒子在第10次,50次循环后的放电比容量从初始的995mAh/g分别降到了657mAh/g,129mAh/g,第50次的循环容量保持率仅在12.9%左右,循环稳定性比较差;而复合材料SnO2@C在同样大小的电流密度下,经过10次,50次循环充放电后,放电比容量也分别降到了636mAh/g,133mAh/g,与SnO2纳米粒子作为负极材料并无太大差别,说明仅对二氧化锡进行碳包覆并不能完全改善材料的循环稳定性,可能原因是,直接将SnO2与碳材料经过机械搅拌混匀,随后经过退火处理的这种复合方式使得碳材料不易渗进活性材料内部,为SnO2在充放电过程中产生的机械应力提供全面的支撑作用;而在制备SnO2@BNNSs@C复合材料过程中,首先将寡层的h-BN纳米片分散进SnO2前驱体合成体系中作为负载基底,使SnO2前驱体直接在BN纳米片上原位生长,抑制SnO2前驱体在生长过程中的团聚,构成有序粒子体,缩短锂离子在活性材料中的传递路径,减缓大的体积效应;随后将SnO2@BNNSs与碳源混匀,经过热处理得到碳包覆的SnO2@BNNSs@C,以提高整个复合材料的导电性,降低极化程度增大可逆容量。

图7 SnO2,SnO2@C与SnO2@BNNSs@C复合材料的循环曲线Fig.7 Cyclic curves of SnO2,SnO2@C and SnO2@BNNSs@C composites
图8为SnO2,SnO2@BNNSs@C纳米粒子在不同充放电倍率下的循环倍率图,从图8可知,SnO2纳米粒子在不同倍率0.1,0.2,0.5,1,2,5C下对应的可逆比容量分别为790,642,438,229,38,1mAh/g,SnO2@BNNSs@C在相应不同倍率下的放电比容量分别是883,706,544,413,199,84mAh/g,两种纳米粒子的放电比容量随着充放电倍率的增加而降低,其中,在大于0.5C的倍率下,SnO2@BNNSs@C较于单纯SnO2具有一个更明显的倍率稳定性;随后用0.1C倍率再次对其进行充放电时,SnO2@BNNSs@C与SnO2比容量又分别回到600,278mAh/g,可知新型结构的SnO2@BNNSs@C纳米粒子有一个更好的电化学可逆性与大电流倍率性能,这与前面CV图得出的结果保持一致,同时也证明该复合材料经过大电流的充放电时结构未受大的损坏。
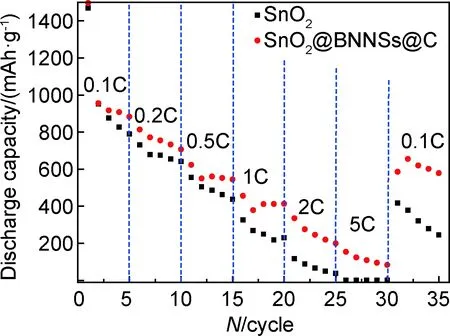
图8 SnO2,SnO2@BNNSs@C复合材料的倍率性能Fig.8 Rate performance of SnO2 and SnO2@BNNSs@C composites
为进一步验证碳在SnO2@BNNSs@C纳米粒子中发挥的作用,本工作对SnO2@BNNSs@C与SnO2@BNNSs纳米粒子做了EIS测试,相应的Nyquist图如图9所示,高中频区出现的半圆为电极材料与电解液界面电荷转移动力过程,该半圆半径值大小对应于电荷传递阻抗,而在低频区出现的斜线对应于锂离子在活性材料中的扩散过程,直线的斜率越大,扩散系数越大,锂离子在活性材料中的扩散速率就越快;比较图中的两个曲线可知,SnO2@BNNSs@C的电荷阻抗与扩散阻力均小于SnO2@BNNSs,说明碳材料在SnO2@BNNSs表面形成了一个导电网络,加快了电子,离子的传递速率,降低了材料的电荷传递阻抗。
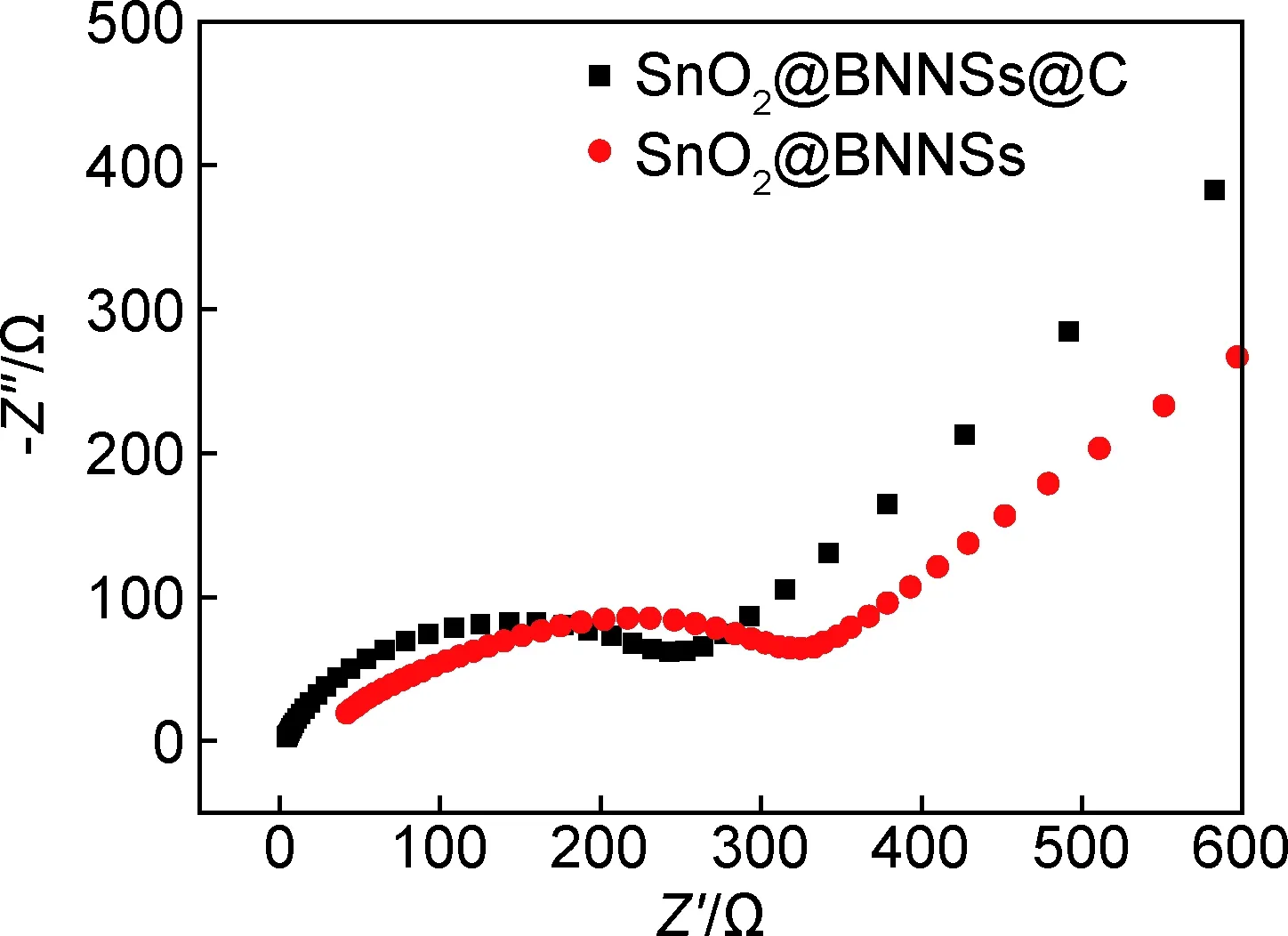
图9 SnO2@BNNSs与SnO2@BNNSs@C复合材料的交流阻抗谱Fig.9 AC impedance spectra of SnO2@BNNSs and SnO2@BNNSs@C composites
3 结论
(1)本工作采用浓硫酸热膨胀法成功制备出寡层h-BN纳米片,并在SnO2合成过程中以BNNSs为柔性基底,得到粒径约5~10nm,大部分均匀分散在BNNSs上的SnO2@BNNSs,然后以葡萄糖为碳源得到SnO2@BNNSs@C纳米材料。
(2)该方法获得的SnO2@BNNSs@C复合材料呈现了显著增强的电化学性能,在100mA/g的电流密度下循环50次后容量仍高达490mAh/g,远高于纯SnO2,SnO2@C纳米粒子的可逆容量,显示出更优异的循环稳定性,为研发用于锂离子电池的新型高性能复合阳极材料奠定基础。

