CDH1基因1018位点突变对乳腺癌非同源末端连接修复途径的影响及作用机理研究
汤永喆,王 杰,何 奇
上海交通大学医学院附属国际和平妇幼保健院乳腺科,上海200030
乳腺癌已成为中国女性发病率最高的恶性肿瘤[1]。乳腺癌患者的基因损伤修复能力较正常人相比有退化。
非同源末端连接(non-homologous end joining,NHEJ)修复途径是DNA损伤修复过程中极为重要的一部分,NEHJ途径通过多种功能性蛋白分子复合来发挥作用,这其中减数分裂重组蛋白11同系物A(meiotic recombination 11 homolog A,MRE11)是负责招募并组成蛋白复合体的重要组成部分[2-3],对MRE11的检测间接说明了其 NHEJ 修复的程度[4-5]。乳腺癌易感基因1(breast cancer susceptibility gene l,BRCA1)是已明确的乳腺癌易感基因[6-7]。
本研究中经过对部分乳腺癌患者及其直系家庭成员进行血液样品的采集与检测,筛选出已知乳腺癌致病基因突变7种、意义不明突变6种以及疑似致病基因突变38种。经过生物信息学软件预测,上皮钙黏蛋白编码基因(E-cadherin gene,CDH1)的1018位点错义突变c.1018A>G(p.Thr340Ala)极有可能是一种致病突变类型,针对该位点突变,本研究利用DNA损伤修复过程中的NHEJ途径的报告系统,对该突变位点进行验证。
1 材料和方法
1.1 材料
MDA-MB-231细胞系购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库,胎牛血清、RPMI-1640培养基购自生工生物工程(上海)股份有限公司,CDH1基因质粒购自上海吉凯基因化学技术有限公司(图1),CDH1抗体购自美国Sigma公司,MRE11抗体、BRCA1抗体购自美国Abcam公司,β-actin抗体购自北京全式金生物技术有限公司;NHEJ报告系统由南京金凯瑞基因公司合成。共收集上海交通大学医学院附属国际和平妇幼保健院乳腺科65份乳腺癌患者全血样品,于深圳华大医学检验中心进行相关基因检测。
图 1 CDH1-pcDNA3.1 质粒图谱Fig. 1 The plasmid profile of CDH1-pcDNA3.1
1.2 方法
1.2.1 致病基因突变位点的筛查
本研究选取2014年5月—2017年5月在上海交通大学医学院附属国际和平妇幼保健院活检或手术后病理确诊为乳腺恶性肿瘤的患者共65例,收集患者血液样本检测。患者均为女性,年龄24~56岁,中位年龄34岁。患者存在一定的遗传性乳腺癌高危因素,如在询问病史过程中发现患者具有血缘关系的三级亲属中存在至少一种肿瘤家族史(乳腺癌、卵巢癌、胃癌及前列腺癌等,双侧乳腺癌患者,患者发病年龄小于45岁等)。在本研究中受检的65份血液样本中,31例患者未发现突变基因;6例患者中存在已知致病基因突变共6种,23例患者发现意义不明突变38种,5例患者中发现疑似致病基因突变7种(表1)。其中1例28岁女性患者,经病理确诊左侧乳腺癌,其家族中虽然父母均未患病,但外公、外婆、阿姨、奶奶均为乳腺癌患者,故推测该患者罹患病症为家族性隐性遗传性乳腺癌(家系图见图2)。对其全血样品进行乳腺癌致病基因筛选,经遗传分子检测后发现该患者CDH1基因(NM_004360)第1018位点发生突变(c.1018 A>G)导致氨基酸发生了改变(p.Thr340Ala),该遗传方式符合孟德尔遗传定律,故选取该基因位点,进行后续实验验证。
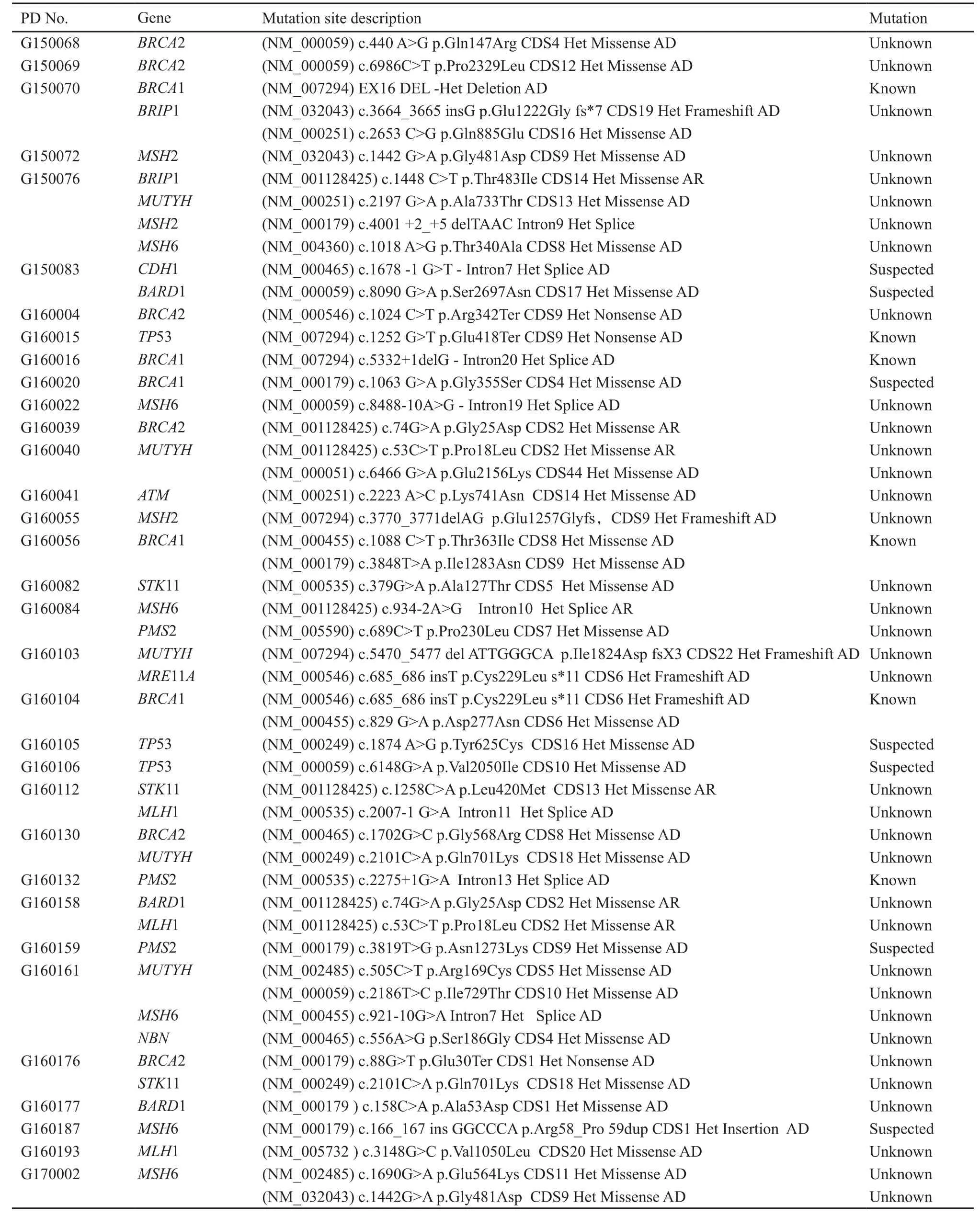
表 1 遗传性乳腺癌/卵巢癌基因检测结果汇总表Tab. 1 Summary of genetic testing results for breast cancer/ovarian cancer
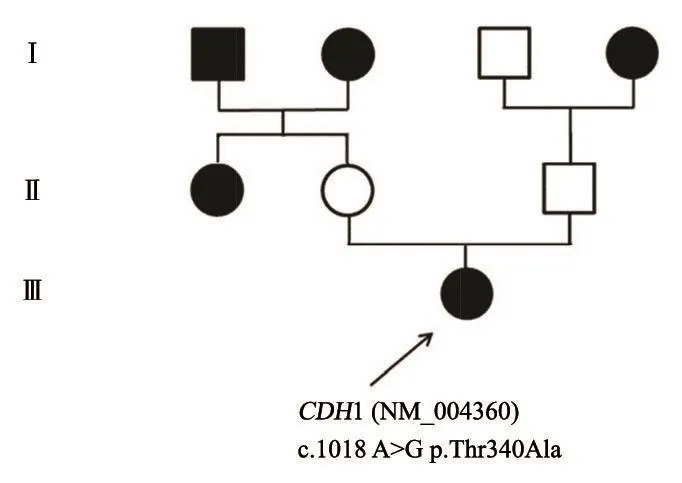
图 2 乳腺癌患者家系图Fig. 2 The pedigree of a breast cancer patient
1.2.2 CDH1-KO细胞系的构建
利用CRISPR/cas9系统构建CDH1-gRNA,序列为5’-CACCGGAGAGACACTGCCAA CTGGC-3’,将cas9质粒与gRNA质粒按1∶1的比例转染MDA-MB-231细胞系,48~60 h后将细胞进行稀释培养,挑取单克隆细胞后接种入24孔板,提取基因组DNA进行测序验证,得到CDH1敲除(CDH1-knockout,CDH1-KO)细胞系。
1.2.3 CDH1基因及其突变体对细胞增殖的影响
CDH1基因突变体(NM_004360)c.1018 A>G质粒,采用定点突变PCR技术,由长片段引物扩增后得到。将pcDNA3.1空载质粒(EV)、CDH1基因质粒(CDH1)以及CDH1-1018位点突变质粒(CDH1-1018)分别转染进入CDH1-KO细胞系,取24、36、48、60和72 h时间节点,利用MTT法对细胞增殖率进行测定。
1.2.4 CDH1基因点突变对DNA损伤修复效率的影响
本实验运用了一种绿色荧光蛋白(green fluorescent protein,GFP)标记的NHEJ报告系统[2],该系统被一个上游的、翻译移码的起始位点(Koz-ATG) 所抑制,经过i-sceⅠ酶切造成DNA双链断裂后,Koz-ATG会被切除,之后DNA末端的修复会允许GFP在正确的翻译框中进行翻译,采用流式细胞术进行检测,按照GFP会正常发光的概率,可以估算出损伤后DNA修复的效率[8]。
将pcDNA3.1空载质粒(EV)作为对照,将CDH1基因质粒(CDH1)与CDH1-1018位点突变体质粒(CDH1-1018)转染进入CDH1-KO细胞系,于48 h用i-sceⅠ酶进行酶切,收集细胞并采用流式细胞术进行验证。
1.2.5 CDH1基因突变对DNA损伤修复过程中相关蛋白质表达情况的影响
将pcDNA3.1空载质粒(EV)作为对照,将CDH1基因质粒(CDH1)与CDH1-1018位点突变体质粒(CDH1-1018)转染CDH1-KO细胞系,收集细胞制备蛋白样品,对NHEJ修复途径相关蛋白MRE11及乳腺癌相关蛋白BRCA1的表达情况进行验证。
1.3 统计学处理
对不同时点细胞增殖率检测结果采用SPSS 13.0软件进行统计分析。组间比较采用配对卡方检验。P<0.05为差异有统计学意义。
2 结 果
2.1 CDH1-KO细胞系的构建
CRISPR/Cas9与gRNA质粒共转染进入细胞,挑取单克隆细胞并进行鉴定,通过PCR及Western blot检测验证CDH1-KO细胞系建立并已成功挑取单克隆株培养(图3、4)。
2.2 CDH1基因及其突变体对细胞增殖的影响
将pcDNA3.1空载质粒(EV)、CDH1野生型基因质粒(CDH1)以及CDH1-1018位点突变质粒(CDH1-1018)分别转染进入细胞,取24、36、48、60和72 h共5个时间节点,使用MTT法对3种细胞进行细胞增殖能力检测(图5)。
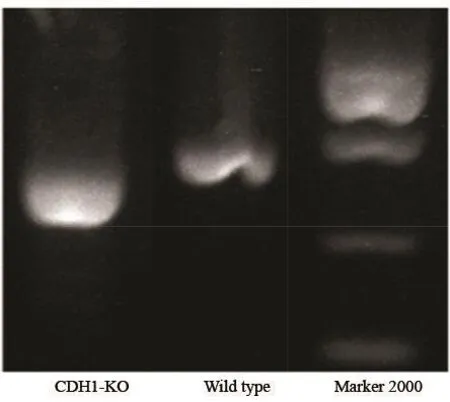
图 3 CDH1-KO细胞系PCR结果图Fig. 3 PCR results of the CDH1-KO cancer cell lines
MTT细胞增殖实验结果显示,CDH1基因对细胞的增殖能力具有一定的影响,对比转染空载的CDH1-KO细胞株,CDH1回补细胞株的增殖能力大幅提升(P<0.01),而且CDH1-1018位点突变细胞回补株的增殖能力不如CDH1野生株(P<0.05)。

图 4 Western blot检测CDH1-KO细胞系蛋白表达情况Fig. 4 The protein expression in CDH1-KO cancer cell line detected by Western blot

图 5 MTT细胞增殖实验显示CDH1基因及CDH1-1018突变体质粒转染后细胞增殖率Fig. 5 MTT assay indicated cell proliferation rate after CDH1-KO cells were transfected with CDH1 and CDH1-1018 plasmid
2.3 CDH1基因点突变对DNA损伤修复效率的影响
运用NHEJ报告系统(图6)对DNA损伤修复效果进行验证,报告系统中GFP荧光强度间接反映在DNA损伤修复过程中NHEJ途径的效率。将报告系统与质粒共转染CDH1-KO细胞株中,用流式细胞术进行绿色荧光检测(图7)。
流式细胞术检测GFP荧光效率,结果表明,CDH1基因参与了NHEJ修复途径,在回补CDH1基因后,NHEJ损伤修复效率有了明显升高(P<0.01)。而回补CDH1-1018位点突变体质粒后,NHEJ修复效率有所升高(P<0.05),但低于回补CDH1质粒的效率。

图 6 NHEJ报告系统结构图Fig. 6 NHEJ reporting system structure
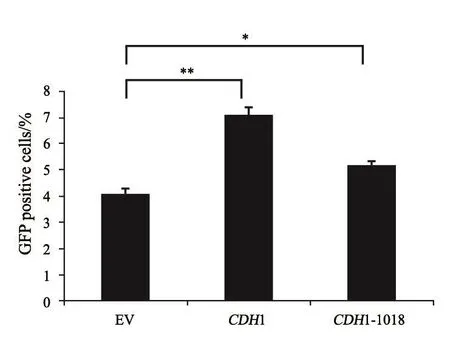
图 7 流式细胞术检测i-sceⅠ酶切后GFP荧光效率Fig. 7 Detection of GFP by flow cytometry after i-sceⅠ enzyme digestion
2.4 CDH1基因突变对DNA损伤修复过程中相关蛋白质表达情况的影响
在CDH1-KO细胞系中,将pcDNA3.1空载质粒(EV)、CDH1野生型基因质粒(CDH1)以及CDH1-1018位点突变质粒(CDH1-1018)分别转染进入细胞,并检测NHEJ修复途径中相关蛋白MRE11及乳腺癌相关蛋白BRCA1等的表达情况,β-actin作为内参。
Western blot检测结果表明,NHEJ修复途径中的关键蛋白分子MRE11在CDH1-KO细胞中表达很弱,回补CDH1野生型质粒后MRE11有很大程度上的表达恢复,而回补CDH1-1018位点突变型质粒后,MRE11的表达量有所恢复,但其程度相较CDH1野生型质粒回补效果较弱;对BRCA1蛋白表达量的检测,则说明了CDH1基因对BRCA1蛋白表达的促进效果:CDH1野生型质粒回补后,BRCA1蛋白表达量较高,CDH1-1018位点突变质粒回补后,BRCA1蛋白表达量略见升高,但其效果弱于前者(图8)。
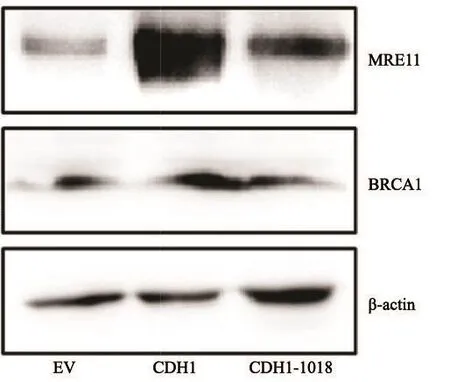
图 8 Western blot法检测CDH1基因质粒以及CDH1-1018位点突变质粒转染CDH1-KO细胞系后MRE11蛋白及BRCA1蛋白Fig. 8 Western blot results of MRE11 protein and BRCA1 protein after CDH1-KO cell line was transfected with CDH1 and CDH1-1018 plasmids
3 讨 论
CDH1基因表达强弱对细胞的增殖能力具有一定的影响,且CDH1-1018位点突变细胞株的增殖能力弱于野生型CDH1细胞株,说明该位点的突变可影响细胞增殖,具有研究价值。
通过NHEJ报告系统与流式细胞术检测DNA损伤后GFP荧光效率,说明CDH1基因对于NHEJ修复途径的重要性。而且回补CDH1-1018位点突变体后,DNA损伤修复过程中NHEJ途径的效率比野生型CDH1有所降低,说明CDH1基因第1018位点A>G的突变可使NHEJ修复方式的效率降低,由此推测此位点的突变类型很可能为致病突变,会引起DNA损伤修复过程的减弱。
通过对NHEJ修复途径中的关键蛋白分子MRE11的检测,表明CDH1基因对NHEJ途径的影响显著。回补CDH1-1018位点突变质粒后,MRE11的表达量回升效率低于野生型CDH1,说明1018位的突变对MRE11的表达有一定程度的抑制作用;同时,也说明该位点的突变对NHEJ修复途径有较大影响。本研究通过对BRCA1蛋白表达量的检测发现,CDH1基因对BRCA1蛋白的表达有促进作用,CDH1-1018位点突变质粒回补后,BRCA1蛋白的表达量有所降低。
有研究显示[9],CDH1基因与细胞间黏附性相关,我们推测,CDH1基因1018位A>G位点突变后,会使得细胞浸润能力减弱,DNA修复过程中蛋白招募过程变慢,从而使得细胞的整体损伤修复效率降低,在乳腺癌易感基因群体中,该基因1018位点的突变,很可能是与其他基因突变共同作用造成细胞损伤,最终使重要位点分子受到影响而导致癌症的发生。

