早期乳腺癌保乳术后大分割放疗Ⅱ期临床研究
——中期安全性及有效性分析
罗菊锐,陈星星,杨昭志,张 丽,马金利,梅 欣,邵志敏,郭小毛,俞晓立
1.复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海 200032
乳腺癌保乳术后全乳放疗是早期乳腺癌的标准治疗模式[1]。当前,保乳术后常规放疗模式为50 Gy/25次,总疗程5~6周。早期乳腺癌全乳大分割放疗的三项重要Ⅲ期临床研究START A、B以及加拿大研究,随访10年以上结果证实全乳大分割放疗对比常规全乳放疗,有相似的局部区域控制率和生存率,与常规分割相比,大分割有更好的美容效果[2-3]。鉴于上述研究,美国肿瘤放射治疗肿瘤学会(American Society for Therapeutic Radiology and Oncology,ASTRO)2011年指南推荐年龄≥50岁、病理分期为pT1-2N0、不接受全身化疗、放疗的剂量学达中心轴平面±7%的人群可接受全乳大分割放疗[4]。2018年指南更新则将人群扩展至任何年龄、任何分期、任何化疗方案[5],并指出除临床研究外,推荐全乳放疗后序贯瘤床加量。因此对于大分割放疗同期瘤床加量,目前仍存在争议。本研究拟在中国人群中探讨早期乳腺癌保乳手术后全乳大分割放疗同期瘤床加量的安全性、局部美容效果以及疾病控制的有效性。
1 资料和方法
1.1 临床资料
本研究为单中心Ⅱ期临床试验,通过复旦大学附属肿瘤医院伦理委员会的审批(伦理批件编号:1406136-Exp1),并完成临床试验注册,ClinicalTrail.gov ID: NCT02617043。
入组标准:① 女性,年龄≥18岁;② 术前未接受新辅助治疗;③术前影像学检查证实为单发肿块;④ 接受保乳手术,切缘阴性;⑤ 术后病理证实为浸润性乳腺癌,病理分期为pT1-2N0M0;⑥ 瘤床可勾画;⑦ 既往无乳腺癌或其他肿瘤病史;⑧ 无严重内科疾病史;⑨ 卡氏体能状态评分(Karnofsky performance status,KPS)≥70。排除标准:① 前哨淋巴结孤立肿瘤细胞转移;② 术前或放疗前影像学检查发现可疑锁骨上、内乳区淋巴结或其他部位远处转移;③双乳癌或既往对侧乳腺癌;④ 接受假体或自体重建术;⑤ 既往其他部位恶性肿瘤病史或放疗史;⑥ 目前存在活动性感染;⑦ 合并严重内科疾病或预计生存期小于6个月;⑧ KPS<70分;⑨ 妊娠或哺乳期乳腺癌。
1.2 治疗
1.2.1 辅助化疗
依据术后病理特点及化疗指征,患者于手术后4周内接受辅助化疗,方案包括蒽环、紫杉及铂类等药物。
1.2.2 辅助放疗
患者取仰卧位,乳腺托架固定体位,使用大孔径定位CT扫描,扫描范围上界包括完整的环状软骨,下界至患侧乳房皱褶下2 cm,层厚为5 mm。临床靶体积(clinical tumor volume,CTV)为全乳腺范围,包括CT上可见的腺体,并参考患者的乳腺皱褶边界,计划靶体积(palnned target volume,PTV)为CTV外扩5 cm。本研究可选用适型调强放疗(intensitymodulated radiation therapy,IMRT)和容积弧形调强放射治疗技术(volumetric intensity-modulated arc therapy,VMAT)。处方剂量为全乳PTV 40 Gy/15次/3周,同期瘤床加量至48 Gy/15次/3周。
1.3 急性不良反应及美容效果评估标准
放疗开始至放疗结束后3个月内,进行放疗急性不良反应评估,采用常见不良事件用语标准4.03版(Common Terminology Criteria for Adverse Events V4.03,CTCAE V4.03)进行分级。放射性肺炎参考肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)/欧洲癌症研究治疗组织(European Organzation for Research and Treatment of Cancer,EORTC)分级标准。放疗结束后6个月及之后的每年进行美容效果评估,评估采用EORTC美容效果评估系统[6]的4分法:极好、好、一般、差。
1.4 随访
治疗开始至结束后3个月持续随访评估急性不良反应,后续每3个月随访1次,2年后每半年随访1次直至死亡或失访。随访时间为手术时间至事件发生或末次随访时间。局部区域复发定义为同侧乳房、腋窝、锁骨区或内乳区疾病复发,除上述部位外其他任何部位疾病复发均定义为远处转移。
1.5 统计学处理
本研究采用SPSS 22.0软件进行数据统计分析。对所有率进行直接计算。P<0.05为差异有统计学意义。
2 结 果
2.1 患者情况及治疗情况
自2015年1月—2016年8月,共入组358例患者,全乳大分割同期瘤床加量放疗总疗程中位时间为20 d(17~28 d),明显少于常规分割的5~6周时间。患者的基本信息及治疗情况见表1、2。
2.2 急性不良反应及美容效果
放疗期间及放疗后3个月内,53.6%和8.1%的患者出现Ⅰ~Ⅱ度的放射性皮炎,主要表现为放疗区红斑(38.8%)以及放疗后干性脱皮(41.3%)(图1)。13例(3.6%)患者出现湿性脱皮,主要位于乳头、乳晕区放疗期间,未见重要的骨髓抑制及肝肾功能损伤(表3)。165例患者在放疗后半年进行美容效果自评,37%和44.8%的患者自评为“极好”和“好”,总体满意率为81.8%。

表 1 患者基本治疗Tab. 1 Patients' characteristics[n(%)]

表 2 患者的治疗情况Tab. 2 Patients’ treatment information

表 3 全乳大分割放疗急性不良反应Tab. 3 Acute toxic effects of hypofractionated whole breast irradiation[n(%)]

图 1 放疗不良反应Fig. 1 Acute adverse reaction of irradiation
2.3 预后
中位随访期为28.3个月(6.0~40.7个月),2年无病生存率(disease-free survival,DFS)为98.6%。3例患者出现局部区域复发,局部区域复发率为0.8%。复发部位分别为同侧乳房、锁骨上淋巴引流区、内乳淋巴引流区(图2)。4例患者出现远处转移,其中两例合并局部区域复发,5例患者出现第二原发肿瘤甲状腺微乳头状癌。具体复发转移病例信息详见表4。

表 4 复发转移病例特点Tab. 4 Characteristics of patients with recurrence and distant metastasis
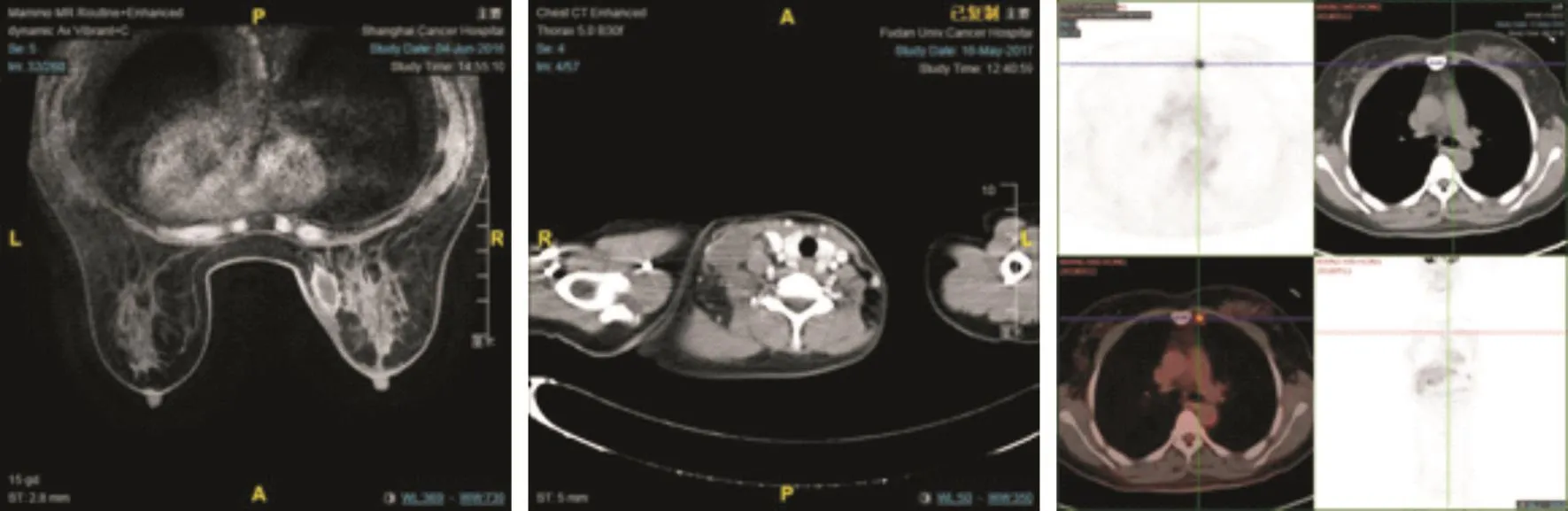
图 2 局部区域复发部位:乳房(右侧)、同侧锁骨区淋巴引流区(右侧)、同侧内乳淋巴引流区(左侧)复发Fig. 2 Locoregional recurrence:breast, ipsilateral supraclavicular, and ipsilateral internal mammary node areas
3 讨 论
本研究为前瞻性Ⅱ期临床试验,结果表明,全乳大分割同期瘤床加量放疗治疗周期短,不良反应轻,患者耐受性好,美容效果自评满意率较高,达到80%。中位随访期28个月,局部区域复发率仅0.8%,具有可靠的安全性和有效性。
早期RMH/GOC研究表明乳腺外形后期改变的α/β值为3.6 Gy, 乳腺组织硬化的α/β值为3.1 Gy,而后续的肿瘤局部控制的α/β值为4 Gy,这意味着乳腺癌对于分割剂量变化的敏感性与乳腺正常组织、肋骨及胸壁的敏感性相似[7-8]。低α/β值提示乳腺癌组织对大分割放疗更为敏感,为乳腺癌的大分割放疗提供了理论基础。早期的START A、B和加拿大的三项Ⅲ期临床试验均随访10年以上,10年局部区域复发率常规分割组分别为7.4%、5.5%和6.7%,大分割组分别为约6.3%、8.8%、4.3%和6.2%,差异无统计学意义(P>0.05)。生存率在START B研究中大分割组优于常规分割组(10年死亡率为15.9% vs 19.2%),进一步证实乳腺癌全乳大分割放疗的安全性及有效性[2-3]。
本研究与上述三项研究存在一定的差异[9-11]。从入组人群来看,本研究入组患者70%以上为未绝经的年轻乳腺癌患者,50岁以上患者仅占33.8%,而上述三项研究中50岁以上患者达到70%。从病理特点上看,中国乳腺癌患者有着较高的组织学分级,Ⅰ级仅为3.1%,Ⅱ级和Ⅲ级分别为43.6%、35.8%,恶性程度远高于上述三项研究中Ⅰ级为20%~35%,Ⅱ级为47.0%~49.9%,Ⅲ级为19%~28%。这也提示中国乳腺癌患者具有年轻化、恶性程度高的特点。在综合治疗上,本研究患者后续辅助化疗比例(62.3%)明显高于上述几项研究(10.9%~35.5%)。因此,基于中国乳腺癌患者的病情特点,乳腺癌保乳术后大分割放疗的安全性及有效性仍需更多的研究来证实。
对于浸润性乳腺癌保乳术后瘤床加量方式,2018年ASTRO指南指出年龄≤50岁;50~70岁肿瘤核分裂象为高级别或切缘阳性的患者推荐瘤床加量,不推荐年龄>70岁、激素受体阳性、核分裂象低中级别、切缘≥2 mm的患者接受瘤床加量,且加量方式为除了临床试验,常规推荐序贯加量[5]。上述三项大分割放疗研究中,瘤床加量比例不尽相同,START A和B研究中分别有60.6%和42.6%的患者接受了瘤床加量,但加拿大研究未进行瘤床加量。大分割放疗后瘤床是否加量,以及加量的方式,相关临床研究较少。正在进行的RTOG1005研究对比常规分割全乳50 Gy/25次序贯12 Gy/6次或14 Gy/7次瘤床加量和大分割全乳40 Gy/15次同期瘤床加量至48 Gy/15次,可能会为全乳大分割同期瘤床加量放疗提供新的证据。本研究作为单臂Ⅱ期临床研究,中位随访28.3个月,局部区域复发率低,仅为0.8%,远处转移率为1.1%。初步结果表明,在中国人群中,全乳大分割40 Gy/15次同步瘤床加量至48 Gy/15次的放疗方式是可接受的,但仍需长期随访来验证其对疾病的有效控制。
全乳大分割放疗的总剂量相对降低,可能会对正常组织的急性不良反应产生影响,但对于大分割放疗的急性不良反应研究报道较少。英国的FAST研究报道了327例患者的急性不良反应,其中大剂量分割组30 Gy/5次/5周、28.5 Gy/5次/5周患者出现湿性脱皮/中度水肿分别为2.7%、1.9%,明显低于常规分割组10.9%[12]。Jagsi等[13]对比了1 731例常规放疗和578例大分割放疗患者的急性不良反应,发现接受常规分割治疗的患者放疗皮肤反应明显高于大分割放疗患者。湿性脱皮发生率在常规分割组为28.5%,大分割组为6.6%(P<0.001)。Ⅱ度以上放射性皮炎分别为62.6%(常规)和27.4%(大分割)(P<0.001)。这提示大分割放疗不仅可以缩短放疗周期,与常规分割放疗有相似的疾病控制,还可以进一步降低放疗相关的急性不良反应。本研究湿性脱皮发生率为3.6%,Ⅱ度以上的放射性皮炎仅为8.1%,明显低于Jagsi等[13]的研究,这可能与人群、不同的放疗技术相关,但总体来看,大分割同期瘤床加量研究的急性不良反应较低,患者耐受性佳。
本研究尚存在不足:首先,本研究为前瞻性单臂Ⅱ期临床研究,缺乏常规分割的同期对照;其次,较大的分割剂量对正常组织的晚期反应影响较大,因此后续还应完成乳腺正常组织的晚期不良反应评估;此外,本研究中位随访时间不足3年,显然该治疗方式的有效性仍需长期随访来证实。
综上所述,在中国人群中,乳腺癌全乳大分割同期瘤床加量放疗急性不良反应轻,耐受性较好,局部区域复发率低,有很好的安全性及有效性,但晚期不良反应以及对疾病的有效控制仍需长期随访来证实。

