狼疮性肾炎生物标志物
张凯聪 张 丽 梁馨苓 审校
狼疮性肾炎(LN)是系统性红斑狼疮(SLE)累及肾脏所引起的一种免疫复合物性肾炎,是SLE主要的损伤脏器和死亡原因之一。早期诊断、有效治疗、及早发现复发是延缓LN进入终末期肾病的有效途径。肾活检是确诊及判断LN活动性的金标准,但操作具有风险,不易重复。因此,我们需要寻找具有以下特点的生物标志物:(1)能特异地反映SLE患者肾脏受累。(2)与肾脏病变活动性有关。(3)标本易获取,价格低廉,可用来连续监测肾脏病情。(4)可估测肾脏受累程度。(5)能反映治疗的效果[1]。本文将从基因、微小RNA(miRNA)、蛋白分子三个层面对近年来LN生物标志物研究进展进行。
基因相关的生物标志物
全基因组关联性研究(GWAS)可辨别出很多人类基因易感性位点[2]。随着基因分型技术的进步,我们可研究基因的多态性、个体多样性与LN之间的关系。北京协和医学院张昀等[3]研究表明中国汉族人群FcγRIIIA基因多态性与SLE的发病有关,FcγRIIIA基因的F等位基因频率约为60.8%,FF纯合子基因型可能对LN易感,VV纯合子基因型早期出现LN的风险较低,可能预示LN晚发。血管紧张素转换酶(ACE)通过血管紧张素Ⅱ影响血管及内皮细胞功能,在SLE发病中起关键作用。Hammad等[4]研究表明ACE基因的D等位基因和DD基因型是埃及儿童SLE易感和增殖性肾炎发生的危险因素。然而,Pitipakorn等[5]研究表明DD基因型不能作为泰国人群SLE和LN预后不良的指标。Xu等[6]对MHC区域进行全面测序分析,发现五个变异位点与LN发病相关:HLA-DRβ1氨基酸11、HLA-DQβ1氨基酸45、HLA-A氨基酸156、HLA-DPβ1氨基酸76、PRRC2A的错义突变(rs114580964),这些危险变异导致MHC Ⅰ类和Ⅱ类分子的异常肽链表达,蛋白功能异常。一项Meta分析研究显示MHC区域内的HLA-DR2(rs9271366)和HLA-DR3(rs2187668)与LN发病具有强关联性,MHC区域外的五个位点具有更强的相关性,其中最强的一个位点为rs1364989,位于染色体4q11-q13编码PDGFRA,LN患者肾脏PDGFRA的mRNA水平升高有意义[7]。在中国人群中,补体因子H(FH)基因变异型CC/CT基因型rs1061170与Ⅲ型LN的发生具有关联性,rs6677604-GG基因型与抗ds-DNA抗体阳性相关,而rs800292-TT基因型与循环中高补体C3水平相关,但这三个单核苷酸多态性的基因频率及基因型频率在LN患者与对照组间的差别没有统计学意义[8]。对患者的血液进行基因检测,发现易感基因将有助于LN的诊断和判断预后,但是基因标志物不因治疗而改变,故不能用来监测疾病的活动性[9]。
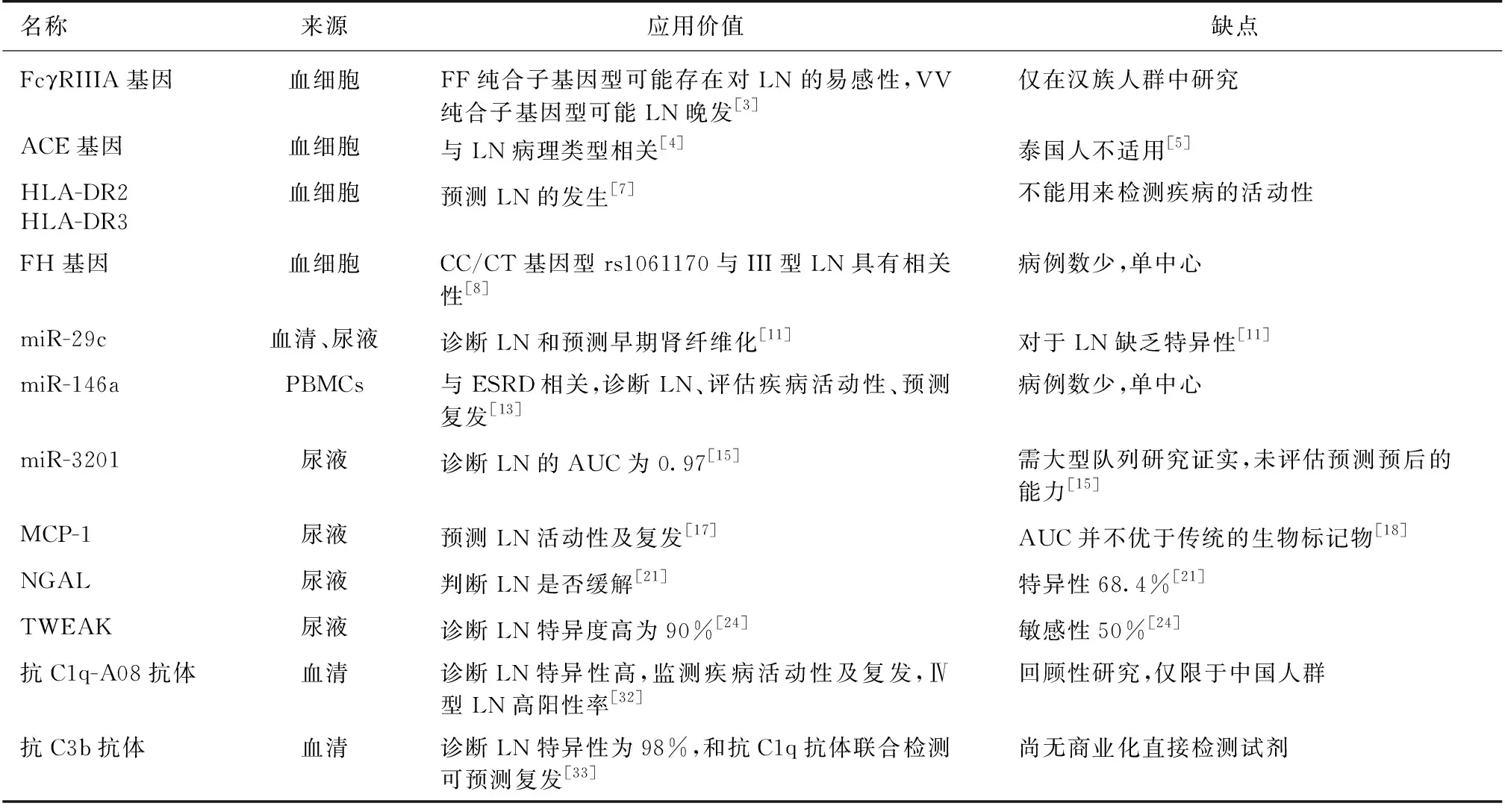
表1 新型LN生物标志物
LN:狼疮性肾炎;ACE:血管紧张素转换酶; FH:补体因子H;PBMCs:外周血单核细胞;ESRD:终末期肾病;AUC:ROC曲线下面积;MCP-1:单核细胞趋化蛋白1;NGAL:中性粒细胞明胶酶相关脂质运载蛋白;TWEAK:肿瘤坏死因子样凋亡微弱诱导剂
miRNA
miRNA是一类长约21~25 nt的单链小分子RNA,一般来源于染色体的非编码区,具有高度保守性,转录后对基因的表达进行负调控。近期研究表明,miRNA在肾脏病患者的肾组织、血清和尿液中表达异常,有望成为肾脏病的生物标记物[10]。李丹等[11]学者研究发现LN患者血清和尿液miR-29c的表达水平比对照组明显减低,并且肾活检时肾脏病理慢性(CI)评分越高miR-29c的表达水平越低,表明miR-29c可作为LN患者早期肾纤维化进展的一种新型生物标志物,在LN患者的辅助诊断和预后判断中具有一定的临床价值。肾活检肾组织中MiR-150的过表达可下调抗纤维化蛋白细胞信号转导抑制因子1(suppressor of cytokine signaling 1,SOCS1)和上调近端小管和系膜细胞的促纤维化因子,从而促进LN患者肾间质纤维化的进展[12]。外周血单核细胞中miR-146a诊断LN的ROC曲线下面积(AUC)为0.821,诊断LN活动的AUC 为0.872,miR-146a降低提示进入终末期肾病的可能性增加,且1年内可能出现LN复发[13]。一项大型研究发现血浆中有89个miRNA滴度在LN患者和健康对照者之间有差异,17个miRNA在有/无肾脏受累的SLE患者中存在显著的差异,有5个miRNA(miR-221-5p、miR-380-3p、miR-556-5p、miR-758-3p和miR-3074-3p)诊断LN的平均敏感度为97%、特异度为70.3%,阳性预测值为82.5%,阴性预测值为96%,诊断效率为87.9%[14]。研究表明LN患者尿液中miR-3201、miR-1273e出现下调,可用来区分LN和健康人AUC分别为0.97和0.91,同时与增殖性LN相关[15]。
众多研究显示多种miRNA与LN的诊断、预后、临床指标具有相关性,是一类具有潜力的生物标志物,但因miRNA性质不稳定,检测方法复杂等原因限制了其临床应用,相信随着生物技术的进步,miRNA的检测手段将越来越方便,miRNA将可用于临床。
尿液蛋白类生物标志物
单核细胞趋化蛋白-1(MCP-1) MCP-1属于趋化因子CC亚家族,由炎症介质刺激单核/巨噬细胞、肾固有细胞如肾小球系膜细胞、成纤维细胞合成和分泌,在肾脏广泛表达,与肾脏疾病的发生发展密切相关。研究显示拮抗MCP-1可改善LN和肾血管炎的启动和发展[16]。尿液MCP-1滴度与疾病活动性有很好的相关性,在肾脏病复燃前2~4个月可见尿液MCP-1水平升高,且发病过程保持高水平,对治疗有反应的患者尿液MCP-1在几个月内缓慢下降,而无应答者持续高水平,接受免疫抑制治疗后持续升高尿液MCP-1表明可能存在持续肾损伤[17]。一项研究表明血液和尿液MCP-1均能预测狼疮的活动性,只有尿液MCP-1能预测LN的活动性,但ROC曲线分析显示尿液MCP-1并不优于传统的生物标志物[18]。因此,需要更多研究来验证尿MCP-1是否是一个理想的、比传统标志物更优的生物标志物。
中性粒细胞明胶酶相关脂质运载蛋白(NGAL) NGAL可由中性粒细胞、肾小管上皮细胞分泌。众多研究认为NGAL是急性肾损伤的标志物,目前越来越多研究表明LN患者NGAL表达也会上调。研究报导,注射抗ds-DNA抗体的LN小鼠模型,肾组织的NGAL表达上调[19]。研究发现尿NGAL水平升高与儿童LN活动有关,随着治疗有效及疾病活动性降低,NGAL水平下降[20]。一项前瞻性多中心研究发现活动性LN患者6个月诱导治疗结束后检测其尿NGAL值,可以区分出完全缓解、部分缓解及无缓解患者,通过ROC曲线分析显示其诊断特异度比传统标志物(如血肌酐、尿蛋白、GFR)更优。当把尿NGAL界值定在28.08 ng/ml时,预测LN无缓解的敏感度为72.7%,特异度为68.4%[21]。Brunner等[22]研究发现诱导治疗6月后病情不缓解的LN患者,肾穿时尿NGAL水平较缓解者有增高趋势,且6月后病情不缓解者尿NGAL水平比缓解者高[22]。因此,尿NGAL有望成为一个可预测治疗反应的新型生物标志物。
肿瘤坏死因子样凋亡微弱诱导剂(TWEAK) TWEAK是肿瘤坏死因子超家族的成员之一,主要由单核/巨噬细胞分泌,与其受体成纤维细胞生长因子诱导早期反应蛋白14(Fibroblast growth factor inducible protein 14 ,Fn14) 结合诱导产生多种炎症介质,如MCP-1、干扰素诱导蛋白10(IP-10)。在肾脏固有细胞,如足细胞、肾小管上皮细胞、系膜细胞表面可见此受体。动物实验发现TWEAK与Fn14相互作用可能在LN的发病中起重要作用。Fnl4缺陷的SLE小鼠肾脏病变较轻,肾脏IgG沉积,IL-6、MCP-1、IP-10表达有所下降;LN小鼠经抗TWEAK抗体治疗后,IL-6、MCP-1、IL-10等在肾脏中的表达明显下调,蛋白尿减少[23]。Schwartz等[24]研究发现活动期LN患者尿液中TWEAK浓度高于稳定期患者,同时发现血、尿TWEAK浓度并无相关性,提示尿TWEAK并非由血液滤过排泄,而是反映了肾脏局部损伤。尿TWEAK在诊断SLE累及肾脏的敏感度为50%,特异度为90%。Xia等[25]研究发现,FN14基因敲除后的LN小鼠肾组织病理明显改善、肾小球和肾小管间质炎症好转,尿蛋白水平降低。因此,研究者认为TWEAK与Fn14在LN的发生发展中起了重要作用。阻断TWEAK/Fn14 轴也许是一个新的治疗方法。尿TWEAK诊断LN的特异度较高,但敏感度较低,深入机制研究可能推动治疗的进展。
血液蛋白类生物标志物
抗C1q抗体补体C1q是补体系统经典途径的第一个组分,在免疫复合物和凋亡小体的清除中起关键作用[26]。补体C1q功能缺陷导致凋亡小体清除能力下降及肾小球出现凋亡小体,从而介导自身免疫性疾病发生[27]。抗C1q抗体主要为IgG型抗体,抗C1q胶原样区(Collagen-like-region,CLR)抗体为LN的主要致病抗体[28]。抗C1q抗体可出现在多种自身免疫性疾病中,包括SLE。在SLE患者血液中出现抗C1q抗体与LN的发生有关联,实验研究显示抗C1q抗体与C1q结合仅沉积在有免疫复合物沉积的肾小球上才导致明显的肾损伤,这可用来解释SLE背景下患者出现抗C1q抗体提示出现了肾损伤[29]。Akhter等[30]研究表明抗C1q抗体滴度与改良的SELENA-SLEDAI评分、肾脏活动性评分呈正相关,肾损害加重时,75%患者抗C1q抗体滴度随之升高(P=0.006)。一项包括31个研究的Meta分析表明抗C1q抗体阳性诊断LN的特异度为73.5%,对应的敏感度为70.4%,区分LN是否活动的特异度为80%,对应的敏感度为75.7%,文章认为抗C1q仍不能提供足够的可信度来诊断LN[31]。Pang等[32]学者研究发现抗C1q-A08抗原表位抗体诊断LN的敏感度为73.5%,特异度为90.8%,AUC为0.754,在Ⅳ型LN,抗C1q-A08抗体的阳性率为74.4%,病情缓解时,所有抗C1q-A08抗体阳性病人转为阴性,缓解后复发时,抗A08抗体的阳转率较抗C1q抗体高。通过生存分析发现,抗C1q-A08抗体阳性是不良预后的危险因素,因此可预测LN患者的肾脏预后。目前已有大量的学者研究抗C1q抗体、抗C1qCLR抗体、抗C1q-A08抗体在LN诊断、监测疾病活动性、预测复发等的应用价值,抗C1q-A08抗体的诊断特异度最高,抗C1q-A08抗体是否能作为新型的LN生物标志物仍需更多的实验及更广泛的人群来验证。
抗C3b抗体补体C3b是补体活化级联反应的枢纽分子,启动三条补体途径共有的末端通路,形成膜攻击复合物导致细胞溶破,发挥细胞毒作用。补体C3b及其裂解产物iC3b为重要调理素,结合于细菌或其他颗粒物表面,促进吞噬细胞对其吞噬。补体C3b可与免疫复合物(IC)结合,促进巨噬细胞吞噬、清除,还可抑制IC形成、解离已形成的IC,具有清除IC的作用。C3b功能缺陷、数量异常可能会导致SLE等疾病的发生。研究表明抗C3b抗体诊断LN特异度为98%,随访期间,抗C3b抗体阳性与LN复发具有相关性(P<0.01),复发时其滴度有升高趋势,但无统计学意义(P=0.07),只有抗C3b抗体阳性的患者LN复发时,抗C1q的滴度升高有统计学意义(P=0.02),且复发前4~6月即可出现抗C1q滴度升高,因此联合检测抗C3b抗体和抗C1q抗体可预测LN复发[33]。抗C3b对LN的诊断具有特异性,阳性患者有复发的倾向,抗C3b有望成为诊断和预测LN复发的一个生物标志物,但敏感度低,仍需更多前瞻性研究进一步验证。
小结:LN的发生发展影响着SLE患者的预后。临床工作者希望能寻找新型生物标志物用于判断LN的发生及预后、辨别肾脏病理类型、监测活动性、预测治疗效果、指导药物选择。当前尽管发现了一系列新型的生物标志物,但尚无一种标志物能满足以上所有条件,多种生物标志物联合检测也许是未来一个发展方向。目前的标志物研究仍处于试验阶段,且多为回顾性研究,尚未大量应用于临床,因此需要更深入的研究来推动科研、临床、转化医学的发展。

