siRNA沉默CXCR4基因对胃癌生物学行为的影响*
陈建荣 朱光辉
上海市奉贤区中心医院普外科1(201499) 上海市公共卫生临床中心普外科2
背景:CXCR4在肿瘤细胞中广泛表达,参与肿瘤侵袭和转移。RNA干扰技术可有效降低或关闭基因的表达,从不同水平阻断肿瘤侵袭和转移。目的:研究胃癌组织中CXCR4 mRNA和蛋白表达及其与临床病理特征的关系,并探讨siRNA沉默CXCR4表达对胃癌生物学行为的影响。方法:选取86例胃癌及其癌旁正常黏膜组织,应用RT-PCR和蛋白质印迹法分别检测CXCR4 mRNA和蛋白表达,并分析其与临床病理特征的关系。构建CXCR4干扰RNA质粒载体,并转染胃癌MKN45细胞。应用MTT法、Transwell法、流式细胞术分别评估胃癌细胞增殖、迁移和侵袭、凋亡能力。结果:胃癌组织中CXCR4 mRNA和蛋白表达明显高于癌旁正常组织(P<0.05),且其表达与TNM分期、肿瘤分化、淋巴结转移相关(P<0.05)。与阴性对照组相比,siRNA转染组转染24、48、72 h后MKN45细胞增殖力均显著降低(P<0.05),迁移率和侵袭率均显著降低(P<0.05),细胞凋亡率显著升高(P<0.05)。结论:CXCR4在胃癌发展过程中具有重要作用;以siRNA沉默CXCR4基因后,可显著抑制MKN45细胞增殖,抑制体外细胞迁移和侵袭,促进细胞凋亡,从而为胃癌的治疗提供新策略。
全球范围内胃癌的发病率和死亡率均位居恶性肿瘤前列,尽管医疗技术不断进步,但胃癌致死率仍居高不下,已成为严重危害人类健康的公共卫生问题之一[1-2]。目前趋化因子及其受体在恶性肿瘤发生、发展中的机制已成为目前研究的热点。趋化因子受体4(CXCR4)属于趋化因子受体CXC亚家族,通过与基质细胞衍生因子-1(SDF-1)结合启动下游信号通路[3]。CXCR4在食管癌、结直肠癌、非小细胞肺癌等恶性肿瘤中高表达,可通过各种信号通路调控细胞增殖和凋亡,在肿瘤的发生、侵袭和转移中发挥重要作用[4-6]。但CXCR4在胃癌中的发病机制目前尚不十分清楚。本研究通过观察CXCR4在胃癌及其癌旁组织中的表达,分析其与临床病理特征之间的关系,并探讨siRNA沉默CXCR4基因对胃癌细胞株MKN45增殖、迁移、侵袭和凋亡的影响,旨在探讨CXCR4在胃癌发生、发展中的作用,从而为临床应用分子生物学技术治疗胃癌提供新的思路。
材料与方法
一、临床对象
选取2013年7月—2013年12月上海市奉贤区中心医院腹外科86例胃癌住院患者,诊断经术后病理检查确诊。其中男51例,女35例,年龄29~69岁,平均年龄(37.24±3.21)岁。肿瘤TNM分期和组织病理学分型依据世界卫生组织(WHO)制定的标准[7]。同时选取相应癌旁组织(距肿瘤边缘>5 cm 的正常胃黏膜组织)作为对照,取得标本后迅速放入液氮保存。所有患者临床病例资料完整,术前均未接受过放疗、化疗、靶向和生物治疗。本研究方案由上海市奉贤区中心医院伦理委员会批准通过。所有患者及其家属均取得知情同意。
二、研究方法
1. RT-PCR法检测CXCR4 mRNA表达:取适量胃癌及其相应癌旁正常组织,采用mRNA抽提和逆转录试剂盒(北京义翘神州科技有限公司),逆转录合成cDNA的第一链,行荧光定量PCR(Biomics Biotech),PCR产物行1%琼脂糖凝胶电泳,以2-ΔΔCt法计算CXCR4 mRNA相对表达量。
2. 蛋白质印迹法检测CXCR4蛋白表达:分别收集和裂解胃癌及其相应癌旁组织中的细胞,BCA法定量蛋白浓度(试剂盒购自北京索莱宝科技有限公司),行SDS-PAGE 凝胶电泳,以β-actin作为内参,加入一抗、二抗(购自北京中杉金桥生物技术有限公司,工作浓度分别为1∶10 000、1∶5 000)。ECL显影(北京中杉金桥生物技术有限公司)。
3. CXCR4-siRNA真核表达载体的构建和转染:人胃癌细胞株MKN45购自上海慧颖生物科技有限公司。CXCR4-siRNA片段由生工生物工程(上海)股份有限公司合成,上游:5’-ATG CAA GGC AGT CCA TGT CAT-3’;下游:5’-ATG AAT GTC CAC CTC GCT TT-3’。插入siRNA表达质粒 pSilencer3.1-HIneo(由北京义翘神州科技有限公司构建),转染大肠杆菌,大量扩增提纯后,转染胃癌细胞株MKN45(LipofectamineTM2000脂质体转染试剂盒购自Invitrogen公司),按照试剂说明书进行转染操作。转染72 h后,将保存正确的单克隆菌液接种于G418培养液(上海翊圣生物科技有限公司)继续培养24 h,筛选稳定转染的细胞株。设立阴性对照组片段,采用无关序列RNA进行转染。
4. MTT法检测细胞体外增殖能力:收集转染后的CXCR4-siRNA细胞,分别接种于96孔板中,使用逆向转染的方法同步转染CXCR4和阴性对照,培养24 h、48 h、72 h时,每孔加入50 μL MTT溶液(购自Sigma公司,5 mg/mL),置入孵箱温育3 h后吸出上清液,每孔加入150 μL DMSO,上平板床摇匀。于490 nm 波长处,应用酶标仪测定各孔吸光度(A)值,细胞抑制率(%)=(1-siRNA转染组A值/阴性对照组A值)×100%,每组设立6个复孔,取均值。
5. Transwell体外趋化侵袭实验:将转染24 h、48 h和72 h后的细胞制成单细胞悬液,取200 μL稀释好的单细胞悬液加入未铺胶的Transwell小室(Corning公司)的上室内,将600 μL含100 ng/mL SDF-1(美国PeproTech公司)的细胞培养液加入小室的下室内。置入培养箱培养24 h,评估细胞迁移情况。迁移率(%)=处理组细胞数/阴性对照组细胞数×100%。
将转染24 h、48 h和72 h后的单细胞悬液细胞密度设为1×105,在Transwell小室的上室铺好Martigel基质胶。倒置显微镜下随机计数6个视野,评估细胞侵袭情况。侵袭率(%)=处理组细胞数/阴性对照组细胞数×100%。
6. 细胞凋亡的检测:分别收集转染组和对照组MKN45细胞。根据Annexin FITC/PI双标记试剂盒说明书进行操作。APOI(凋亡细胞数/细胞计数总数)表示细胞凋亡情况。
三、统计学分析
结 果
一、CXCR4 mRNA和蛋白表达
胃癌组织中CXCR4 mRNA和蛋白表达均明显高于癌旁正常组织,差异均有统计学意义(P<0.05)(表1、图1)。
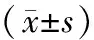
组别例数mRNA表达蛋白表达胃癌组织861.08±0.12∗0.61±0.05∗癌旁正常组织860.35±0.060.33±0.02
*与癌旁正常组织比较,P<0.05

1 Da=0.992 1 u
二、CXCR4 mRNA和蛋白表达与胃癌患者临床病理特征的关系
胃癌患者的性别、年龄、肿瘤大小与CXCR4 mRNA和蛋白表达均无关(P>0.05);随着临床TNM分期升高、肿瘤分化程度降低,CXCR4 mRNA和蛋白表达明显增加,差异均有统计学意义(P<0.05);伴有淋巴结转移的肿瘤组织中CXCR4 mRNA和蛋白表达明显高于不伴有淋巴结转移者,差异有统计学意义(P<0.05)(表2)。
三、MKN45细胞增殖能力的比较
转染CXCR4-siRNA后,与阴性对照组相比,转染组培养24、48、72 h的细胞增殖能力显著降低,差异均有统计学意义(P<0.05)。与培养0 h相比,siRNA转染组和阴性对照组培养24、 48、 72 h的细胞增殖能力均明显升高,差异均有统计学意义(P<0.05)(表3)。
四、MKN45细胞迁移、侵袭能力的比较
与阴性对照组相比,转染CXCR4-siRNA后MKN45细胞的迁移率和侵袭率均明显降低,差异有统计学意义(P<0.05)(表4、图2~3)。
五、细胞凋亡
MKN45细胞转染CXCR4-siRNA后,细胞凋亡较转染前明显增加,而阴性对照组转染后细胞凋亡无明显变化(P>0.05),且siRNA转染组细胞凋亡率明显高于阴性对照组,差异有统计学意义(P<0.05)(图4)。
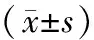
临床病理特征例数CXCR4mRNA表达P值CXCR4蛋白表达P值性别>0.05>0.05 男511.07±0.070.66±0.04 女351.11±0.090.59±0.03年龄>0.05>0.05 <60岁381.05±0.090.60±0.03 ≥60岁481.10±0.080.63±0.04肿瘤大小>0.05>0.05 <5 cm381.06±0.090.63±0.05 ≥5 cm481.10±1.020.59±0.03TNM分期<0.05<0.05 Ⅰ+Ⅱ360.89±0.060.51±0.04 Ⅲ+Ⅳ501.23±0.130.68±0.06分化程度<0.05<0.05 中-高分化450.89±0.070.52±0.03 低分化411.38±0.130.78±0.04淋巴结转移<0.05<0.05 无450.93±0.080.44±0.03 有411.33±0.090.76±0.06
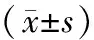
表3 两组培养24、48、72 h后MKN45细胞增殖能力的比较
*与同组0 h比较,P<0.05;#与同时间点阴性对照组比较,P<0.05

表4 两组细胞迁移和侵袭能力的比较(%)
*与阴性对照组比较,P<0.05

图2阴性对照组MKN45细胞迁移和侵袭能力(Trans-well法)

图3siRNA转染组MKN45细胞迁移和侵袭能力(Trans-well法)

图4 流式细胞仪检测转染48 h后MKN45细胞凋亡情况
讨 论
本研究结果显示,胃癌组织中CXCR4 mRNA和蛋白表达明显高于相应癌旁正常组织,其表达与肿瘤TNM分期、分化程度和淋巴结转移相关,即肿瘤恶性程度和临床分期越高,CXCR4 mRNA和蛋白表达水平越高,伴有淋巴结转移的肿瘤组织CXCR4 mRNA和蛋白表达明显高于无淋巴结转移的肿瘤组织,提示CXCR4可能在一定程度上调控癌细胞行为,抑制肿瘤细胞凋亡,从而促进胃癌的发生、发展、侵袭和转移。
胃癌的发生是一个多基因、多阶段、多途径共同作用的结果,细胞有丝分裂和凋亡、上皮-间质转化、血管内皮细胞增殖和侵袭、耐药相关基因表达异常与胃癌的发生有关。目前我国发现的约90%的胃癌属于进展期[8],恶性肿瘤的高度侵袭性和早期发生远处转移是绝大多数胃癌患者死亡的原因。
RNA干扰技术可有效诱导基因沉默,改变与肿瘤侵袭和转移相关基因的表达,特异性阻断肿瘤转移,为研究基因调控的一种新手段[9]。相关研究[10]表明,CXCR4在胃癌组织中选择性高表达,并与临床分期、病理程度、淋巴结转移有关,推测CXCR4在胃癌的增殖、侵袭和转移中发挥重要作用,但具体机制还有待进一步研究。据文献报道,CXCR4有促进肿瘤生长、侵袭、转移的作用[11]。为进一步研究CXCR4是否介导胃癌的侵袭和转移,本研究人工合成CXCR4-siRNA片段,以siRNA靶向沉默CXCR4基因并转染胃癌细胞MKN45,结果显示,与阴性对照组相比,沉默CXCR4基因可明显抑制MKN45细胞增殖,抑制细胞迁移和侵袭,并促进细胞凋亡。研究[12]显示,CXCR4-siRNA能减缓G0/G1期细胞进入增殖周期,抑制细胞分裂增殖,促进细胞凋亡。国内有研究[13]显示,腺病毒表达载体通过基因沉默机制抑制CXCR4基因的表达,能有效抑制胃癌细胞SGC7901侵袭和增殖能力,在一定程度上抑制胃癌细胞的转移。
总之,本研究发现CXCR4在胃癌组织中的高表达可能参与了胃癌的发生、发展、侵袭和转移进程,成功构建了CXCR4-siRNA真核表达载体并转染胃癌细胞株MKN45,沉默CXCR4基因可抑制胃癌细胞MKN45增殖、侵袭能力,并诱导其凋亡,有望为胃癌的治疗提供新的策略和靶点。但本实验为体外实验验证沉默CXCR4基因对控制胃癌细胞的转移,期待后续研究模拟人体内环境行进一步探讨。

