CBX3表达在结直肠癌中的临床意义及其机制探索*
徐浒东 严婷婷 艾罗燕 周 超 王 争 汤佳音#
上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所1(200001)上海交通大学医学院附属仁济医院胃肠外科2
背景:CBX3属于异染色质蛋白家族成员之一,近年研究发现CBX3与肺癌、骨肉瘤、胃癌等多种人类癌症密切相关。目的:探讨CBX3在结直肠癌中的表达及其临床意义,并探索可能的作用机制。方法:选取2011年6月—2012年6月上海交通大学医学院附属仁济医院30例结直肠癌组织及其相应癌旁正常组织。以实时定量PCR和免疫组化法分别检测CBX3 mRNA和蛋白表达。将CBX3过表达质粒和CBX3 siRNA转染人结直肠癌细胞株RKO,以CCK-8法检测细胞增殖,蛋白质印迹法检测CBX3、p53蛋白表达。结果:结直肠癌组织中CBX3 mRNA和蛋白表达均显著高于相应癌旁正常组织,且CBX3蛋白表达与肿瘤大小(P=0.025)、淋巴结转移(P=0.013)和TNM分期(P=0.020)相关。过表达CBX3可有效上调RKO细胞中CBX3 mRNA和蛋白表达,促进细胞增殖,同时上调p53蛋白表达;敲低CBX3可有效下调CBX3 mRNA和蛋白表达,抑制细胞增殖,同时下调p53蛋白表达。结论:CBX3可能通过影响p53表达来促进结直肠癌细胞增殖,进而影响结直肠癌疾病进程,提示CBX3有望成为诊断和治疗结直肠癌的新靶点。
结直肠癌是目前全球第三大常见的恶性肿瘤,2012年全球结直肠癌新发病例超过136万,位居所有恶性肿瘤的第3位(其中男性位居第3位,女性位居第2位),死亡人数超过69万,位居第4位(其中男性位居第4位,女性位居第3位)[1]。随着生活水平的提高和膳食结构的改变,我国结直肠癌的发病率和死亡率也呈逐年上升的趋势[2]。对2012年全国恶性肿瘤发病和死亡的分析发现,结直肠癌发病率位居第4位(其中男性位居第5位,女性位居第3位),死亡率位居第5位(其中男性位居第5位,女性位居第4位)[3]。结直肠癌的发生、发展涉及多种基因调控失常和信号通路转导异常,其机制一直是研究的热点,对结直肠癌的治疗和预后具有重要的指导意义。
染色盒3(chromobox 3, CBX3)属于异染色质蛋白家族成员之一,其染色质结构域能在组蛋白甲基转移酶uv339H1的协助下识别甲基化组蛋白H3K9,从而调控基因的表达[4-6]。CBX3与甲基化H3K9结合能招募各种协同因子参与细胞内多种生物学过程,包括端粒代谢、DNA损伤修复、RNA剪接、转录延伸、转录抑制和激活等[7-10]。近年研究发现CBX3与肺癌、舌癌、骨肉瘤、前列腺癌等多种人类癌症密切相关[11-14],但具体的分子机制目前尚不清楚。
p53是迄今发现与人类肿瘤相关性最高也是最重要的基因。野生型p53是一种抑癌基因,编码的p53蛋白是一种转录因子,可控制细胞周期的启动,对细胞分裂起减慢或监视的作用,如细胞受损而又未得到修复,p53将诱导细胞凋亡[15-18]。
本研究通过检测结直肠癌患者中CBX3表达,并以CBX3过表达质粒和siRNA转染人结直肠癌细胞株RKO(RKO为p53野生型细胞株),检测细胞增殖情况以及p53蛋白表达,旨在探讨CBX3在结直肠癌中的可能作用机制,从而为结直肠癌的诊断和治疗提供一定的理论依据。
材料与方法
一、研究对象
选取2011年6月—2012年6月上海交通大学医学院附属仁济医院30例结直肠癌患者,诊断经术后病理检查证实。同时选取距病变边缘5 cm以上的癌旁组织作为对照。其中男17例,女13例;年龄31~90岁,平均67岁;肿瘤长径<5 cm者12例,≥5 cm者18例;中-高分化5例,低分化25例;根据美国癌症联合委员会(AJCC)TNM分期,Ⅰ~Ⅱ期20例,Ⅲ~Ⅳ期10例;浸润局限于黏膜层或肌层者5例,浆膜或全层者25例;有淋巴结转移8例,无淋巴结转移22例;有远处转移2例,无远处转移28例。入选者住院前未接受过手术、放化疗或免疫抑制剂治疗。所有入选者均取得知情同意,本研究方案通过上海交通大学医学院附属仁济医院伦理委员会的审批。
二、主要仪器和材料
实时荧光定量PCR仪(ABI公司);RNAiso Plus总RNA提取试剂、逆转录试剂盒和Real-Time PCR试剂盒(日本TaKaRa公司);CBX3特异性引物由生工生物工程(上海)股份有限公司合成(序列见表1);人结直肠癌细胞株RKO(ATCC);DMEM培养基(美国Gibco公司);胎牛血清(美国Gibco公司);CBX3 siRNA(由上海吉玛制药技术有限公司构建)(序 列见表1);FuGENE HD转染试剂(美国Promega);DharmaFECT 1转染试剂(美国GE Healthcare);CCK-8试剂盒(日本株式会社同仁化学研究所);RIPA蛋白裂解液(美国Thermo Fisher Scientific);CBX3抗体(美国Proteintech公司)、p53抗体(美国Santa Cruz公司)、GAPDH抗体(美国Cell Signaling Technology公司)、HRP标记的IgG抗体(美国Cell Signaling Technology公司);ECL发光试剂盒(美国Thermo Fisher Scientific)。

表1 CBX3序列
三、研究方法
1. 实时定量PCR法:取结肠组织充分研磨后裂解细胞,提取RNA,逆转录合成cDNA。行实时PCR,具体步骤参照试剂盒说明书进行。以2-△△Ct法计算样本目的基因mRNA相对表达量,每组设立3个复孔。
2. 免疫组化染色法:将组织切片以3% H2O2处理15 min,消除内源性过氧化物酶活性;以PBS微波加热修复抗原15 min后自然冷却至室温;滴加非免疫性羊血清,室温封闭30 min;滴加CBX3抗体(工作浓度为1∶200),4 ℃湿盒过夜后复温 30 min,PBS漂洗3次;滴加HRP标记的二抗,DAB显色,苏木精复染,自然晾干后中性树胶封片。
结果判断:光学显微镜下,细胞质呈淡黄色或黄褐色颗粒定义为阳性细胞。采用Formwitz半定量积分法。于200倍视野下随机观察5个视野,计数阳性细胞,并观察染色强度。阳性细胞率:≤5%,0分;6%~25%,1分;26%~50%,2分;51%~75%,3分;>75%,4分。染色强度:无染色,0分;淡黄色,1分;黄色,2分;黄褐色,3分。两项评分之积为染色总分:0分为阴性(-),1~4分为弱阳性(+),5~8分为中等阳性(++),9~12分为强阳性(+++)。阴性和弱阳性为低表达,中等阳性和强阳性为高表达。采用双盲法由两名医师独立评分,不一致时取均值。
3. 细胞培养和转染:将RKO细胞培养于含10%胎牛血清的DMEM完全培养基中,培养至对数生长期后,以2×105个/孔的密度接种于6孔板。待细胞贴壁后进行转染。具体操作步骤参照FuGENE HD和DharmaFECT 1转染试剂说明书进行,转染后继续孵育24~72 h。
4. 细胞增殖实验:RKO细胞按2 500个/孔的密度接种于96孔板上,每组设6个复孔,待细胞贴壁后转染。分别于培养24 h、48 h、72 h、96 h后加入CCK-8试剂(以无血清培养基按照1∶10的体积比稀释)。使用酶标仪读取450 nm波长处的吸光度(A)值,绘制细胞增殖图。
5. 蛋白质印迹法:RKO细胞转染CBX3 siRNA 48~72 h后,收集细胞,以预冷的PBS洗涤,加入蛋白裂解液裂解10 min,4 ℃ 12 000 r/min离心10 min,取上清,BCA法定量蛋白浓度。取40 μg总蛋白上样,行10% SDS-PAGE电泳分离后转移至NC膜,经5%脱脂奶粉封闭1 h。分别加入CBX3、p53、GAPDH一抗(工作浓度分别为1∶1 000、1∶500、1∶2 000)4 ℃孵育过夜。TBST洗膜5 min×5次,加入二抗(工作浓度1∶3 000),常温孵育1 h。计算目的蛋白的相对表达量。
四、统计学分析
结 果
一、结直肠癌患者中CBX3表达及其与临床病理特征的关系
在30例结直肠癌患者中,实时定量PCR结果显示结直肠癌组织中CBX3 mRNA表达显著高于癌旁正常组织(P<0.001)(图1A),免疫组化结果显示结直肠癌组织中CBX3蛋白表达显著高于相应癌旁正常组织(P<0.001)(图1B、图2)。CBX3蛋白高表达与肿瘤大小(P=0.025)、淋巴结转移(P=0.013)和TNM分期(P=0.020)相关,而与患者的性别、年龄、分化程度、浸润深度和远处转移无关(P>0.05)(表2)。
二、RKO细胞中CBX3 mRNA和蛋白表达
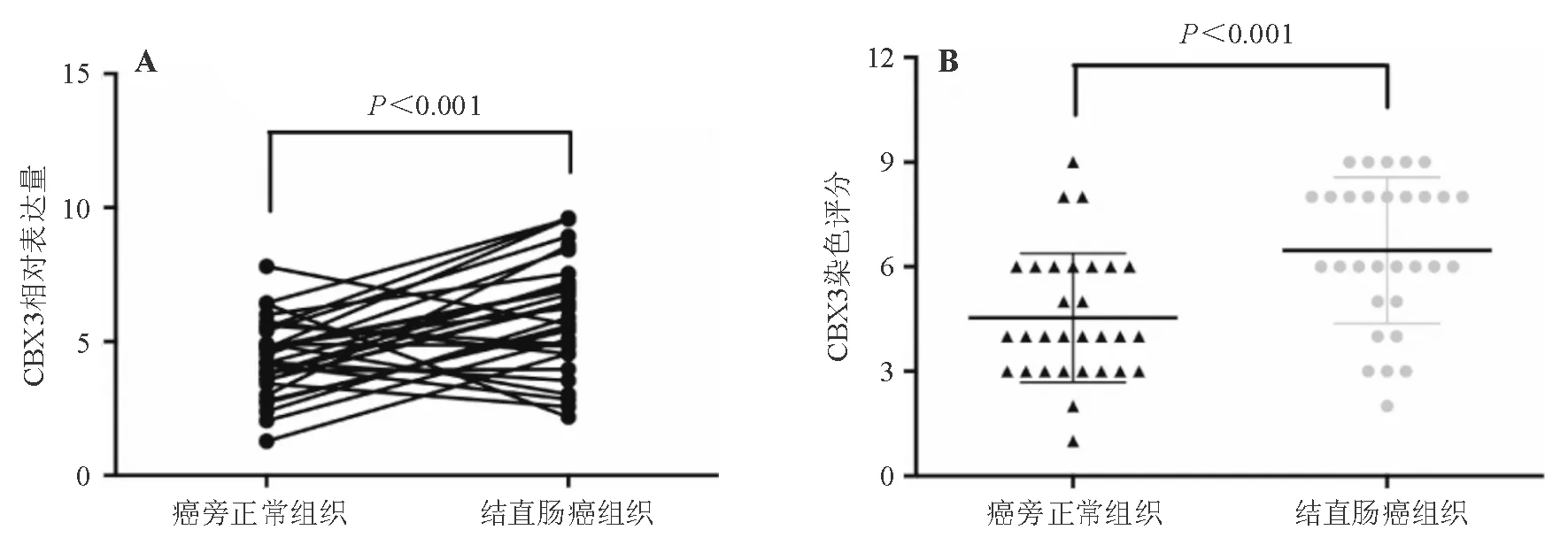
A:mRNA相对表达量(实时定量PCR法);B:蛋白表达(免疫组化评分)
表2结直肠癌患者中CBX3蛋白表达与临床病理特征的关系(n)

临床病理例数CBX3表达高(n=15)低(n=15)P值性别 男171070.269 女1358年龄(岁) <6513580.269 ≥6517107肿瘤大小(cm) <512390.025 ≥518126分化程度 中-高分化5320.624 低分化251213浸润深度 T1~T25230.624 T3~T4251312淋巴结转移 N0228140.013 N1~N2871远处转移 M02814141.000 M1211TNM分期 Ⅰ~Ⅱ207130.020 Ⅲ~Ⅳ1082
实时定量PCR结果显示,以质粒过表达CBX3后,其mRNA表达显著增高;以siRNA敲低CBX3后, 其mRNA表达显著降低(图3)。蛋白质印迹法亦显示过表达或敲低CBX3表达后,CBX3蛋白表达显著增高或降低(图4)。提示过表达质粒和siRNA可有效调控RKO细胞中CBX3 mRNA和蛋白表达。

1 Da=0.992 1 u
图4过表达和敲低CBX3表达后RKO细胞中CBX3和p53蛋白表达变化(蛋白质印迹法)
三、CBX3对RKO细胞增殖的影响
与对照组相比,过表达CBX3可促进RKO细胞增殖,敲低CBX3表达可抑制RKO细胞增殖,差异均有统计学意义(P<0.01)(图5)。说明CBX3能影响结直肠癌细胞的增殖能力。
四、CBX3对p53表达的影响
蛋白质印迹法结果显示,转染72 h后,过表达CBX3的RKO细胞中p53蛋白表达较对照组显著降低;敲低CBX3表达后,RKO细胞中p53蛋白表达较对照组显著升高(图4)。说明CBX3对p53蛋白表达有一定的调控作用。
讨 论
作为异染色质蛋白家族成员,CBX3能结合基因启动子区2甲基化或3甲基化的H3K9,从而起沉默基因的作用[19]。有文献报道CBX3可负调控p53下游的p21基因,从而促进肿瘤生长[20]。目前尚不清楚CBX3对p53是否具有调控作用。p53自1979年被首次报道以来,已被认为是最重要的肿瘤抑制基因之一,对细胞生长、凋亡和 DNA 修复起调控作用[21]。但起初p53一度被认为是癌基因,随着研究的不断深入,发现其在人类50%以上的肿瘤组织中均发生突变,突变后由于其空间构象发生了改变,失去了应有的抑癌功能,故由抑癌基因转变为癌基因[22-24]。有鉴于此,本研究选用RKO细胞株进行实验,其是p53野生型结直肠癌细胞株。

图2 结直肠癌和癌旁正常组织中CBX3蛋白表达(免疫组化染色,×200)

图3 过表达和敲低CBX3表达后RKO细胞中CBX3 mRNA表达变化(实时定量PCR法)
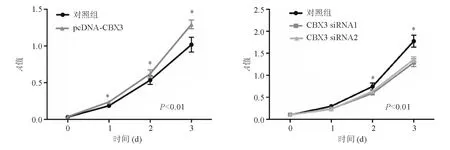
图5 过表达和敲低CBX3后RKO细胞增殖情况(CCK-8法)
本研究检测了30例结直肠癌患者中CBX3的表达,发现癌组织中CBX3 mRNA和蛋白表达均明显高于癌旁正常组织,且蛋白表达与肿瘤大小、淋巴结转移和TNM分期相关(P<0.05)。提示CBX3表达可能与结直肠癌患者的恶性程度有关。但本研究样本量偏少,可能存在一定的偏倚,未来需行大样本、多中心临床研究进一步证实。此外,本研究未对结直肠癌患者的生存情况进行随访,因此无法明确CBX3表达能否预测患者的预后以及是否能作为预测预后的独立影响因素。本研究进一步将CBX3过表达质粒和siRNA转染人结直肠癌细胞株RKO,发现其能明显促进或抑制细胞增殖能力,下调或上调p53蛋白表达,从细胞生物学的角度支持了CBX3表达与肿瘤大小等相关的临床意义。但本课题尚未进行动物实验,无法明确体内复杂的微环境是否会对CBX3的作用产生一定的影响,仍需进一步研究证实。
综上所述,结直肠癌患者CBX3表达水平升高,且与肿瘤大小、淋巴结转移和TNM分期相关,可能在结直肠癌的发生、发展中起有一定的作用。CBX3发挥作用的机制可能是通过调控野生型p53表达而实现的,因此有望成为诊断和治疗结直肠癌的新靶点。

