闭锁蛋白和闭锁小带蛋白在慢性胃炎组织中的表达和意义
陈 俊 张 慧 张琼慧 李俊红 徐桂涛 徐卫华
湖北孝昌县第一人民医院消化内科(432900)
背景:慢性胃炎发病的过程中,生物因子的改变可影响胃黏膜的生理屏障,增加细胞间连接的损伤风险,导致黏膜上皮屏障破坏。目的:探讨闭锁蛋白(occludin)、闭锁小带蛋白-1(ZO-1)在慢性胃炎组织中的表达和意义。方法:选取2014年10月—2017年10月于孝昌县第一人民医院就诊的慢性胃炎患者82例,根据内镜活检病理结果分为慢性非萎缩性胃炎(CNAG)组和慢性萎缩性胃炎(CAG)组,选取同期健康志愿者40名作为正常对照组。采用免疫组化方法检测胃黏膜组织occludin、ZO-1表达。幽门螺杆菌(Hp)阳性患者给予Hp根除治疗,转阴者复查occludin、ZO-1表达。结果:CNAG、CAG组occludin、ZO-1蛋白阳性表达率显著低于正常对照组(P<0.05);CNAG组occludin、ZO-1蛋白阳性表达率显著高于CAG组(P<0.05)。CNAG Hp阳性组occludin、ZO-1蛋白阳性表达率显著低于Hp阴性组(P<0.05);CAG Hp阳性组ZO-1蛋白阳性表达率显著低于Hp阴性组(P<0.05)。Occludin、 ZO-1蛋白表达与胃黏膜炎症活动度呈线性趋势关系(P<0.05),随着炎症活动度的增加,两者表达显著减弱。CNAG Hp阳性患者转阴后,occludin、ZO-1蛋白阳性表达率较根除治疗前显著升高(P<0.05)。结论:Occludin、ZO-1在慢性胃炎组织尤其是CAG中表达减弱。两者表达与Hp感染以及胃炎活动度之间存在一定联系。
慢性胃炎发病的过程中,生物因子的改变可影响胃黏膜的生理屏障,增加细胞间连接的损伤风险,导致黏膜上皮屏障破坏。闭锁蛋白(occludin)是重要的细胞跨膜成分,作为细胞间紧密连接蛋白之一,参与细胞屏障功能和维持细胞极性。闭锁小带蛋白-1(zonula occluden-1, ZO-1)则是紧密连接的骨架成分,可连接occludin与细胞内骨架蛋白,在紧密连接与细胞内成分相连中起桥梁作用[1]。本研究通过检测occludin、ZO-1在慢性萎缩性胃炎(CAG) 、慢性非萎缩性胃炎(CNAG)患者胃黏膜组织中的表达,旨在为慢性胃炎的临床诊治提供理论依据。
对象与方法
一、研究对象
选取2014年10月—2017年10月于湖北孝昌县第一人民医院就诊的慢性胃炎患者82例,根据内镜活检病理结果分为CNAG组和CAG组。纳入标准:①经电子胃镜检查确诊;②入组前3个月内未服用非甾体消炎药、抗菌药物、铋剂;③经快速尿素酶试验(RUT)明确幽门螺杆菌(Hp)感染状态。排除标准:①胃大部切除术史;②活动性上消化道出血、严重心肺疾病、消化道穿孔等疾病;③无法耐受胃镜检查。选取40名同期健康志愿者作为正常对照组。根据RUT结果进一步将CNAG、CAG患者分别分为Hp阳性组和阴性组。研究方案经湖北孝昌县第一人民医院伦理委员会批准,入组者均签属知情同意书。
二、方法
1. 免疫组化染色:胃黏膜内镜活检标本石蜡切片脱蜡至水,反复洗涤,加入牛奶液体封闭5 min,加入occludin、ZO-1 抗体(Abcam公司,滴度均为1∶1 000), 37 ℃孵育2 h,PBS洗涤3次,加入荧光标记的二抗(Abcam公司),37 ℃ 孵育 30 min,PBS洗涤,DAB显色,封片,光学显微镜下观察。以PBS代替一抗作为阴性对照。
结果判断:Occludin、ZO-1阳性表达定位于细胞膜,阳性细胞比例<5%为0分,5%~25%为1分,25%~50%为2分,50%~75%为3分,≥76%为4分;无染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。总分为阳性细胞比例评分与染色强度评分的乘积,≤6分为阴性表达,≥7分为阳性表达。
2. 胃黏膜炎症活动度分级:参照《中国慢性胃炎共识意见(2006,上海)》中的标准进行分级[2]。
3. Hp根除治疗:对Hp阳性患者给予Hp根除治疗(铋剂四联疗法)。治疗结束后4~6周行13C-尿素呼气试验,CNAG组Hp转阴患者复查胃黏膜occludin、ZO-1表达。
三、统计学分析
结 果
一、 一般情况
82例患者中CNAG组44例,其中男27例,女17例,年龄30~69岁 ,平均(55.0±9.2)岁;CAG组38例,其中男20例,女18例,年龄29~70岁 ,平均(54.8±8.4)岁。正常对照组40例,其中男25例,女15例,年龄30~70岁 ,平均(55.1±9.1)岁。三组间性别构成、年龄差异无统计学意义(P>0.05)。
二、CNAG、CAG患者occludin、ZO-1蛋白表达情况
CNAG、CAG组occludin、ZO-1蛋白阳性表达率显著低于正常对照组(P<0.05);CNAG组occludin、ZO-1蛋白阳性表达率显著高于CAG组(P<0.05)(表1)。
三、Hp阳性与阴性CNAG、CAG患者occludin、ZO-1蛋白表达情况
CNAG患者中Hp阳性21例,Hp阴性23例。Hp阳性组occludin、ZO-1蛋白阳性表达率显著低于Hp阴性组(P<0.05)(表2)。
CAG患者中Hp阳性17例,Hp阴性21例。Hp阳性组ZO-1蛋白阳性表达率显著低于Hp阴性组(P<0.05);两组间occludin蛋白阳性表达率差异无统计学意义(P>0.05)(表2)。
四、不同炎症活动度患者occludin、ZO-1蛋白表达情况
82例患者occludin、 ZO-1蛋白表达与胃黏膜炎症活动度呈线性趋势关系(P<0.05),随着炎症活动度的增加,occludin、ZO-1蛋白表达显著减弱(表3)。
五、Hp阳性转阴后occludin、ZO-1蛋白表达比较
21例CNAG组Hp阳性患者均成功根除Hp,根除治疗后occludin、ZO-1蛋白阳性表达率较根除治疗前显著升高(P<0.05)(表4)。
讨 论
胃黏膜上皮慢性损伤和代偿性修复过程可引起腺上皮细胞生理功能退化,导致黏膜变薄,间质成分减少[2]。紧密连接、黏附连接、缝隙连接、桥粒等是胃黏膜上皮细胞间的主要连接方式,其结构中包含多种细胞骨架成分,后者可保护胃壁或胃腺体细胞,避免其发生萎缩性变化。Occludin除作为细胞间紧密连接的重要组分,还能促进胃腺体细胞间质成分持续性增生,降低炎症细胞对胃上皮基底膜的渗透,以及抑制胃腺体、间质成分的代偿性纤维化。ZO-1则通过形成细胞桥接蛋白成分,提高细胞间连接的紧密程度。
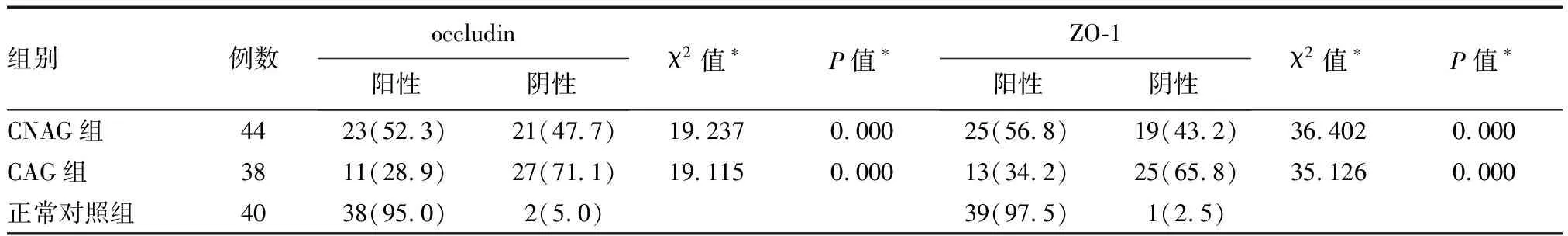
表1 CNAG、CAG患者occludin、ZO-1蛋白表达比较n(%)
*与正常对照组比较
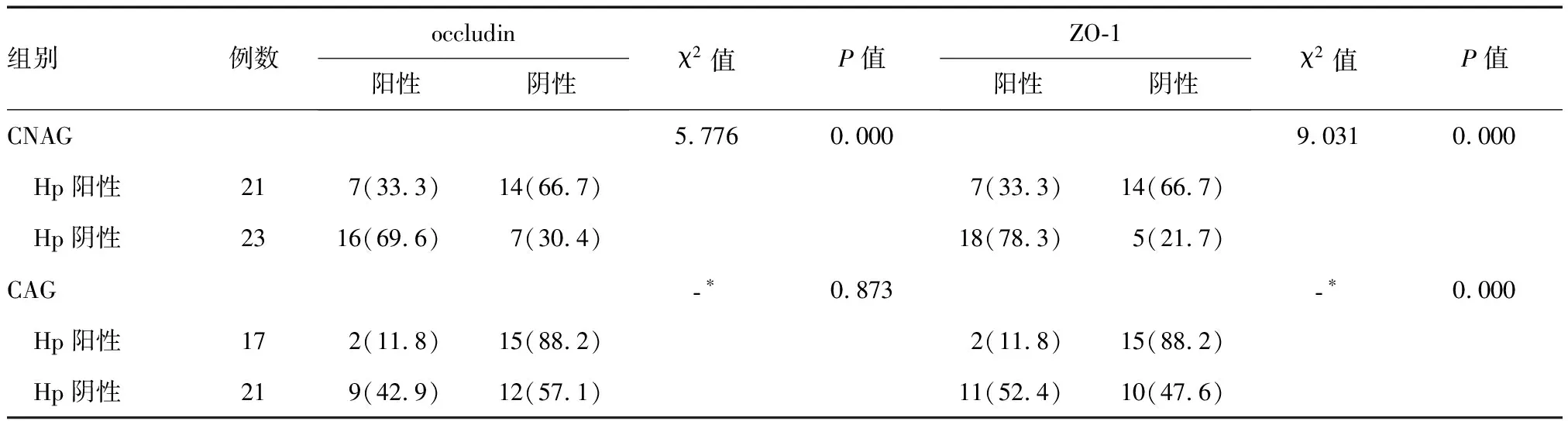
表2 Hp阳性与阴性CNAG、CAG患者occludin、ZO-1蛋白表达比较n(%)
*Fisher精确检验

表3 不同炎症活动度患者occludin、ZO-1蛋白表达n(%)

表4 Hp阳性转阴患者occludin、ZO-1蛋白表达变化n(%)
本研究发现,在CNAG、CAG患者的炎症黏膜组织中, occludin、ZO-1表达显著下降,提示两者表达缺失可能参与了慢性胃炎的发生过程。Occludin、ZO-1低表达可能通过下述几个方面发挥作用:occludin低表达降低细胞间的物理性连接力度,细胞间质成分分解增加,促进黏膜上皮萎缩;ZO-1表达下降可直接影响细胞间连接的数量,导致上皮细胞基底膜直接暴露于Hp、胆汁等刺激因素下。本研究结果显示,在CNAG伴Hp感染患者的胃黏膜组织中,occludin、 ZO-1表达均明显下降,显著低于不伴Hp感染的患者。Hp感染对occludin、ZO-1的影响可能与其分泌的尿素酶、CagA、VacA等致病因子的破坏作用有关[3-4]。本组Hp阳性CAG患者的occludin无上述改变,考虑可能与样本量偏小导致的偏倚有关,亦可能与免疫组化染色过程中的操作误差有关。此外,本研究发现,随着胃黏膜炎症活动度的增加,occludin、ZO-1表达明显减弱。炎症反应对两者表达的影响,可能与单核细胞、巨噬细胞等对黏膜屏障的损伤作用有关。Hp阳性转阴后,CNAG患者occludin、ZO-1阳性表达率较根除治疗前显著升高,与国内樊叶等[5]的研究发现相一致,进一步证实occludin、ZO-1表达与Hp感染之间存在一定联系,但具体机制尚未明确,有待探讨。
综上所述,本研究分析了occludin、ZO-1的表达与慢性胃炎伴Hp感染以及炎症活动度的关系。Occludin、ZO-1在慢性胃炎组织中表达减弱,尤其是在CAG中表达降低更为明显。此外,occludin、ZO-1表达与Hp感染以及胃炎活动度之间存在一定联系。进一步对相关内容进行研究,有望为探索慢性胃炎的治疗提供新方向。

