冷冻保存对人类精子线粒体DNA的影响
傅龙龙,周芳,安琪,张开舒,童越,许剑锋,王晓尉,郭颖,李鸿,袁冬,卢文红,梁小薇,谷翊群
(1.国家卫生计生委科学技术研究所 国家卫生计生委男性生殖健康重点实验室 男性临床研究室/北京人类精子库,北京 100081;2.北京协和医学院研究生院,北京 100730;3.青岛大学附属医院生殖中心,青岛 266000)
线粒体是精子内除细胞核以外,唯一携带遗传物质的细胞器;与细胞核的遗传系统构成了一个整体。线粒体DNA(mitochondrion DNA,mtDNA)是一条双链环状的DNA,共含有16 569个碱基对,有自己的遗传系统和自己的蛋白质翻译系统,且部分遗传密码与核密码有不同的编码含义。人类线粒体基因组共编码了37个基因,编码13 种蛋白质,22种tRNA和2种rRNA[1]。这13种蛋白质与核DNA编码蛋白参与线粒体氧化磷酸化,是机体提供能量和物质代谢的重要基础。随着mtDNA研究的不断深入,mtDNA成为衡量线粒体功能的重要生物标记物[2];研究者在异常精液中发现mtDNA突变与缺失[3-5]与男性不育、精液质量下降等生殖相关疾病密切相关。
精液冷冻是辅助生殖技术发展的重要保障:为中重度少弱精子症男性进行精液冻存,用于后期辅助生殖;冻存志愿者精液,为男方无精子症夫妇提供精子;为放化疗前肿瘤患者、输精管绝育术前患者、移植患者等进行自体精液保存,保存生育力[6]。精子冷冻损伤是精子冷冻和复苏过程中,由于渗透压改变、细胞内外冰晶形成、冷冻保护剂的毒性等因素,不可避免的都会发生一些物理和化学损伤。冷冻复苏过程会降低精子质量[7-8]:活力下降、受孕率减少,顶体完整性降低,精子线粒体膜电位降低。冷冻损伤是否会引起mtDNA水平的破坏,从而降低精子相关功能?本研究观察冷冻保存前后人精子线粒体mtDNA拷贝数和完整性的变化。
资料与方法
一、研究对象和分组
1.精液样本收集:本研究得到国家卫生计生委科学技术研究所伦理委员会通过,所有志愿者签署知情同意书。标本来源于北京人类精子库捐精志愿者,禁欲5~7 d后,手淫法取精留存于消毒干燥取精杯中,置于37℃水浴完全液化后,按照世界卫生组织操作指导规范分析精液。选取符合捐精条件的正式志愿者为研究对象:精子浓度>60×106/ml,前向运动精子(PR)百分比>60%,PR复苏率>60%。
2.精液分组:收集研究对象精液,待精液完全液化后,每份精液样品分为2份:1份进行精液冷冻复苏处理,纳入实验组;1份为新鲜精液,纳入研究对照组。
二、研究方法
除特殊说明,本实验采用的相关试剂均来自于美国Sigma公司。
1.精液冷冻及复苏:本研究中,实验组采用北京精子库精液操作流程进行精液冷冻复苏[9]:1份体积甘油-卵黄-柠檬酸盐(自制)冷冻保护剂逐滴加入到2份体积精液中,充分混匀装入冷冻管,在30~35℃孵育10 min。将冷冻管放入程控冷冻仪中(Planner,英国),进行冷冻降温。精液于液氮保存2周后复苏:37℃水浴快速复温5~10 min。对实验组和研究对照组精子均进行精子活力、mtDNA拷贝数和完整性检测。
2.Markler计数板联合CASA法评估精子活力:采用Makler板(Sefi Instruments,以色列),在400倍光学显微镜下最少计数200个精子。计数精子总数和PR精子数,计算精子浓度和PR百分比。并采用计算机辅助精子动态图像检测系统CASA(IVOS,Hamilton Thorn Research,美国)分析运动参数:平均路径速率(Average path velocity,VAP)、直线速率(Straight-line velocity,VSL)和曲线速率(Curvilinear velocity,VCL)。
3.精子总DNA提取:充分混匀精液后,根据每份标本收集精子数为20×106个的标准,取相应体积的精液。将所取精液,与PBS液以体积比1∶2的比例进行混匀,1 000 g离心5 min,小心吸取并丢弃上清液。再加入1 ml PBS液,轻柔吹打,重悬精子后,1 000 g离心5 min,并重复两次。留取精子沉淀团,使用DNA提取试剂盒(北京天根生化)提取精子基因组DNA,稀释至10 ng/μl,-80°冻存备用。
4.实时荧光定量PCR(qPCR)检测mtDNA拷贝数:选取mtDNA编码的16SrRNA为目的基因[10],以核编码β-actin为内参基因,半定量检测mtDNA拷贝数。两基因引物由Invitrogen(上海)公司合成,引物序列详见表1。使用ABI PRISM 7500荧光定量PCR仪(Applied Biosystems,美国)进行扩增,获得各样品所扩展基因的CT值、扩增曲线和溶解曲线。扩展反应体系为20 μl:2×UltraSYBR Mixture(With ROX)(北京康为世纪)10 μl、上游引物(10 μmol/L)0.4 μl、下游引物(10 μmol/L)0.4 μl、DNA模板2 μl。扩增程序为:95℃10 min,(95℃15 s,60℃ 60 s)×45个循环。同时在60~95℃进行溶解曲线分析,根据溶解曲线图,评价引物特异性。采用基因的CT值,对mtDNA 拷贝数进行相对定量[9]:mtDNA拷贝数=2-△ct,其中△ct=CT16srRNA-CTβ-actin。
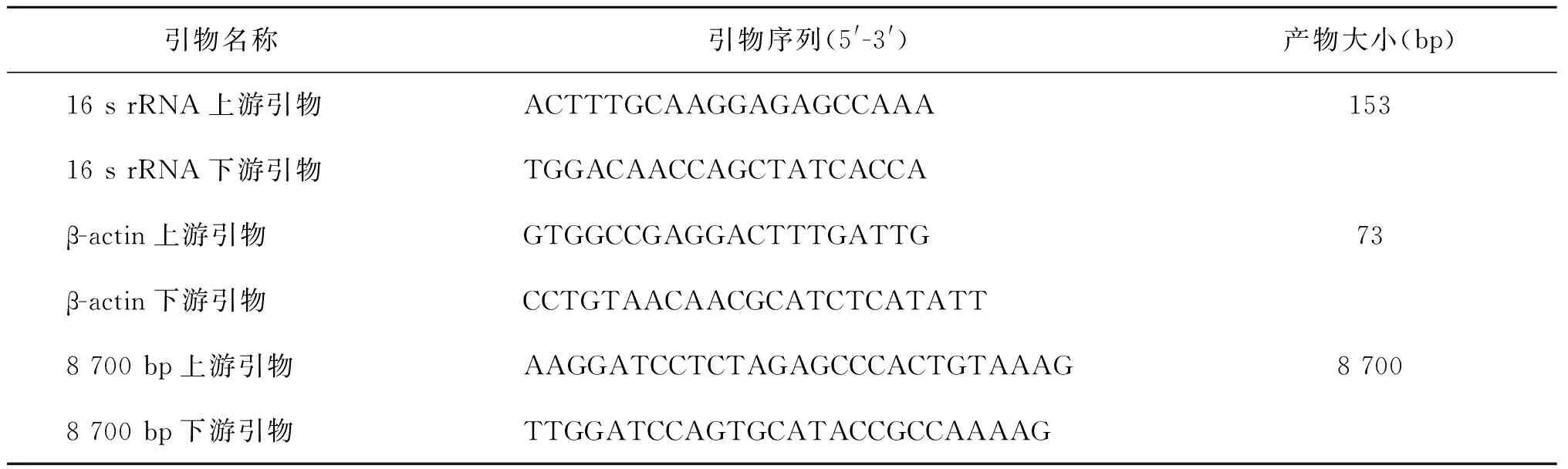
表1 引物序列
5.长链PCR方法检测精子mtDNA完整性:采用长链PCR方法扩增mtDNA 8 700 bp片段。引物由Invitrogen(上海)公司合成,详见表1。使用A100 PCR仪扩增,反应体系20 μl:2×Es Taq MasterMix(Dye)10 μl、上游引物(10 μmol/L)0.4 μl、下游引物(10 μmol/L)0.4 μl、DNA模板(10 ng/μl)2 μl,加入灭菌蒸馏水至20 μl。扩增程序为:95℃ 5 min,(95℃ 30 s,62℃ 60 s,72℃ 1 min)×30个循环,72℃延伸5 min。以8 700 bp片段产物评价精子mtDNA的完整性;采用Quantity One v.4.6.2软件读取8 700 bp条带电泳强度值。为了消除mtDNA数量的影响,将长链PCR扩增后的8 700 bp条带的电泳强度值与相对应的拷贝数进行标准化处理:电泳强度值/mtDNA拷贝数。
三、统计学分析

结 果
一、一般资料
共纳入22例符合北京人类精子库捐精条件的正式志愿者。纳入志愿者年龄为(27.8±3.0)岁,禁欲天数(6.1±0.9)d。志愿者精液体积为(5.0±1.5)ml,精子浓度(75.8±15.8)×106/ml,前向运动精子百分比为(68±6)%。采用北京精子库精液操作流程进行精液冷冻,22名志愿者总活动精子复苏率为(72±8)%。
二、冷冻保存对人精子的影响
1.冷冻保存对精子活力影响:冷冻复苏后前向运动精子百分比显著降低(P<0.05);冷冻保存后精子活力明显降低,VSL、VCL和VAP均显著低于新鲜精液组(P<0.05)(表2)。
2.冷冻保存对人精子mtDNA拷贝数的影响:按照mtDNA拷贝数=2-△ct,△ct= CT16srRNA-CTβ-actin,计算各样本mtDNA拷贝数。新鲜精液组精子mtDNA拷贝数为(5.66±5.53),冷冻复苏组精子mtDNA拷贝数为(10.12±8.41),配对样本t检验显示冷冻复苏组精子mtDNA拷贝数较新鲜精液精子显著增加(P<0.05)。

表2 冷冻保存对精子活力及运动参数量影响
注:与新鲜对照组相比,*P<0.05
3.冷冻保存对人精子mtDNA完整性的影响:以8 700 bp条带扩展相对强度值计算mtDNA完整性,冷冻复苏后精子组与新鲜精液精子组无统计学差异[(29.69±15.04)vs.(32.78±16.0),P=0.077],暂不认为冷冻复苏会降低精子mtDNA的完整性。
讨 论
精子冷冻保存技术发展至今,已有几十年的历史,其在辅助生殖技术中起到了至关重要的作用,且到目前为止,精液冷冻也是目前唯一有效的男性生育力保存的方式。随着冷冻方法和冷冻保护剂的不断改良,精子的存活率有了一定提高,但对精子功能等仍然会造成了一些不可逆转的影响。本研究结果中也发现,精液冷冻明显降低精子活力、减少RP百分率、降低精子运动参数。但活力和形态的改变,很难全面评估冷冻复苏后的精子质量;因此寻求多指标评价精子质量,筛选优质精子进行后期辅助生殖尤为重要。
冻融后精子遗传物质的改变一直受到相关领域研究者的关注[11]。我们团队早期研究发现精子冷冻会增加核DNA碎片[12],此后在越来越多的证据得到相类似结果[13]。我们对冷冻损伤对人精子DNA甲基化相关影响也进行相关探索[9]。
mtDNA是核DNA以外的遗传物质,mtDNA拷贝数和完整性是评价精子功能的重要指标之一。mtDNA拷贝数与常规精液参数如精子浓度、精子总数、精子活率及正常形态精子率呈负相关[4-5,14];它对成功受精和胚胎形成具有极大的重要性,与胚胎发育密切相关[15]。mtDNA完整性也与精子质量相关[3-5]:精液质量越高,mtDNA完整性越好;精液质量越差,mtDNA完整性越差。冷冻技术是否会对精子mtDNA的完整性和拷贝数产生影响,鲜有报道。
本研究初步探讨了冷冻保存对于人类线粒体DNA完整性和拷贝数的影响,采用qPCR和长链PCR技术分别检测冷冻前后精子mtDNA的拷贝数和完整性,以进一步研究冷冻损伤导致精子功能降低的相关因素。不同的实验方法,所测的结果存在差异[16]。本实验采用的qPCR不仅可以半定量,而且特异度高,可以排除假基因的干扰;且相比于二次测序技术[17]操作简单,对样本制备和数据处理的要求较低,易于大量使用和推广。本实验中22例合格供精志愿者新鲜精液mtDNA拷贝数及完整性检测结果,与Zhang等[5]研究结果相近。精子冷冻复苏后mtDNA拷贝数增加,这与卵母细胞冷冻相关研究相一致[18-19]。本研究通过长链PCR测量mtDNA完整性,并在每个精子样品中用mtDNA拷贝数归一化,进行量化比较。但目前结果暂未发现冻融后精子mtDNA完整性发现明显变化。国内蔡学泳等[20]关于冷冻保存对人类卵母细胞线粒体DNA缺失的研究也发现卵母细胞mtDNA缺失率和mtDNA拷贝数在冷冻处理前后均无统计学差异。不同于核DNA的稳固,mtDNA多以拷贝的形式存在于线粒体中,且没有组蛋白的保护,线粒体DNA修复的途径也并不完善;因此,线粒体中的氧化损伤比细胞核中的氧化损伤高,mtDNA所累积的突变是细胞核基因组的10~50倍[21]。
目前研究认为冷冻复苏过程中,精子内氧自由基和抗氧化剂防御体系平衡的丧失,过量的ROS产生,是引起精子冷冻损伤的重要因素。不同于其他细胞结构,成熟精子胞质少,且线粒体集中分布于精子中段,所以精子抗氧化能力减弱且缺乏修复能力,极易受到ROS损伤[22]。相关临床研究也显示[23]:ROS会引起精子功能降低与男性不育、女性复发性流产、儿童先天畸形等生殖相关疾病,存在密切相关性。本研究结果显示,在捐精合格志愿者人群中,冷冻过程会增加mtDNA拷贝数,但对mtDNA完整性的影响不大。可能的原因是[20,24]:ROS刺激引起线粒体呼吸链功能受损,ATP合成受到抑制,为了弥补损伤后的功能缺陷,拷贝数代偿性增加;但目前冷冻过程中ROS的蓄积,尚未引起mtDNA完整性的改变。
我们研究了现有冷冻复苏技术对精子mtDNA拷贝数和完整性的影响,但受到条件限制,本实验冻存时间尚未达到临床保存所需时间要求。后期需要进一步扩大研究人群、增加样本量、延长冷冻及纳入精子参数相关性研究,为精子冷冻损伤的机制进行进一步研究。

