卵泡液中游离线粒体DNA提取和定量方法的研究
刘宇,赵雪,邹敏,邵淑敏,李娇,张衷源,汪文诤,张玲,*
(1.华中科技大学同济医学院计划生育研究所,2.华中科技大学同济医学院生殖医学中心,武汉 430000)
游离DNA(circulating cell free DNA,cfDNA)是游离于细胞外的核酸,广泛存在于血液[1-7]、卵泡液[8-9]、胚胎培养液[10-11]等液体中。血清和血浆中的cfDNA作为一种无创的检测手段在肿瘤等疾病早期诊断及预后监测中表现出广阔的应用前景。cfDNA包括游离核DNA(circulating cell free nuclear DNA,cfnDNA)和游离线粒体DNA(circulating cell free mitochondrial DNA,cfmtDNA)。线粒体DNA的结构比较简单且数量多,因此,cfmtDNA具有成为无创检测标志物的潜力。尽管有不少研究显示了cfmtDNA与肿瘤的相关性[12-13],然而,对体液中cfmtDNA的研究尚处于起步阶段,其检测仍然存在很多问题,定量分析缺乏一个统一的标准,各实验室的结果缺乏可比性。因此,本研究拟通过对卵泡液处理和冷冻储存、不同Q-PCR引物和试剂盒进行分析比较,探索影响卵泡液中cfmtDNA提取和定量的因素,为后续实验奠定基础。
资料和方法
一、研究对象
收集2016年3月~10月在华中科技大学同济医学院生殖医学中心进行IVF/ICSI的78名患者的1~2个大卵泡液。其中14名患者的卵泡液用于卵泡液处理、冷冻储存和试剂盒选择研究;剩余64名患者的卵泡液用于实时荧光定量PCR(Q-PCR)引物的比较研究。纳入标准:(1)大卵泡(直径>16 mm的卵泡)的卵泡液;(2)无明显肉眼可见的血液污染。本研究通过本院伦理委员会批准([2017]伦审字(S206)号)。
二、主要试剂和仪器
1.主要试剂:DNase/RNase-Free Deionized water(北京天根生化科技)、 SYBR Green(Takara,日本)、50 bp DNA ladder(北京天根生化科技)
2.主要仪器和软件:StepOne实时荧光定量PCR仪(ABI公司,美国);PCR产物凝胶电泳仪(JY200C,君意东方电泳设备,北京);台式低温离心机(Heofuge 15R,力康生物);凝胶成像系统:Biometra BDA Digital(Biometra,德国)
三、方法
1.卵泡液的处理:卵泡液用4种方法处理,分别为:(1)一步离心法即3 000g离心15 min;(2)两步离心法即3 000g离心15 min后16 000g离心10 min;(3)在两步离心法的基础上用0.22 μm过滤器过滤;(4)在两步离心法的基础上用0.45 μm过滤器过滤;对cfmtDNA的提取量进行比较。
通过比较卵泡液4种处理方法对cfmtDNA提取量的影响实验结果,在后续实验中我们均用两步离心法处理样本。将IVF/ICSI患者的每人2 ml大卵泡液分成两份:一份新鲜样品直接提取cfmtDNA;另一份冷冻24 h后提取cfmtDNA。分别对新鲜及冷冻24 h后提取出来的cfmtDNA进行定量。
2.DNA提取:分别采用BeaverBeadsTMCirculating DNA 试剂盒和TIANamp Genomic DNA试剂盒进行样本中cfmtDNA提取。提取方法完全按照试剂盒的说明书进行,用200 μl洗脱液洗脱DNA。
3.q-PCR:用线粒体编码的基因ND1[11]和hmito3[15]为引物定量cfmtDNA,hmito3引物设计参考文献,并进行验证,合成委托上海生工生物工程公司,引物序列详情见表1。

表1 线粒体编码的基因ND1和hmito3引物序列
荧光定量PCR反应体系为20 μl,每个q-PCR反应包括2 μl cfmtDNA模板、2 μmol/L正向和反向引物和10 μl SYBR Green I的反应混合物。qPCR反应条件:在95℃孵育30 s,接着在95℃进行5 s的变性,以及60℃ 30 s的退火和72℃ 30 s的延伸,40个循环。实时定量PCR在StepOne Software v2.3中进行。每个样本重复3次。
4.标准曲线绘制
(1)标准品的制备:通过普通PCR扩增线粒体编码的ND1和hmito3基因,产物经2%琼脂糖凝胶电泳进行鉴定并切胶回收测浓度,此时的琼脂糖凝胶电泳产物即为标准品i。
(2)绝对定量标准曲线的制备:标准品i通过连续15次的5倍稀释得到标准品ii-XVi,将标准品i-XVi分别进行荧光定量PCR分析。荧光定量PCR反应体系为20 μl: 2 μl标准品、2 μmol/L正向和反向引物和10 μl SYBR Green I的反应混合物;反应条件为:在95℃孵育30 s,接着在95℃进行5 s的变性,以及60℃ 30 s的退火和72℃ 30 s的延伸,40个循环。实时定量PCR在StepOne Software v 2.3中进行。
四、统计学处理

结 果
一、线粒体基因引物的特异性、相关性和绝对定量标准曲线
两对引物用于荧光定量PCR以后,均显示出良好的扩增效果,熔解曲线正常,无引物二聚体和非特异性扩增,引物的特异性好(图1A、B,图2A、B)。2%琼脂糖凝胶电泳图显示,ND1和hmito3分别可见139 bp和129 bp的目的条带(图1C)。ND1绝对定量标准曲线方程为y=-3.78x+5.2715,其中R2=0.9979,扩增效率为83.89%(图1D);hmito3绝对定量标准曲线方程为y=-3.5489x+0.8876,其中R2=0.999 4,扩增效率为91.33%(图2C)。ND1和hmito3两个基因的扩增效率好,适用于样本分析。在同一荧光阈值下,ND1和hmito3引物扩增cfmtDNA所得的浓度平均值分别为(3.49±5.17)ng/L和(0.03±0.02)ng/L,两对引物浓度平均值之间有显着性差异(P<0.05),相关性分析显示ND1与hmito3良好的相关性(r=0.63,P<0.000 1),因此在后面的研究中,我们只选择了其中一种线粒体基因的引物ND1进行定量分析。
二、新鲜样本中4种不同的处理方案对卵泡液中cfmtDNA提取量的影响
4种不同的处理方案下,用线粒体基因ND1去定量卵泡液中cfmtDNA浓度,结果依次为:(14.34±14.81)ng/L、(3.41±5.04)ng/L、(2.19±2.72)ng/L、(1.58±2.08)ng/L。一步离心法得到的cfmtDNA浓度最高,与其他三种方案相比较差异有统计学意义(P<0.05);其他3种方案之间cfmtDNA浓度差异无统计学意义(P>0.05)(图3)。
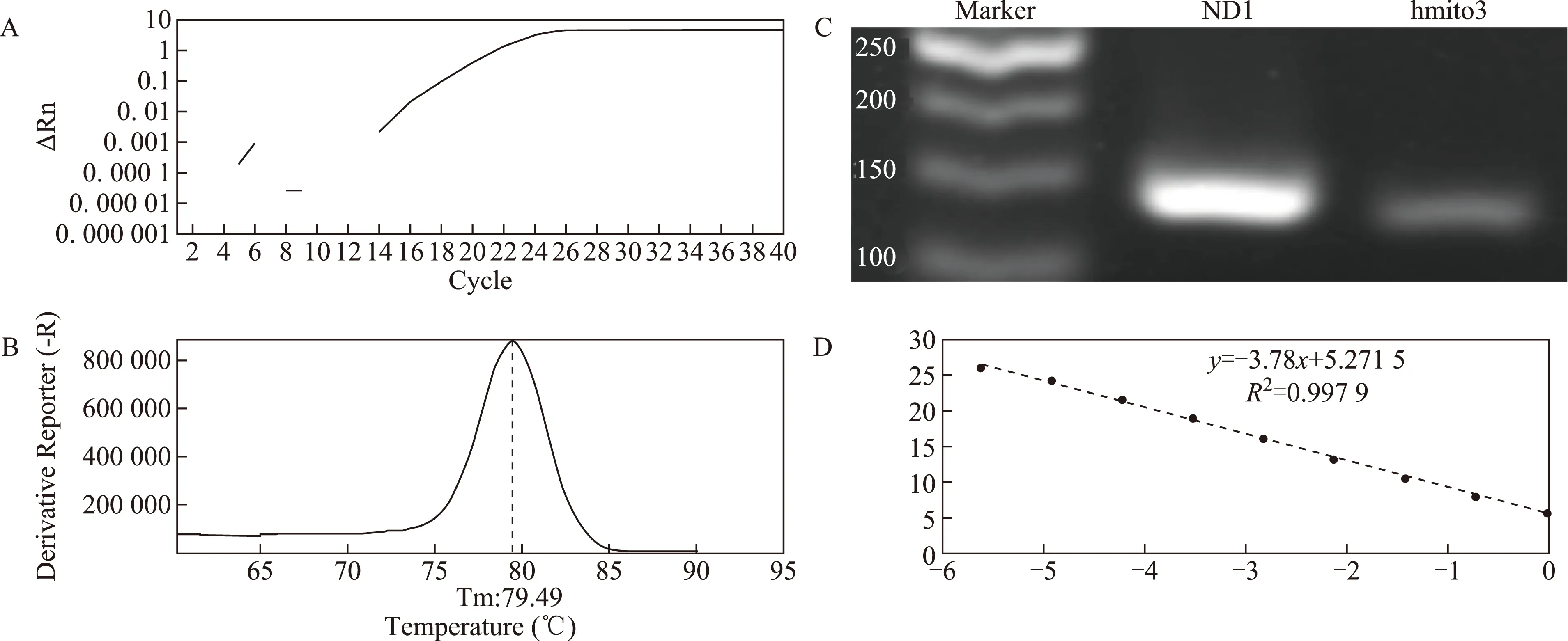
图1 ND1引物的Q-PCR结果
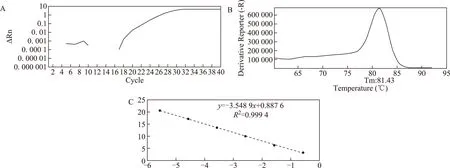
A:扩增曲线;B:熔解曲线;C:标准曲线;其中hmito3引物的凝胶电泳图谱见图1 C图2 hmito3引物的Q-PCR结果
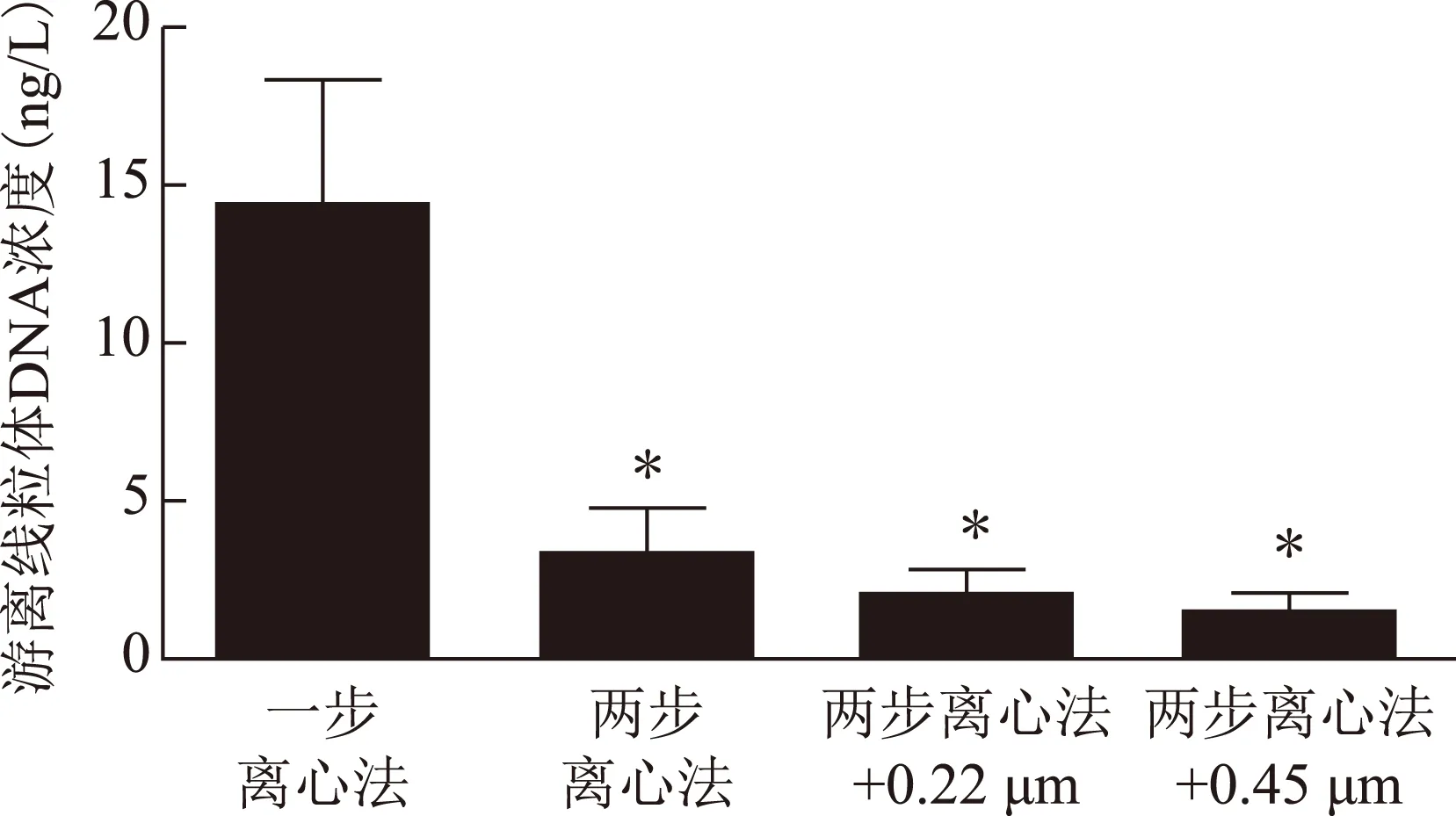
图3 新鲜样本中4种不同的处理方案对卵泡液中cfmtDNA提取量的影响与一步离心法相比,*P<0.05
三、储存条件对卵泡液中cfmtDNA提取量的影响
以ND1为引物对cfmtDNA进行定量,冷冻前样本中提取到的cfmtDNA浓度为(3.41±5.04)ng/L,冷冻后样本中cfmtDNA为(2.82±2.40)ng/L,两者cfmtDNA浓度差异无统计学意义(P>0.05)。
四、两种不同试剂盒对卵泡液中cfmtDNA提取量的影响
用ND1定量两种试剂盒提取卵泡液中cfmtDNA的浓度,BeaverBeadsTMCirculating DNA试剂盒提取卵泡液中cfmtDNA的浓度为(5.17±2.77)ng/L,而TIANamp Genomic DNA试剂盒提取的为(2.79±2.37)ng/L,前者比后者提取到卵泡液中cfmtDNA的量显著增加(P<0.05)(图4)。

图4 两种不同的试剂盒提取卵泡液中cfmtDNA的比较与TIANamp Genomic DNA试剂盒相比较,*P<0.05
讨 论
近年来由于分子生物学的飞跃发展,对体液中的cfDNA和cfmtDNA的研究有了长足的进展。线粒体为细胞活动提供所必需的能量,同时参与细胞内新陈代谢、钙离子稳定[15]、细胞凋亡和信号传递等多种生物过程,能够较为全面的反映细胞的功能状态。线粒体DNA质与量的变化可导致氧化磷酸化异常等线粒体功能不良,在疾病的发生发展中起重要的作用。而且,线粒体DNA还具有基因长度短、分子结构简单及拷贝数众多等特点。因此,cfmtDNA具有成为信息量大、敏感性高的血清标志物潜力。目前关于cfmtDNA的研究主要针对血液及其他体液中cfmtDNA与肿瘤的关系,卵泡液中cfmtDNA的研究尚未见报道。
我们的研究结果显示3 000g离心15 min的条件下卵泡液中cfmtDNA的浓度是最高的,而后3种处理方式下cfmtDNA的浓度差异没有统计学意义(P>0.05)。这与Chiu等[16]人的研究结果是一致的。他们通过研究循环线粒体DNA的物理特征发现,不同的离心和过滤方案会影响健康个体血浆中线粒体DNA的定量,可能是由于血浆中存在颗粒相关(particle-associated)的线粒体DNA和非颗粒相关(non-particle-associated)的线粒体DNA。一步离心法获得的卵泡液中cfmtDNA的浓度最高,推测是其中残留的细胞碎屑所致。两步离心法获得的卵泡液则为一种几乎无细胞或细胞碎屑的液体[17],这种离心方法可取得与过滤类似的效果,所以更建议用两步离心法。-80℃冰箱冷冻卵泡液对cfmtDNA的提取量没有影响,表明卵泡液样本可先放于-80℃冰箱储存,然后集中进行cfmtDNA的提取。这对于样本的收集管理以及工作的安排提供了便利。
荧光定量PCR可以通过检测荧光信号的变化来测定引物的特异性。在本研究中,线粒体的两对引物ND1和hmito3用于荧光定量PCR以后,均显示良好的扩增效果,熔解曲线正常,无引物二聚体和非特异性扩增,引物的特异性好,凝胶电泳也证实目的条带明显。ND1为引物所得到的cfmtDNA浓度平均值远远大于hmito3引物所得的浓度平均值。hmito3引物扩增cfmtDNA浓度较低可能推测与hmito3在mtDNA中独特存在有关。Malik等人[18]研究证实了hmito3是mtDNA独特的短区域设计出来的引物,其不会共扩增任何核假基因。本研究中相关性分析结果显示ND1引物与hmito3引物良好的相关性(P<0.000 1),说明hmito3和ND1引物均可用于卵泡液中cfmtDNA的定量分析。
目前,提取cfmtDNA最常用的方法有磁珠法(例如:BeaverBeadsTMCirculating DNA 试剂盒)、硅胶膜离心柱吸附法(例如:TIANamp Genomic DNA试剂盒)等方法。磁珠法充分发挥了纳米与生物技术的优点,利用磁场分离的原理,即磁珠可以特异性的吸附DNA,在外加磁场的作用下,能够从液体中分离出DNA的方法;优点是提取DNA浓度高、纯度好,同时省时、快速。硅胶模离心柱吸附法是利用一种特殊的硅基质膜吸附材料,选择性的吸附DNA片段,而RNA、蛋白质等物质被过滤,最后用洗脱液将DNA片段从滤膜上洗脱下来的方法;优点是简化了核酸的纯化过程、操作简便。我们的研究结果表明,与硅胶膜离心柱吸附法(TIANamp Genomic DNA试剂盒)相比,用磁珠法(BeaverBeadsTMCirculating DNA 试剂盒)可获得较高浓度的cfmtDNA,快捷简便。
综上所述,在进行卵泡液中cfmtDNA的提取时,可选用两步离心法来处理样本;同时,可以将处理好的样本冻于-80℃冰箱,待样本量合适时统一处理。比较硅胶膜离心柱吸附法,磁珠法有助于减少提取过程中的损耗,获得更多的cfDNA。线粒体编码的基因ND1和hmito3均可用于cfmtDNA的定量分析,可根据需要选择。

