致牛肉酱生膜菌的分离鉴定及其生膜能力验证
郭壮,董蕴,尚雪娇,倪慧,周明会,张振东*
(1.湖北文理学院 化学工程与食品科学学院 鄂西北传统发酵食品研究所,湖北 襄阳 441053;2.襄阳农锦食品有限公司,湖北 襄阳 441053)
牛肉酱使用牛肉为主要原料,添加天然香辛料,经蒸、煮、熬等多道工序精制而成,营养全面均衡,在全国范围内均有消费市场。鲜肉经过热加工制成各种熟肉制品后理应不含菌体,但是由于工艺或者其他原因,可能会有微生物在牛肉酱中残留下来,进而在后期贮藏中产生生物膜和腐败。生膜微生物在牛肉酱中进行繁殖,不仅影响到牛肉酱的外观、气味、滋味。有些微生物还可能会产生一些毒素,一些侵袭性的微生物还可能会造成食物中毒等事件,危及到食用人群的健康。由于很多种酵母对低温有很好的适应性,因此冷藏通常只能减缓食品腐败的发生[1]。
通常情况下,引起肉类食品生膜腐败的微生物有霉菌、酵母和细菌。牛肉酱是一种高油和高蛋白含量的食品,所以能引起牛肉酱腐败的微生物通常能分解油脂,能够利用蛋白质来获取能量。研究表明,酱肉中的腐败菌以肠杆菌属微生物、芽孢杆属、微球菌群等细菌微生物与丝状真菌和酵母为主。引起食品腐败的酵母有:高盐的大头菜中Candidapararugosa,Candidazemplinina等腐败酵母[2],引起糖浆、酱油等食品腐败的Candidapelliculosa,Candidalambica,Geotrichumcandidum[3],能够利用脂肪而引起高脂肪食品腐败的Candida,Cryptococcus,Geotrichum与Rhodotorula等。本文从襄阳市区牛肉酱企业收集到1瓶生膜牛肉酱样品,采用传统可培养方法对生膜微生物进行了分离与鉴定,使用分子生物学方法对分离到的微生物进行了鉴定,并验证了它们对牛肉酱的生膜能力。
1 材料与方法
1.1 材料
1.1.1 牛肉酱
2017年9月从湖北省襄阳市牛肉酱生产企业收集的生膜牛肉酱1瓶及刚加工的新鲜牛肉酱1000 g。
1.1.2 培养基
LB培养基配方:胰蛋白胨10 g,酵母粉5 g,氯化钠10 g,蒸馏水1000 mL,调节pH至7.2;PDA培养基:使用合成培养基(海博,青岛);YPD培养基配方:1% 酵母膏,2% 蛋白胨,2%葡萄糖,调节pH至7.2。
1.1.3 主要仪器
电子天平 赛多利斯公司;-70 ℃冰箱、生物安全柜 青岛海尔股份有限公司;组织研磨器 美国Biospec公司;隔水式培养箱 上海博讯实业有限公司;离心机 日本日立公司;PCR仪 美国ABI公司;恒温水浴锅 上海森信实验仪器有限公司。
1.2 方法
1.2.1 牛肉酱生膜菌的分离与纯化
生膜细菌的分离采用传统的平板划线法进行:取生膜牛肉酱1块,将接种环在酒精灯上灼烧灭菌、冷却后,挑取生膜酱块上的含生物膜菌团,划线于LB固体平板上培养3~5天。根据菌落形态的不同,挑取菌落形态具有差异的菌,并在LB固体平板上划线纯化至少3次,然后将纯化的细菌进行染色镜检后使用30%甘油于-40 ℃冰箱保存。
生膜真菌的分离方法同生膜细菌:取生膜牛肉酱,挑取生膜酱块上的菌膜,划线于PDA固体平板后于25 ℃培养3~5天。根据菌落形态的不同,挑取菌落形态具有差异的菌,并在PDA固体平板上划线纯化至少3次,然后使用30%甘油于-40 ℃冰箱保存。在保存前,将纯化过的微生物未染色直接镜检与染色镜检。
1.2.2 牛肉酱腐菌DNA提取
牛肉酱中生膜菌的鉴定:将纯化过的微生物培养1~2天后收获菌体,将菌体使用TE缓冲液重悬,并加入0.2 g玻璃珠(直径0.5 mm)后在组织研磨器中破碎菌体细胞,接着加入10% SDS、蛋白酶K,于55 ℃水浴90 min后,使用酚-氯仿-异戊醇(25∶24∶1)抽提1次,接着使用氯仿-异戊醇(24∶1)抽提1次后取上清,加入2倍体积无水乙醇沉淀DNA,然后晾干并用无菌TE缓冲液溶解DNA,使用0.8%琼脂糖凝胶电泳检测,保存于-20 ℃冰箱备用[4]。
1.2.3 牛肉酱腐菌的鉴定
使用酵母菌26S rDNA的D1/D2区通用引物NL1(5′-GCA TAT CAA TAA GCG GAG GAA AAG-3′)与NL4 (5′-GGT CCG TGT TTC AAG ACG G-3′)[5],以提取的生膜菌总DNA为模板进行PCR扩增,将PCR产物使用1%的琼脂糖凝胶电泳检测后,使用AxyPrep PCR清洁试剂盒纯化,并连接到pMD18-T克隆载体后,转化到Top10大肠杆菌感受态细胞。接着使用M13引物,取在LB液体(含氨苄青霉素)过夜培养的克隆子进行PCR,并用1.5%琼脂糖凝胶对克隆子进行验证,然后挑取阳性克隆子送南京金丝瑞生物科技有限公司测序。待测序后,将去除引物NL1与NL4的序列在NCBI数据库进行BLAST比对,选取最相近的序列与分离到的菌株序列一起构建系统发育树,分析生膜菌的系统发育地位。
1.3 生膜菌对牛肉酱的生膜能力
取正常加工的牛肉酱100 g分装于玻璃瓶中,首先进行巴氏杀菌。待牛肉酱冷却后,接入培养好的菌液,并于25 ℃培养,每天观察牛肉酱的情况,待牛肉酱生膜后,进行拍照并描述牛肉酱的组织状况。
2 结果
2.1 牛肉酱腐菌的分离与纯化
划线分离与倍比稀释法是分离微生物的基本方法,许多研究都采用这些方法对传统发酵食品中的微生物进行分离。本研究使用划线分离法对牛肉酱中的生膜微生物进行了分离与纯化。从PDA固体平板上微生物LJJ11,从LB培养基上获得了3株微生物LJJ1、LJJ2、LJJ3。分离到的4株微生物在PDA固体平板上的菌落形态及它们的镜检图片见图1。

图1 牛肉酱生膜菌形态Fig.1 The morphology of biofilm-forming yeasts
通常情况下,LB培养基主要用来分离与纯化细菌。由图1可知,从LB固体培养基上分离到的3株微生物LJJ1、LJJ2、LJJ3与LJJ11显微形态一致,菌体细胞大小明显大于普通的细菌,推断分离到的4株菌均为酵母菌。单个酵母细胞呈卵圆形,而多个细胞聚集在一起时,出现不规则的多边形菌体,酵母细胞可被结晶紫染色,染色后在显微镜下酵母细胞呈卵圆形。在PDA固体平板上生长2天后,这4株菌的菌落形态均表现为白色凸起,奶油样外观,菌落周围整齐,表面光滑湿润。
2.2 生膜酵母的PCR扩增
对酵母菌LJJ1、LJJ2、LJJ3与LJJ11菌体总DNA进行了提取,然后使用真菌26S rDNA基因D1/D2区通用引物NL1与NL4进行了PCR扩增。PCR扩增产物的琼脂糖凝胶电泳图见图2,可知PCR产物片段约为600 bp,符合真菌26S rDNA基因D1/D2区段大小,可以进行下一步的克隆并进行测序。

图2 生膜酵母26S rDNA基因D1/D2区PCR产物凝胶电泳图Fig.2 Agarose gel electrophoresis of PCR products of D1/D2 region of 26S rDNA gene of biofilm-forming yeasts
2.3 生膜酵母的鉴定
酵母菌大亚基上26S rDNA分子,可分为 D1、D2~D12等多个区域,其中D1/D2区域,序列相对比较保守,长度为600 bp左右。而酵母18S rDNA序列长达1800 bp,测序较繁琐,且多数酵母菌均能使用26S rDNA中Dl/D2区进行区分[6]。针对26S rDNA基因D1/D2区仍然无法区分的酵母,可采用ITS间区或者一些持家基因如TEF1,CYTB,RPB等序列加以区分[7,8]。
使用通用引物NL1与NL4通过PCR获得了分离到的4株酵母的26S rDNA基因D1/D2区序列,并将这些序列在NCBI进行BLAST比对,结果见表1。
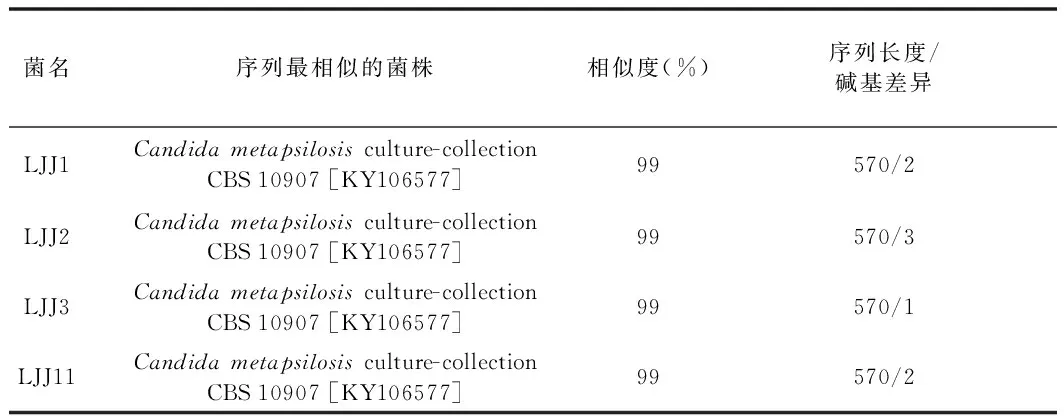
表1 分离到的4株酵母NCBI BLAST比对结果Table 1 NCBI Blast of isolated 4 yeast strains
由表1可知,4株菌与Candidametapsilosis(近平滑假丝酵母)序列相似度最高。但是与Candidametapsilosis,Candidaparapsilosis,Candidaorthopsilosis3个种的酵母菌株序列相似度也超过了99%。有研究人员将Candida属一些生理生化性状相似,26S rDNA基因D1/D2区序列相似的酵母菌组成一个Candidaparapsilosiscomplex[9],而系统发育分析也证实了它们的同源性较高,在系统发育树上能聚成一个分支。
从NCBI数据库下载序列相似度超过98%的序列,与分离到的4株酵母菌序列一起构建系统发育树,进行系统发育分析以确定它们的分类地位,见图3。

图3 基于生膜菌26S rDNA D1/D2区序列的NJ系统发育树Fig.3 Neighbor-joining phylogenetic tree of biofilm-forming yeasts based on D1/D2 region 26S rDNA gene
由图3可知,它们与Candidametapsilosis系统发育关系最近,并与Candidaparapsilosis,Candidametapsilosis,Candidaorthopsilosis聚成一个分支,表明它们都属于Candidaparapsilosiscomplex。这4株酵母菌26S rDNA基因D1/D2区序列的系统发育关系分析表明,它们均属于Candidametapsilosis,而它们的菌落形态与显微镜下的形态与Candidaparapsilosiscomplex符合,因此综合分子生物学方法和传统培养方法,这4株酵母菌均属于Candidametapsilosis,为Candidaparapsilosiscomplex的一个分支。
目前国内对Candidaparapsilosiscomplex的研究仍然较少,国外的研究主要针对Candidaparapsilosiscomplex的感染性与分类方面。2004年,基于ITS等序列的MLST分析,Tavanti等[10]将Candidametapsilosis与Candidaorthopsilosis一起确立为种水平上的新分类单元。2007年,Gácser等[11]指出,C.orthopsilosis与C.parapsilosis对人体组织的损伤程度较为相似,而C.metapsilosis的毒性更小一些。Candidaparapsilosiscomplex是人类皮肤表面的一种正常菌群之一,常可在指甲下间隙分离到。但是它们也是一种机会致病菌,感染之后能导致多种疾病:真菌血症、心内膜炎、腹膜炎、关节炎和内眼炎等的发生。
2.4 分离菌的生膜性分析
将生膜菌接入新鲜的经过灭菌的牛肉酱中,在25 ℃常温培养7天后,牛肉酱的外观发生了显著变化,见图4。

图4 生膜菌致牛肉酱腐败实验Fig.4 Experiment of spoilage of beef sauce caused by biofilm-forming bacteria
牛肉酱肉块表面长满了黄色的菌膜,且LJJ1、LJJ2、LJJ3与LJJ11 4个处理的牛肉块表面的组织状态类似。而对照未接菌处理的牛肉酱表面仍然保持与第0天的牛肉酱组织状态一致,说明分离到的4株Candidaparapsilosiscomplex中Candidametapsilosis酵母确实是引起这种牛肉酱生膜的微生物。
Candidaparapsilosiscomplex能产生多种代谢产物,如谷胱甘肽、GABA及各种酶如木糖还原酶等,还可用于肉类发酵,有较好的应用价值。将Candidaparapsilosis与普洱茶共发酵,发现接种菌株的普洱茶样品的GABA含量显著较高[12]。也有研究人员使用Candidaparapsilosis进行(S)-苯基乙二醇的生物制备[13]。
与其他食品不同,牛肉酱是一种高油脂、高蛋白及高盐食品。据报道,一些酵母能产生丰富的蛋白酶,降解肉类制品中的蛋白质产生低分子量的硫化物如H2S和SO2,造成食品的营养价值与气味变化。这些酵母多为Candida属,如Candidazeylanoides和Candidaalimentaria,而关于Candidametapsilosis对造成肉类食品生膜的报道尚少。
3 总结
酵母菌是一种常见的腐败菌,能导致肉类、果蔬、面食等的腐败。本研究从腐败的牛肉酱肉块上分离到的4株微生物均为酵母菌,经过菌落形态、显微细胞细胞形态的观察及系统发育分析得出它们均属于Candidametapsilosis,且它们均能导致新鲜无菌牛肉酱产生黄色膜状腐败。

