传统调味品中纳豆激酶产生菌的筛选和鉴定
王俊芳,刘佳佳,刘佳音
(1.河南大学 生命科学学院,河南 开封 475004;2.河南大学 健康与护理学院,河南 开封 475004)
纳豆是将黄豆蒸煮过后,在纳豆枯草芽孢杆菌的发酵作用下制成的,是一种具有粘性、口感润滑、营养成分极丰富的豆制品,其营养价值较大豆倍增[1,2]。研究表明,纳豆发酵过程中纳豆菌产生了一种能够直接溶解纤维蛋白的碱性丝氨酸蛋白酶活性物质,即纳豆激酶(nattokinase)。纳豆激酶是日本科学家须见洋行从纳豆中首先发现并命名的,因其显著的溶血栓作用而备受瞩目[3]。纳豆激酶的溶血栓能力明显强于尿激酶、链激酶、t-PA、蛇毒制剂、DSPA等具有一定副作用的溶血栓药物。纳豆激酶作用迅速,使用安全,无毒副作用,半衰期长,具有广阔的开发和应用前景。随着血栓类疾病对人类健康的危害日益加重,人们开始注重养生,食用纳豆激酶保健品的人们越来越多。而纳豆作为调味品,具有预防心脑血管疾病、抗氧化、降血压、抗癌、防治骨质疏松、美容等保健功能[4-6]。由于购买的商品纳豆大多都有胺臭味,闻起来有点让人难以接受。因此,本文旨在对纳豆激酶产生菌进行筛选、鉴定,以获得符合国人口味的酱香型发酵纳豆生产用菌种。
1 材料与方法
1.1 材料
1.1.1 样品
自制豆豉、豆酱等发酵豆制品。
1.1.2 主要试剂
凝血酶(1000 U)、纤维蛋白原、尿激酶(≥7200 U):均购自北京索莱宝科技有限公司;其他试剂:均为市售分析纯。
1.1.3 培养基
斜面培养基为LB培养基[7]:蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,琼脂20 g/L,用来活化及保藏菌种。
初筛选培养基(牛奶平板):用来筛选产蛋白酶的菌株,配制方法是向配好的牛肉膏蛋白胨培养基中添加终质量浓度为15 g/L的牛奶,温度105 ℃,时间30 min,单独灭菌。
液体发酵培养基为牛肉膏蛋白胨培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂20 g/L,用于菌种的发酵培养。
1.2 方法
1.2.1 样品的处理
将不同的豆豉、豆酱等样品各取5 g,分别加入装有20 mL无菌水和10颗玻璃珠的锥形瓶中,在温度30 ℃,转速200 r/min下振荡20 min,再于室温下浸提1 h,转速3000 r/min离心5 min,即制得菌悬液。
1.2.2 纳豆激酶生产菌株的筛选
1.2.2.1 初筛
将制得的菌悬液于80 ℃水浴锅中热处理20 min,再将不同样品制得的菌悬液用生理盐水倍比稀释,取10-1,10-2,10-3,10-44个浓度梯度,分别取100 μL涂布牛奶平板,在30 ℃恒温箱培养18 h。
1.2.2.2 复筛
观察牛奶平板上长出的单菌落,选出透明圈直径与菌落直径比值较大的菌株,用无菌牙签接种到牛奶平板上。放入30 ℃恒温培养24 h,再次选出透明圈比值较大的菌株。将筛选出的菌分别在牛肉膏蛋白胨培养基上连续划线分离纯化,重复筛选3次。
挑取纯化的单菌落,接种到LB斜面培养基,30 ℃恒温培养24 h,放入4 ℃冰箱中保存备用。
1.2.3 纳豆激酶酶活分析
1.2.3.1 制备纳豆激酶粗酶液
将筛选得到的高产菌株用无菌牙签挑取,分别接种到30 mL的牛肉膏蛋白胨液体培养基中,在全温度振荡培养箱中在30 ℃,转速200 r/min的条件下摇床培养22 h。取出后在4 ℃,转速12000 r/min下离心10 min,取其上清液,即得到纳豆激酶粗酶液。
1.2.3.2 配制改良的纤维蛋白原平板
参考Astrup等的方法[8]:利用琼脂糖、凝血酶和纤维蛋白原按比例混合制成人工血栓平板:配制琼脂糖溶液:将0.1 g的琼脂糖加入到10 mL蒸馏水中,用微波炉加热使之溶解,在121 ℃灭菌20 min,使用前在45 ℃下恒温水浴10 min;配制纤维蛋白原溶液:将0.01 g纤维蛋白原加入到10 mL 10 mol/L的PBS缓冲液中(pH为7.44),振荡摇匀后在45 ℃下恒温水浴10 min备用;将凝血酶稀释至100 U/mL,取10 μL加入到配制好的琼脂糖溶液中,快速摇晃均匀,倒入9 cm的无菌平板中,在室温下放置一段时间使其充分冷却凝固。
1.2.3.3 制作尿激酶标准曲线
参考张杰等描述的尿激酶标准曲线的制作方法[9]。首先将尿激酶标准品稀释至50,200,400,600,800,1000 U/mL,分别取10 μL上样于配制好的均匀摆放了牛津杯的纤维蛋白平板上,在室温下静置10 min,于37 ℃恒温培养箱中培养18 h,取出后用游标卡尺测量各个溶解圈的直径,计算出各个溶圈的面积。将尿激酶的酶活力单位数作为横坐标,将溶解圈的面积作为纵坐标,做标准曲线。
1.2.3.4 纳豆样品酶活检测
加样:将灭过菌的牛津杯均匀放置在纤维蛋白平板上,加入10 μL纳豆激酶粗酶液,在室温下静置10 min后放入37 ℃恒温培养箱中培养18 h。
观察溶解圈的大小,测量其直径,计算溶解圈面积。对照尿激酶标准曲线计算样品的酶活。
1.2.4 纳豆激酶产生菌生长曲线的测定
将筛选出的纳豆激酶产生菌接种到牛肉膏液体培养基中,放入37 ℃,200 r/min的摇床中培养,每隔2 h测量其OD595值,重复测量3次。将OD595值作为纵坐标,生长时间作为横坐标,做出纳豆激酶产生菌的生长曲线。
1.2.5 纳豆制备及其感官评价
从本实验筛选出的纳豆菌株中,挑选出纤溶活性较好的菌株,另外,再以枯草芽孢杆菌1-44菌株作为对照,分别制备待发酵菌株的种子液,4 ℃冰箱保存备用。
挑选大小相对一致、无虫咬和颗粒饱满的大豆。将大豆清洗干净,以3∶1的比例加入水,在室温下浸泡18 h,将水过滤掉,分装到250 mL的锥形瓶中,40 g/瓶,放入高压蒸汽灭菌锅,121 ℃下蒸煮30 min。取出后冷却至50 ℃左右,加入2 mL菌悬液,充分混匀,在37 ℃下恒温发酵24 h,发酵完成后放入4 ℃冰箱中,后熟24 h后即得到纳豆制品。
将制得的纳豆转移到培养皿中,搅拌均匀后测定其拉丝长度。具体方法是用玻璃棒挑起,以20 cm作为1个单位,拉出20 cm后再从中间挑起20 cm,重复至拉断为止。另外,对纳豆的气味、口感、色泽、拉丝和纳豆激酶酶活等指标分别进行感官评价。评价方式参考马明等的方法进行[10]。品评人数为10人,分别对纳豆单项指标进行打分,并综合评价。
1.2.6 纳豆激酶产生菌的鉴定
1.2.6.1 形态观察和生理生化鉴定
参照东秀珠《常见细菌鉴定手册》,对筛选得到的纳豆激酶生产菌进行形态特征和生理生化鉴定实验[11]。
1.2.6.2 PCR检测
PCR产物由上海生工扩增及测序。提取目标菌株基因组,并以其为模板,采用细菌16Sr DNA通用引物F(5′-AGAGTTTGATCCTGGCTCAG-3′)和R(5′-GGCTACCTTGTTACGACTT-3′)进行PCR扩增,PCR扩增体系为:ddH2O 15.9 μL, 10×PCR Buffer 2.5 μL,Mg2+(1.5 mmol/L)1.5 μL,dNTP (10 mmol/L)2.0 μL,P1 (10 mmol/L)1.0 μL,P2 (10 mmol/L) 1.0 μL,模板1.0 μL,rTaq酶0.1 μL,PCR反应条件为:95 ℃预变性5 min;94 ℃变性30 s,58 ℃退火45 s,72 ℃延伸2 min,共30个循环;72 ℃延伸10 min。琼脂糖凝胶电泳检测PCR产物。
1.2.6.3 16S rDNA 测序及同源性分析
测序结果在RDP 网站(http://rdp.cme.msu.edu/index.jsp)数据库检出与所测菌16S rDNA 序列同源性较高的序列,判断16S rDNA 基因鉴定结果。
1.2.6.4 系统发育分析
在RDP 核苷酸数据库中挑选出同源性较为相近的16S rDNA 序列,用MEGA 7.0软件邻接法(neighbor-joining method)进行1000次步长计算,构建系统发育树。
1.2.7 不同培养条件下对纳豆激酶产生菌的酶活测定
分别在不同的初始pH值和发酵温度下,针对筛选出的纤维活性最高的菌株,进行发酵产酶的实验,观察这些培养条件对产纳豆激酶的影响,实验设计如下:
(1)将250 mL的瓶分装30 mL牛肉膏蛋白胨液体培养基,初始pH分别调为5.0,6.0,7.0,8.0,9.0,接种高产菌后于37 ℃,转速200 r/min下摇床发酵24 h,测其OD595值及相对酶活。
(2)将高产菌接种到pH和盐离子都一定的液体培养基中,分别放在25,28,35,37,40 ℃几个不同温度下发酵,24 h后分别测量其相对酶活,观察温度对产酶的影响。
(3)在配制液体培养基时,将牛肉膏培养基中原本单一的Na+换成用Mg2+,K+,Ca2+,Mn2+分别与Na+按一定比例组合加入,盐离子加入量为0.2 g/L,pH都调为7,分装成30 mL/瓶,接种高产菌,培养条件及酶活测定方法同(1),比较各离子对产酶的影响。
1.3 数据分析
实验重复3次及以上,数据采用平均值,数据经方差分析,计量数据组间比较利用Duncan检验分析。
2 结果与分析
2.1 纳豆激酶生产菌株的筛选
利用牛奶平板对产酶菌株进行初筛选,共选出15株纤溶性明显的菌株。测量这些菌株的透明圈直径和菌落直径,并计算其比值。通过计算从中挑选出4株直径比较大的菌株,结果见图1。各菌株周围均有明显的透明圈,N-2菌株的直径比最大,高于枯草芽孢杆菌1-44和1-37菌株的直径比。
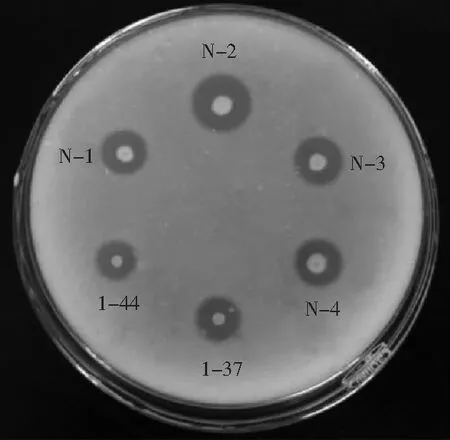
图1 牛奶平板初筛纳豆激酶产生菌Fig.1 Screening nattokinase producing strains in milk plate
2.2 纳豆激酶酶活分析
通过测量尿激酶标准品的酶活,制得的尿激酶标准曲线见图2,得到线性回归方程:y=0.320x+54.13,R2=0.994,表明线性关系良好。
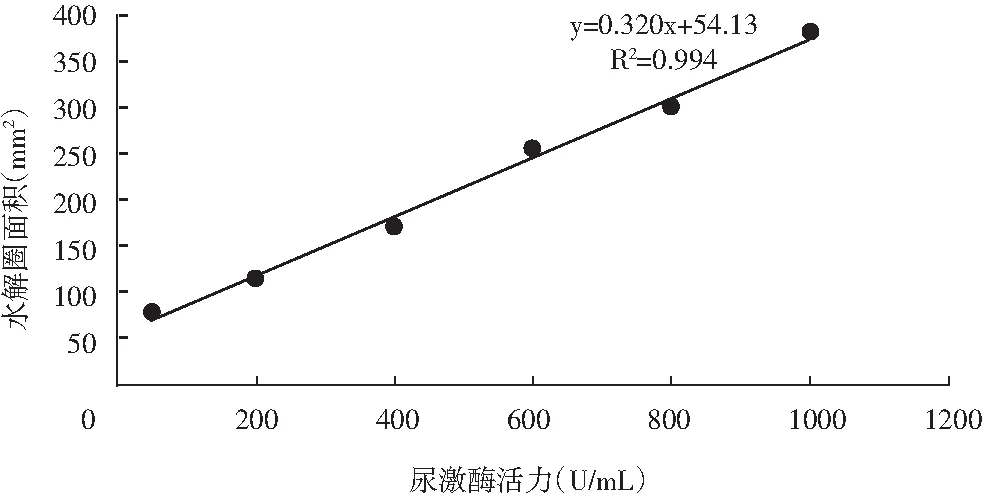
图2 尿激酶标准曲线Fig.2 Urokinase standard curve
将测得的溶解圈面积对照尿激酶标准曲线,计算可得。本实验从豆制品分离筛选出的几株纤溶性好的菌种中,N-2菌株的酶活力最高,达到了1159 U/mL,结果见表1。
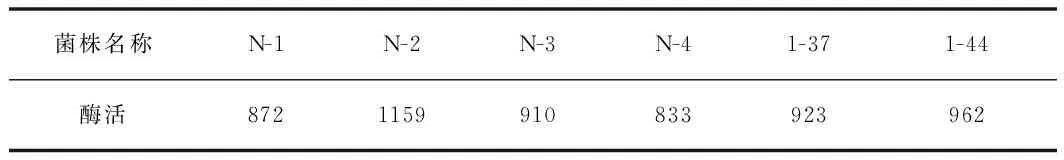
表1 不同菌株纳豆激酶酶活Table 1 Nattokinase activity of different strains U/mL
2.3 纳豆激酶产生菌生长曲线的测定
纳豆激酶产生菌N-2的生长曲线见图3,N-2菌在0~8 h时生长缓慢,处于生长延滞期;在8~12 h时活菌数量快速增加,处于对数生长期;在12~24 h处于生长稳定期;24 h之后进入生长衰亡期。
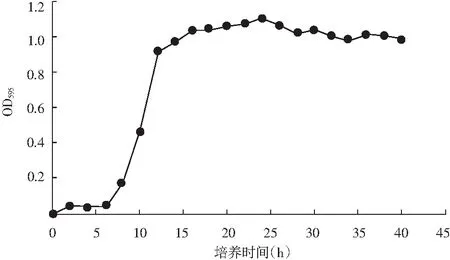
图3 N-2菌株生长曲线Fig.3 Growth curve of N-2 strain
2.4 纳豆制作及感官评价
分别利用N-1,N-2,N-3,N-4,1-44菌株发酵制备纳豆。并按照相应的评价指标对大豆进行品评打分,比较结果见图4。
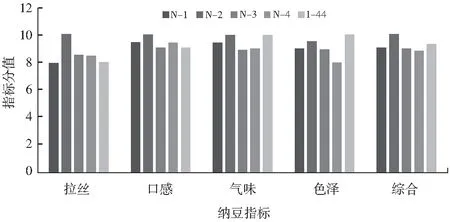
图4 不同菌株发酵纳豆指标比较Fig.4 Comparison of the indexes of natto fermented by different strains
结果显示:N-2菌株发酵纳豆拉丝、口感和气味等指标都优于其他菌株;1-44菌株发酵纳豆色泽黄褐色,半透明状,优于其他菌株;其中用N-2菌株发酵制得的纳豆拉丝长度为80 cm,且酱豆味更香浓;用1-44菌株发酵的纳豆拉丝长度为30 cm,香味也稍次于N-2菌株发酵的纳豆。通过对发酵纳豆综合评价,N-2优于其他菌株。
N-2发酵结果及拉丝见图5,N-2发酵制得的纳豆初始为黄褐色,后熟结束颜色稍变深,口感酥软,带有独特的酱香味,没有胺臭味,搅动纳豆时其表面的乳白色粘液增多,可以拉出长长的强韧不易断的拉丝。

图5 N-2菌株发酵的纳豆Fig.5 Natto fermented by N-2 strain
注:左图为三角瓶发酵纳豆;右图为纳豆拉丝。
2.5 高产纳豆激酶产生菌的鉴定
2.5.1 形态观察
N-2菌株的菌落形态近似圆形,边缘不整齐或裂成叶状,乳白色不透明,且表面有褶皱。对N-2菌株进行芽孢染色观察,显微观察结果见图6,菌体呈短杆状,两端钝圆,产芽孢,芽孢呈柱状或椭圆形,芽孢中生,芽孢囊不明显膨大;革兰氏染色阳性。
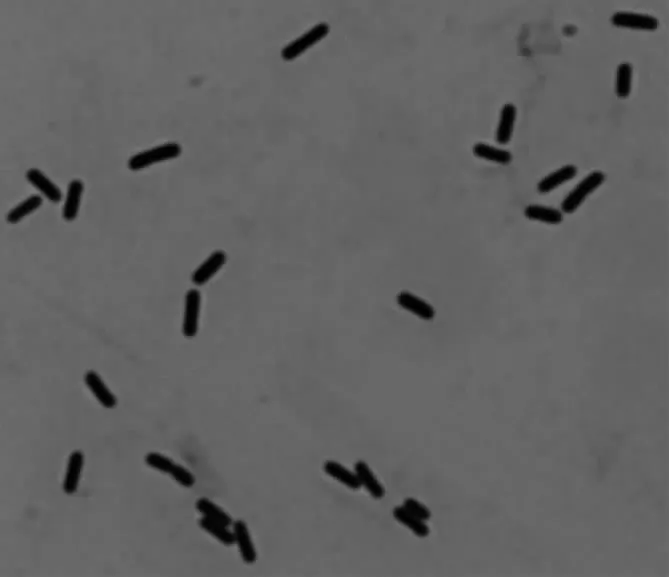
图6 N-2菌株革兰氏染色Fig.6 Gram's stain of N-2 strain
2.5.2 生理生化鉴定
对N-2菌株的部分生理生化特征进行测定,结果见表2。
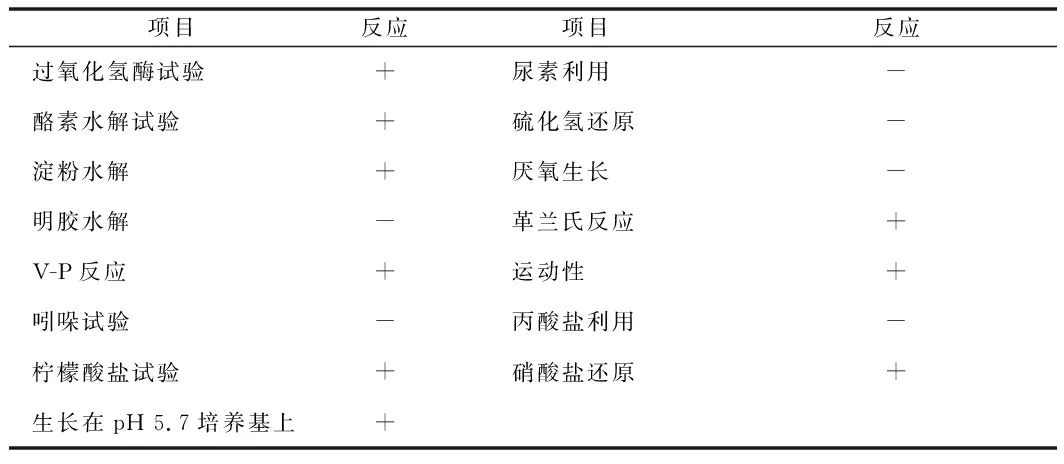
表2 N-2菌株生理生化测定Table 2 Physiological and biochemical determination of N-2 strain
2.5.3 N-2菌株16S rDNA同源性分析
将N-2菌株16S rDNA测序结果在RDP 数据库进行比对,利用Classifier功能比对,结果显示:N-2菌株属厚壁菌门,类杆菌纲,芽孢杆菌目,芽孢杆菌科,芽孢杆菌属;通过Seqmatch功能,将16S rDNA测序结果提交比对,结果显示:N-2菌株与GenBank中的模式菌株解淀粉芽孢杆菌BacillusamyloliquefaciensDSM7同源性达到99%。
2.5.4 系统发育分析
根据Seqmatch比对结果,选择与N-2菌株同源性较高的模式菌株16S rDNA 序列,用软件MEGA 7.0邻接法(neighbor-joining method)进行1000次步长计算,构建系统发育树(见图7)。在该系统发育树上可见,N-2与GenBank中模式株BacillusamyloliquefaciensDSM7和BacillusamyloliquefaciensNBRC聚在同一个分支,验证可信度达89%。由以上分析可知,N-2是一株Bacillusamyloliquefaciens(解淀粉芽孢杆菌)。

图7 N-2菌株系统发育树Fig.7 Phylogenetic tree of N-2 strain
注:树枝上的数值为验证可信度;图下端标尺表示碱基置换频率;上标T表示菌株为模式菌株。
2.6 纳豆激酶产生菌N-2菌株培养条件对酶活性的影响
2.6.1 培养基初始pH值对纳豆激酶活性的影响
培养基不同初始pH,摇瓶发酵24 h后,分别测量相对酶活,结果见图8。培养基初始pH值为6.0时的相对酶活最高,pH值为9时相对酶活最低。经方差分析,培养基5个不同初始pH值,发酵结束后,酶活差异极显著。经多重比较,Duncan检验分析,结果显示:初始pH值为6的培养基发酵结束酶活极显著高于其他处理;pH值为5的培养基发酵结束酶活显著高于pH值为9的培养基;其他初始值之间发酵结束两两比较,均显示酶活差异极显著。

图8 培养基初始pH对N-2菌株纳豆激酶酶活的影响Fig.8 Effect of initial pH of culture medium on nattokinase activity of N-2 strain
注:小写字母表示显著度为P<0.05;大写字母表示显著度为P<0.01,下同。
2.6.2 发酵温度对纳豆激酶活性的影响
N-2菌株经5个不同的培养温度,分别培养发酵24 h,实验结果见图9。35 ℃时的相对酶活最高,25 ℃发酵相对酶活最低。经方差分析,5个培养温度经发酵24 h后,25 ℃与40 ℃发酵结束,酶活差异不显著;28 ℃与40 ℃发酵结束,酶活差异显著;35 ℃和37 ℃温度与其他发酵温度相比,均显示酶活差异极显著。
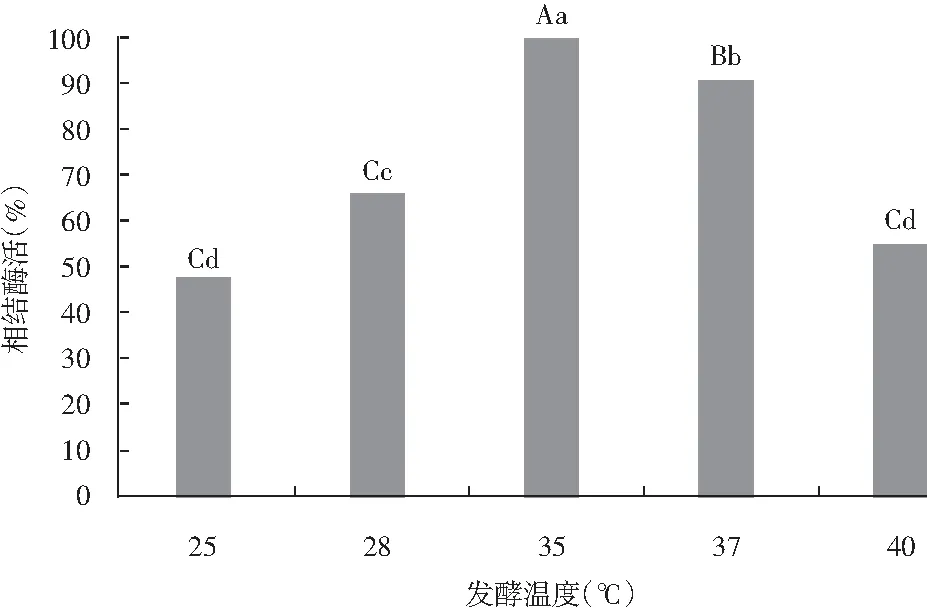
图9 发酵温度对N-2菌株纳豆激酶酶活的影响Fig.9 Effect of fermentation temperature on nattokinase activity of N-2 strain
2.6.3 不同盐离子对纳豆激酶活性的影响
N-2菌株以牛肉膏蛋白胨培养基为基础培养基,分别添加一定量盐,培养发酵24 h,实验结果见图10。与其他盐相比,Ca2+对产酶的影响效果极显著,其他盐之间对产酶的影响效果不显著。
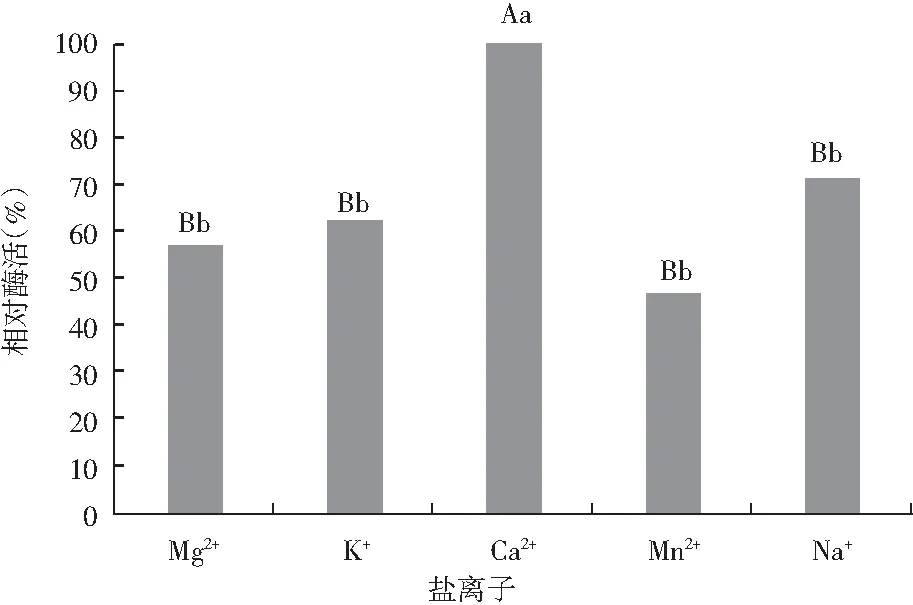
图10 盐离子对N-2菌株纳豆激酶酶活的影响Fig.10 Effect of salt ions on nattokinase activity of N-2 strain
对以上实验结果进行分析,初步确定较佳的培养条件为:培养基初始pH 6.0,加入适量Ca2+盐,发酵温度35 ℃。在此培养条件下使用N-2菌进行液体发酵产酶,测得菌液的酶活为1365 U/mL。
3 讨论
本实验从传统调味品中分离纳豆激酶产生菌,对筛选出的几株纤溶活性高的菌株进行了纳豆发酵,并对纳豆进行了评分比较。其中,N-2菌株各指标综合评价分值最高,该菌株发酵纳豆性状较优。发酵初始pH及供氧对纳豆激酶酶活影响极显著。可通过改变培养条件和培养基营养组成优化产酶条件,提高纳豆激酶酶活。另外,可通过诱变或基因工程方式对菌种进行选育,提高纳豆激酶产量。
市售纳豆及纳豆激酶存在的突出问题:大多市售纳豆都有稍许胺臭味,有少部分人能接受食用;纳豆和纳豆激酶产品牵涉到纳豆激酶酶活,其产品的货架期相对其他调味品或保健品的货架期短;菌株纳豆激酶产量低。该实验进一步的研究内容主要从以下几个方面着手,纳豆发酵优化、延长产品的货架期和提高N-2菌株的产酶量等方面。
4 结论
本实验从传统豆豉中筛选出的纳豆激酶产生菌编号为N-2的菌株,对其进行形态观察、生理生化鉴定和16S rDNA序列分析等项目的测定;鉴定结果初步认定该菌株为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)。N-2菌株纤溶活性高,其纳豆发酵性状最佳,纳豆拉丝长达80 cm,其酶活达到1159 U/mL,该菌最适的单因素液体发酵条件为:培养基初始pH 6.0,添加0.02%浓度的 Ca2+盐,发酵温度35 ℃。在该条件下进行液体发酵,其酶活为1365 U/mL,酶活比之前提高了18%。解淀粉芽孢杆菌是公认的益生菌,而且该菌株又来源于食品,因此,N-2菌株可用于保健豆豉和纳豆的生产和开发,但作为纳豆激酶生产菌商品开发,该菌株的酶活有待进一步提高。

