输尿管不全梗阻时段平滑肌肌球蛋白表达的研究
安文亚,吴宇波,罗江艳,赵泽驹,罗逸航,辜 浩
(遵义医学院附属医院 泌尿外科,贵州 遵义 563099)
输尿管不全梗阻临床较为多见,梗阻时间越长平滑肌不可逆性损害越重,梗阻近端输尿管扩张、积水、肾盂高压波及肾实质,肾功能进行性减退[1];在梗阻过程中输尿管病理生理变化先于肾脏,适时干预有利于挽救输尿管及肾功能,又使非手术治疗得以实现。输尿管梗阻临床上较为常见,梗阻发生后其基本病理生理改变为梗阻近端输尿管压力升高,输尿管扩张、积水,持续梗阻最终导致肾功能不可逆性损害,因对肾脏的损害可以较为快速的发现,以至于梗阻性疾病的研究重点关注了肾损害,其实,输尿管梗阻后近端输尿管病理性改变先于肾脏,部分输尿管梗阻解除后肾功能基本恢复。本文用SD大鼠输尿管不全梗阻模型,研究了梗阻不同时段输尿管形态结构及平滑肌肌球蛋白表达,以期为临床掌控输尿管不全梗阻解除时间提供理论支持。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 健康10~12周龄普通级SD大鼠120只,雌性各半,体重250~300 g,由第三军医大学大坪医院实验动物中心提供,许可证号:SCXK-(渝)2012-0005。饲养于遵义医学院中心实验室,雌雄分开,普通标准饲料喂养,自由饮水,每2~3天更换垫料,室温18~22 ℃,相对湿度45%~65%,3周后随机分为正常组30只,模型组和实验组各45只。
1.1.2 主要试剂和仪器 肌球蛋白兔抗大鼠一抗(SA1022)、抗体稀释液(AR10161)、即用型正常山羊血清(AR0009,武汉博士德生物工程有限公司);肌球蛋白二抗免疫组化试剂盒(GK500705,上海基因科技有限公司);CKX31普通光学倒置显微镜(日本Olympus公司);IPWin32采图系统(德国Leica公司)。
1.2 方法
1.2.1 模型建立及标准化 正常组不实施干扰,模型组SD大鼠称重后,10%的水合氯醛3 mL/kg腹腔内注射麻醉,麻醉有效后固定、剪毛、消毒,取下腹正中切口,切开进入腹腔,探查无异常后找到膀胱,分离右侧输尿管下段约2.0 cm,于后方腰大肌钝性分离出一条长约2.0 cm、深约0.5 cm的裂隙,不做输尿管腰大肌隧道包埋,腹腔放少量青霉素,缝合腹部切口;实验组在模型组基础上参照腰大肌隧道包埋法将游离的下段放置于裂隙底部[2-3], 1-0丝线间断缝合2针关闭裂隙,腹腔放少量青霉素后缝合切口,继续饲养。
1.2.2 标本采集 术后1、2、3周随机选择正常组10只、模型组及实验组各15只处死,分离、切取右侧肾及输尿管;实验组找到右侧输尿管下段包埋处线结,分离显露输尿管、肾脏,近膀胱壁剪断输尿管,挤压肾脏见尿液从近侧断端流出,切除右侧肾脏、输尿管;观察各组输尿管及肾脏形态,拍照,部分输尿管用4%多聚甲醛固定,石蜡包埋,切片备组织病理与免疫组化用。
1.2.3 输尿管直径测量 完整分离输尿管及肾脏,标记输尿管梗阻部位,用游标卡尺(0.05 mm)测量输尿管中、上段直径(均分三段测量)记录数据。
1.2.4 组织病理及免疫组化 将输尿管中、上段石蜡切片常规梯度脱蜡至水,一部分用于HE染色观察其不同时间的组织结构变化;另一部分用于平滑肌肌球蛋白检测,按试剂盒说明,SP法逐步实施,阴性对照用PBS代替一抗;结果判断:镜下平滑肌细胞胞浆内见黄色或棕黄色颗粒为阳性;细胞胞浆内未见黄色或棕黄色颗粒为阴性;用Leica Qwin图像处理系统采集图像,每张切片采集4~5张图片,并用Image-proplus 6.0图像分析软件测量平均积分光密度(IOD)进行相对定量分析。
2 结果
2.1 模型效果与样本 本实验由同一组实验人员在中心实验室完成,建模顺利; SD大鼠120只中117只达到预期目标,死亡3只中包括模型组3周时1只,实验组1、3周各1只,正常组无死亡;纳入统计的正常组30只,模型组44只,实验组43只,切取的右侧肾、输尿管数量与之相同。
2.2 实验大鼠大体观察 正常组与模型组肾、输尿管大体形态比较无明显差异;实验组右侧梗阻近端输尿管直径增粗、肾脏体积增大与其比较差异显著,且梗阻不同段间也存在差异:1周,右侧梗阻近端输尿管稍增粗,肾脏体积约有增大、张力稍高;2周,梗阻以上输尿管增粗明显,壁厚,肾脏体积增大、包膜张力高、皮质变薄、肾盂扩张;3周,梗阻近端输尿管增粗显著,管壁明显变薄,肾脏体积增大、外形不规则,肾盂、肾盏分离,肾实质菲薄,肾盂、肾盏变形扩大(见图1)。

A1、2、3:正常组1、2、3周;B1、2、3:模型组1、2、3周;C1、2、3:实验组1、2、3周。图1 各组大鼠不同时段输尿管及肾脏形态学变化
2.3 输尿管不同时段直径变化 正常组与模型组比较,输尿管直径变化统计学无差异(P>0.05);实验组与模型组、正常组比较,实验组不同周间比较,输尿管直径变化均有显著差异(P<0.01,见表1)。
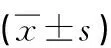
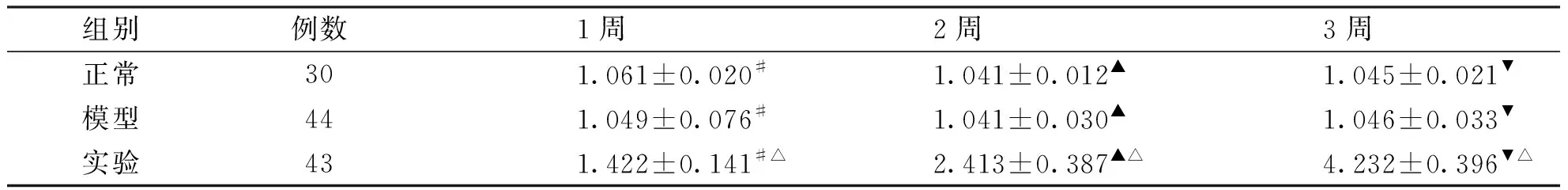
组别例数1周2周3周正常301.061±0.020#1.041±0.012▲1.045±0.021▼模型441.049±0.076#1.041±0.030▲1.046±0.033▼实验431.422±0.141#△2.413±0.387▲△4.232±0.396▼△
1周:正常组、模型组及实验组比较,#:P<0.01;2周:正常组、模型组及实验组比较,▲:P<0.01;3周:正常组、模型组及实验组比较,▼:P<0.01;1、2、3周实验组比较,△:P<0.01。
2.4 HE染色观察输尿管组织病理变化 正常组及模型组右侧输尿管平滑肌细胞排列规律、完整,细胞核呈长椭圆形,无明显核异型,与实验组间差异较大;实验组1周,右侧输尿管壁稍增厚,平滑肌层为主,平滑肌细胞排列紊乱,可见部分细胞代偿性肥大,间质增生的纤维结缔组织延伸到细胞间,细胞间连续性及规律性被局部被破坏;2周,右侧输尿管壁明显增厚,肌层明显增生肥厚,细胞排列紊乱,体积增大,胞核成长梭型,浆膜下部分纤维也有增生;3周,右输尿管壁明显变薄,肌层明显,细胞萎缩,体积变小,细胞核变小变圆,大量纤维增生取代平滑肌(见图2)。
2.5 输尿管平滑肌肌球蛋白表达 正常组、模型组及实验组各周平滑肌肌球蛋白均有不同程度的表达,彼此间表达量存在差异(见图3);正常组与模型组间差异无统计学意义(P>0.05),二者与实验组各周比较差异有统计学意义(P<0.01);实验组1、2周平滑肌肌球蛋白表达量明显高于正常组和模型组,第3周组表达量却显著低于模型和正常组(P<0.01);实验组各周间表达量也存在显著差异,2周组>1周组>3周组(P<0.01)(见表2);整个实验中平滑肌肌球蛋白表达强弱顺序为:实验组2周>实验组1周>正常组与模型组>实验组3周。

A1、2、3:正常组1、2、3周;B1、2、3:模型组1、2、3周;C1、2、3:实验组1、2、3周;(HE,×200)。 图2 各组大鼠不同时段输尿管病理学改变

A1、2、3:正常组1、2、3周;B1、2、3:模型组1、2、3周;C1、2、3:实验组1、2、3周;D:空白对照组;(IHC,×400)。 图3 各组大鼠不同时段输尿管平滑肌肌球蛋白表达
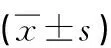

组别例数1周2周3周正常300.109±0.004#0.110±0.007▲0.103±0.006▼模型440.111±0.008#0.113±0.004▲0.112±0.007▼实验430.146±0.009#△0.221±0.052▲△0.059±0.017▼△
1周:正常组、模型组及实验组比较,#:P<0.01;2周:正常组、模型组及实验组比较,▲:P<0.01;3周:正常组、模型组及实验组比较,▼:P<0.01;1、2、3周实验组比较,△:P<0.01。
3 讨论
输尿管不全梗阻临床较为常见,多与结石有关,部分梗阻过早解除挽救了肾及输尿管功能,却使非手术治疗失去意义,如较小的输尿管中、下段结石不全性梗阻急性期手术干预[4];另一部分则因梗阻解除过晚致近端输尿管过度扩张、积水、肾脏代偿性积水增大、实质萎缩,梗阻消除后输尿管仍扩张、积水、收缩乏力,为较小结石、尿盐结晶、脱落坏死组织或感染性脓苔等形成梗阻提供了机会,时常诱发急性梗阻、肾衰[5],且非手术治疗效果差。可见输尿管不全梗阻适时解除非常重要,不仅可以充分实施非手术治疗,使部分患者受益,还有利于及时手术干预,恢复输尿管及和肾脏功能,那么到底什么时间解除梗阻较为适宜,目前尚缺相关共识[6],据此,我们用SD大鼠输尿管不全梗阻模型进行了研究,获得了较为可靠的结果。
输尿管是肌性、管状、空腔器官,依赖平滑肌节律性收缩协助排尿,梗阻一旦发生,尿液滞留,梗阻近端压力升高,反射性输尿管、肾盂平滑肌收缩力增加,以期排出更多尿液缓解压力,保护肾脏泌尿功能;如果梗阻时间延长,尿液不能排出,完全性梗阻,近端积水及压力将进一步升高,肾盂压>10 mmHg时出现肾实质返流,肾血流分布改变,髓质流量增加,泌尿功能逐渐下降到停止[7];此时,输尿管、肾盂维持高压,功能停止,不可逆性损害持续,一经诊断需立即解除梗阻方可挽救其功能,与临床上所见完全性输尿管梗阻、肾盂轻度扩张积水、肾脏体积增大不明显或缩小,镜下呈纤维化萎缩。不全性梗阻,因始终有部分尿液排出,梗阻近端压力有一定程度的缓解,输尿管、肾盂平滑肌收缩、扩张以期排出更多尿液,呈现由代偿到失代偿的转化过程,输尿管扩张、积水逐渐增加,波及肾脏后肾积水、体积增大、实质萎缩也逐渐发展,最终使输尿管过度扩张增粗类似于“肠管”,巨大肾积水形成,输尿管壁及肾实质均菲薄,肾单位耗竭,尿量却基本维持稳定,即使梗阻解除,输尿管及肾功能已不可能有效恢复[8];该过程中输尿管病理损害先于肾脏,部分输尿管梗阻解除后肾功能基本恢复[9]。
输尿管平滑肌最先受累,肌球蛋白是平滑肌纤维主要结构与功能单蛋白,在梗阻性病变中,肌细胞内离子稳态破坏,出现钙超载,线粒体、肌球蛋白等超微结构异常[10-11],肌球蛋白的变化较早,研究其变化规律可反映不同时段输尿管平滑肌功能状态,对保护输尿管及肾脏有预警作用,及时阻止可以挽救肾功能;实验中发现输尿管不全梗阻随时间延长,近端输尿管逐渐扩张,2、3周间变化较明显,与其它各组间形成显著差异,肾盂扩张积水与肾脏体积增大也呈相应变化,提示输尿管梗阻性改变波及肾脏损害;镜检与大体观察结果类似:梗阻2周输尿管平滑肌层增厚,细胞代偿性增生肥大,核变大,长梭型;第3周管壁平滑肌纤维明显减少,肌层变薄、细胞萎缩、核小而圆、细胞排列紊乱、纤维增生明显,与2周前形成显著差异,肌球蛋白的表达量在1、2周也呈现增加,3周时显著降低,甚至低于阴性对照与对照组,说明不全梗阻过程中,平滑肌细胞经历了由代偿期肌球蛋白合成增加、肌纤维增粗向失代偿性降低与减少的过程,肌球蛋白的这种显著性变化是平滑肌不可逆性损害的标志[12],说明输尿管不可逆性改变存在,只有解除梗阻才能阻止输尿管及肾脏功能进一步损害。
综上所述,输尿管不全梗阻平滑肌损伤性改变较早,其肌球蛋白表达的变化与平滑肌细胞形态结构改变相适应;不全梗阻2周到3周间变化最为显著,可能存在代偿向失代偿的转化,超过2周,平滑肌不可逆性损害的风险明显增加,建议临床将输尿管不全梗阻观察期控制在2周,最好不超过3周,否则,即使解除梗阻,输尿管功能也存在降低,并可能成为再发梗阻和长期影响肾功能的危险因素。

