纳米Na0.32MnO2嵌入化合物的制备与电化学性质
代 芳,朱杨军,温祖标,周 攀,李 平,章 磊
(1.江西省精密驱动与控制重点实验室,南昌工程学院,南昌 330099; 2.江西师范大学 化学化工学院, 江西 南昌 330022)
科学技术的发展提高了人们生活水平,同时,也污染与破坏着人类赖以生存的环境.如总量有限的化石能源(如石油、煤、天然气等)不仅日益减少,而且燃烧后排放出大量的COx和NOy气体以及尘埃等,使得全球生态环境问题日趋严重(如全球变暖和雾霾加重等).因此,开发清洁高效的绿色能源(如太阳能、地热、风能、生物能等)及其利用技术已是时下全球的研究热点,而利用这些可持续的绿色能源产生的间歇性电能需要高效能量存储系统[1].其中,锂离子电池(Lithium-ion Batteries, LIBs)和超级电容器(Supercapacitor)是最为普遍的电化学能量存储系统;它们具有方便易行、环境友好和可持续发展等特点,而广泛应用在电子、(混合)电动汽车、电气设备、国防和航天科技等不同领域[2].
超级电容器在学术上也称为电化学电容器(Electrochemical Capacitors)[3],是介于普通电池和传统电容器之间的一种新型储能元件,具有充放电效率高、循环寿命长与使用温度范围宽等特点,在大功率领域,甚至成为电池的重要补充或替代物,抑或成为下一代的电化学储能装置[2,4].电极材料对超级电容器的电化学性能起着决定性作用,主要有碳材料、导电聚合物、过渡金属氧化物[3-5]和嵌入化合物(Intercalation compound)[6]以及它们的复合材料等.它们各自具有不同的比容量,其中,法拉第比容量是双电层比容量的10~100倍,而嵌入比容量又数倍于法拉第比容量[7].
在过渡金属氧化物中,二氧化锰(MnO2)具有易得、价廉、无毒、环境友好等特性,因而是超级电容器的重要电极材料[8].MnO2由[MnO6]八面体构成,但其连接方式有多种,因而可形成α-、β-、γ-、δ-、OMS-5-MnO2等不同的晶型[9].MnO2作为电极材料,具有电导率低、转移电阻大并且在电化学循环过程中锰离子易溶于电解质等缺点,严重影响了MnO2的利用率,也限制了其电化学性能[6].因此,通常将MnO2与其他材料如碳材料、导电聚合物等进行复合,以改善MnO2的电化学性能.在上述不同的晶型的MnO2中,δ-MnO2具有层状结构,其层间距为0.7nm,易为碱金属离子(如Na+、K+)嵌入,生成嵌入化合物;碱金属离子(如Na+、K+)的嵌入改变了MnO2的电子电导率和离子电导率,进而大大提高材料的比电容和循环稳定性[10-11].
本文采用溶液法,首先制备层状δ-MnO2前驱体,然后采用水热沉积法,以NaOH为嵌入离子源,制备以具有0.46×0.92nm隧道结构的OMS-5-MnO2为宿主的纳米Na0.32MnO2嵌入化合物电极材料;利用多晶X射线衍射仪、扫描电子显微镜、能谱仪表征了材料的晶型结构、形貌特征和元素组成;然后应用电化学工作站测试了材料在0.5mol·L-1Na2SO4和K2SO4电解液中的相关电化学性能.
1 实 验
1.1 纳米NaxMnO2电极材料的制备
在冰水浴条件下,将100mL 0.28mol·L-1MnCl2溶液缓慢滴加到盛有100mL 3mol·L-1NaOH溶液和0.1mol·L-1KMnO4溶液的混合溶液中,搅拌反应24h,静止,过滤,用蒸馏水洗涤至滤液呈中性后,60℃下干燥12h,获得层状δ-MnO2前驱体.然后,将0.5g上述制备的δ-MnO2超声分散在100mL 0.1mol·L-1NaOH溶液中获得悬浊液,然后转至高压反应釜中,180℃条件下反应48h后,抽滤,用蒸馏水洗涤直至滤液呈中性.在60℃下干燥24h,即可获得以OMS-5-MnO2为宿主的纳米NaxMnO2嵌入化合物.
1.2 材料的表征
用X射线衍射(X-ray diffraction, XRD)仪(Cu靶,D8 ADVANCE,Bruker,德国)对材料的晶相结构进行分析,扫描范围为5°~90°,管压为40kV,扫描速度10°/min;采用扫描电子显微镜(Scanning Electron Microscope, SEM)(S-3400N型,日本日立公司)观察材料颗粒大小和表面形貌,同时采用能谱仪(Energy Dispersive Spectrometer, EDS)测试了试样的元素种类及组成.
1.3 电极的制备及电化学性能的测试
按照质量比为8∶1∶1,分别称取NaxMnO2、粘合剂(PTFE乳液,质量分数60%)、导电石墨粉至一干净烧杯中,加入适量乙醇使其润湿,用玻璃棒搅拌均匀,待其干燥至糊状后,压在已称重的干净镍网上,然后再放至压片机上,制成一厚度约为0.3mm、半径约为0.5cm的电极片.在三电极体系中,以制备的电极片为工作电极、饱和甘汞电极(Saturated Calomel Electrode, SCE)为参比电极、镍网为对电极,在电化学工作站(CHI660E,上海辰华仪器公司)上测试材料的电化学性能.
2 结果与讨论
2.1 X射线衍射表征
图1为层状δ-MnO2前驱体和NaxMnO2嵌入化合物的XRD图谱,由图1(a)可知,在2θ=12.2°、24.7°处呈现出两个明显的特征衍射峰[12],由此可判断该物质为层状δ-MnO2.从图1(b)可知,样品的最高衍射峰在2θ=12.22°处,其他各衍射峰的位置与Shen[13]所制备的OMS-5-MnO2是一致的,表明以层状δ-MnO2为前驱体可以制备OMS-5-MnO2宿主,并可容纳Na+而可能生成NaxMnO2嵌入化合物,这与我们先前所制备的K-OMS-5-MnO2是有相似之处的[14].
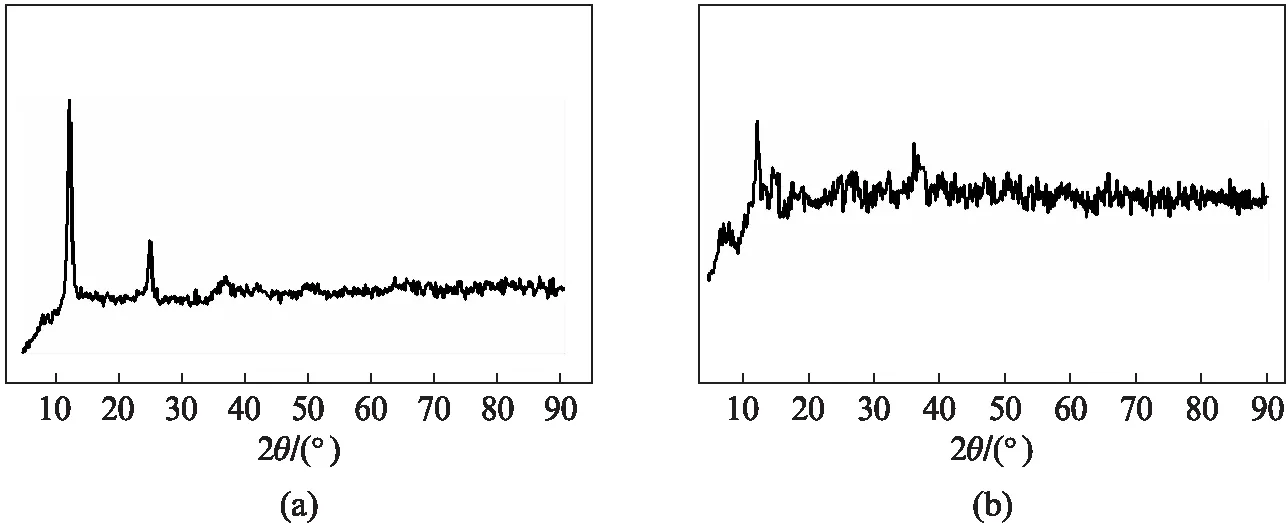
图1 (a) 层状δ-MnO2前驱体与(b) NaxMnO2嵌入化合物的XRD图Fig.1 XRD patterns of layered δ-MnO2 precursor (a) and NaxMnO2 intercalation compound (b)
2.2 NaxMnO2材料的形貌和元素组成分析
图2是NaxMnO2不同放大倍数的SEM图.

图2 纳米NaxMnO2嵌入化合物的SEM图Fig.2 The SEM images of nanorods NaxMnO2 intercalation compound

图3 纳米Na0.32MnO2的EDS图Fig.3 EDS patterns of Na0.32MnO2 nanorods
从图2(a)中可以看出,样品分布较均匀,但有一定团聚现象;在倍数放大至刻度1μm时(图2(b)),可以观察到材料为明显的纳米棒状结构,其直径不到100nm,这表明实验制得的NaxMnO2是纳米材料,结晶度良好.由于纳米材料表面吉布斯自由能大,容易发生团聚现象,这与图2(a)所示结果相一致.
图3是纳米NaxMnO2的EDS图,由图可知,样品出现了明显的Na、Mn和O元素的特征峰,表明所制样品含有Na元素,是NaxMnO2嵌入化合物.由图3中的NaxMnO2的能谱数据,可进一步确定x为0.32,即样品的化学式为Na0.32MnO2.
2.3 纳米Na0.32MnO2材料的电化学性能测试
2.3.1 循环伏安(Cyclic Voltammetry, CV)性能测试
图4是Na0.32MnO2嵌入化合物在0.5mol·L-1Na2SO4和K2SO4电解液中不同扫描速率下的CV曲线.由图4(a)可知,Na0.32MnO2材料在Na2SO4电解液中出现了较明显的氧化还原峰,这主要是因为OMS-5-MnO2宿主具有大小为0.46nm×0.92nm的隧道结构,电解质离子Na+可在其中发生嵌入/脱嵌反应;而Na0.32MnO2材料在K2SO4电解液中的CV曲线虽表现出氧化还原峰特性,但是即使在低扫速下CV曲线也严重扭曲变形,这表明电解质离子K+不容易发生嵌入/脱嵌反应.
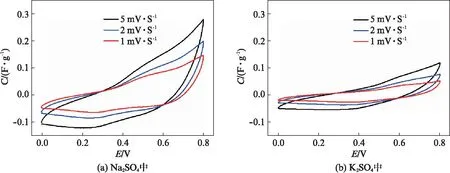
图4 纳米Na0.32MnO2在0.5 mol·L-1 Na2SO4和K2SO4电解液中的循环伏安曲线Fig.4 Cyclic voltammograms curves of Na0.32MnO2 nanorods in 0.5 mol·L-1 Na2SO4 and K2SO4 electrolytes
在相同扫描速率下,纳米Na0.32MnO2嵌入化合物在Na2SO4电解液中CV曲线围成的面积要比在K2SO4电解液中的大,这意味着Na0.32MnO2在Na2SO4电解液中具有更大的比电容特性[15].计算结果显示,在1mV·s-1时,Na0.32MnO2在0.5mol·L-1Na2SO4和K2SO4电解液中的比电容大小分别为79.7和31.1F·g-1.这是因为电解质Na+的半径要小于K+,更容易在材料的隧道结构中发生嵌入/脱嵌反应;同时,Na0.32MnO2嵌入化合物的晶体结构中嵌入了Na+,电极反应时缩短了电解质离子Na+的传输时间,提高了电极中活性物质的利用率[16].
2.3.2 恒流充放电(Galvanostatic Charge-Discharge, GC)性能测试
图5是纳米Na0.32MnO2在0.5mol·L-1Na2SO4和K2SO4电解液中不同电流密度下的GC曲线.

图5 纳米Na0.32MnO2在0.5 mol·L-1 Na2SO4和K2SO4电解液中的恒流充放电曲线Fig.5 Galvanostatic charge-discharge curves of nano Na0.32MnO2 in 0.5 mol·L-1 Na2SO4 and K2SO4 electrolytes at different current density
由图可知,电极材料在两种电解液中的GC曲线是偏离直线型的曲线而表现出赝电容特性[17],这与材料的CV曲线是一致的.对比图5(a)和(b)发现,在相同的电流密度下,纳米Na0.32MnO2在Na2SO4电解液中的放电时间要远大于在K2SO4电解液中的放电时间,表明材料在Na2SO4电解液中的比电容要远高于在K2SO4电解液中的比电容.这与CV曲线所围面积是一致的.另外,随着电流密度的增大,在两种电解液中的放电时间不同程度的减少;这主要是电流密度影响着电解质离子如Na+、K+在电极反应中的迁移速率和电导率,致使电化学反应和放电时间受到不同程度的限制[18].
2.3.3 交流阻抗性能与循环寿命
交流阻抗(Eectrochemical Impedance Spectroscopy, EIS)是研究电极反应和界面电化学反应的一种重要的测量技术.图6是纳米Na0.32MnO2材料的EIS测试和循环性能测试.
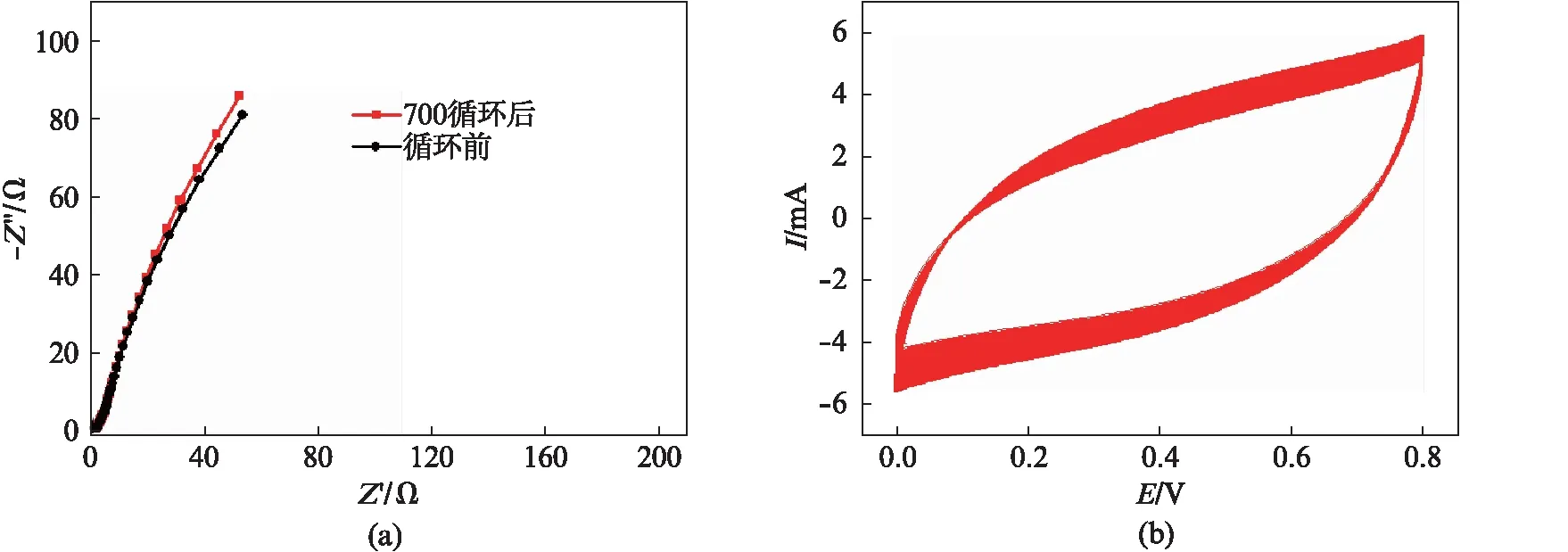
图6 纳米Na0.32MnO2电极的EIS和CV测试Fig.6 The EIS and CV test of nano Na0.32MnO2 electrode(a) 700个循环前后的EIS图谱;(b) Na0.32MnO2电极在0.5mol·L-1Na2SO4中的循环伏安曲线
图6(a)是纳米Na0.32MnO2在0.5mol·L-1Na2SO4电解液中700个循环前后的EIS图谱,交流信号振幅为5mV,频率范围为0.01~100kHz.由图可得,在低频端没有出现圆弧,意味着纳米Na0.32MnO2在Na2SO4电解液中的转移电阻很小,在低频端倾斜直线的角度大于45°,表明Na0.32MnO2电极材料具有典型的电容特性;在700个循环前后等效串联电阻(2.1Ω)在循环前后没有发生变化,曲线的重现性良好,意味着Na0.32MnO2电极材料具有良好的循环稳定可逆性[19].循环性能是评价电极材料的稳定性能的另一重要参数,图6(b)是纳米Na0.32MnO2在0.5mol·L-1Na2SO4电解液中的700次CV曲线,在循环过程中,CV曲线重现性良好,这意味着该纳米Na0.32MnO2在Na2SO4电解液中充放电性能稳定、循环可逆性好和库伦效率高[10].
3 结 论
二氧化锰是超级电容器的重要电极材料,不同的晶型表现出不同的电化学性能.本论文采用溶液法制得层状δ-MnO2前驱体,进而以Na+为嵌入离子源,采用水热沉积法合成出以OMS-5-MnO2为宿主的纳米Na0.32MnO2嵌入化合物,研究了其在0.5mol·L-1Na2SO4和K2SO4电解液中的电化学性能.研究结果表明,纳米Na0.32MnO2在0.5mol·L-1Na2SO4电解液中表现出良好的电容特性、循环稳定性和可逆性.该研究结果亦或为后续更优性能的MnO2电极材料研究及其在超级电容器中应用提供帮助.

